文章信息
- 刘晓雷, 张莉, 刘志东, 刘洋, 胡利民, 张炜
- LIU-Xiao lei, ZHANG Li, LIU-Zhi dong, LIU Yang, HU-Li min, ZHANG wei
- β-环糊精对丹酚酸B肠黏膜透过性的促进作用研究
- Study on the effects of beta cyclodextrin on improving the permeability of salvianolic acid B passing through intestinal mucosa
- 天津中医药, 2016, 33(1): 47-52
- Tianjin Journal of Traditional Chinese Medicine, 2016, 33(1): 47-52
- DOI: 10.11656/j.issn.1672-1519.2016.01.12
-
文章历史
- 收稿日期: 2015-10-07
2. 天津中医药大学中药学院, 天津 300193;
3. 武安市第一人民医院, 武安 056300
丹参多酚酸是由丹参中提取的各种丹酚酸的混合物。丹酚酸B为丹参多酚酸中主要的有效成分,活性最强,含量最高(约占60%),经证实其具有多方面的药理活性[1, 2],但其肠道透过性差,是造成其生物利用度低的主要原因[3]。 环糊精可以通过降低细胞质膜的胆固醇的量,影响细胞间的紧密连接蛋白,从而打开紧密连接处的紧密连接,来促进药物吸收[4]。故本文拟用β-环糊精为促渗剂以期提高丹酚酸B透过肠黏膜的能力。
1 实验仪器、材料和动物 1.1 实验仪器尤斯灌流室(美国生理仪器公司,其中数据采集系统为ADInstraments Pty Ltd);高效液相系统紫外检测器(岛津,型号:SPD-20A);Milli-Q超纯水系统(Milli-pore,美国);水浴锅(上海精宏实验设备有限公司,DKB-501A);Deltta 320 pH计(Mettler Toledo,瑞士);高速冷冻离心机(Hettich Mikro 220RS/N);震动搅拌器(金怡XH-C);分析天平(METTLER TOLEDO XS 205 max. 81 g/220 g,d=0.01 mg/0.1 mg));移液器(eppendorf 1000,100 μL)。
1.2 实验材料丹参多酚酸冻干粉针剂(天士力集团,批号:20121101);丹酚酸B对照品(天津一方科技有限公司,98%);β-环糊精(安徽山河药辅);乙腈、甲醇(天津市康科德科技有限公司,色谱纯);甲酸(色谱纯,美国 MREDA公司,批号:220120);无水磷酸二氢钠(天津化学制剂公司,分析纯);磷酸二氢钾、葡萄糖(天津市风船化学试剂科技有限公司);水合氯化钙、氯化钠、氯化钾、碳酸氢钠、氯化镁(天津市化学试剂批发公司,分析纯)。
1.3 实验动物健康SD大鼠,雄性,大鼠体质(250±10) g,饲养于动物房,动物室温度:(25±2) ℃,相对湿度:(50±2) ℃,由北京华阜康生物科技有限公司(质量检测单位:中国医学科学院医学实验动物研究所),合格证号:SCXK(京)2014-0004,相关研究遵照动物实验原则进行。
2 实验方法 2.1 溶液配置 2.1.1 K-R液配置K-R液由:117 mmol/L NaCl,4.7 mmol/L KCl,1.2 mmol/L MgCl2,1.2 mmol/L NaH2PO4,25 mmol/L NaHCO3,2.5 mmol/L CaCl2,11 mmol/L葡萄糖组成。配制时,先制作KCl,CaCl2,MgCl2,NaHPO4的20倍浓度的储备溶液,使用时再稀释加NaCl,NaHCO3和葡萄糖制备而成。给此溶液通气(95%O2和5%CO2的混合气体)15 min,氧气饱和pH值变为7.2~7.4[5]。储备溶液可以在冰箱中保存1个月。
2.1.2 药物溶液配置将供试液分为4组,分别为丹酚酸B溶液组和加入低、中、高浓度β-环糊精的丹酚酸B组。称取12.17 mg丹参多酚酸溶于30 mL去离子水即得200 μg/mL丹酚酸B供试液;称取12.17 mg丹参多酚酸和38.4 mg β-环糊精溶于30 mL去离子水即得低浓度促渗剂供试液(β-环糊精质量浓度为0.13%)组;称取12.17 mg丹参多酚酸和192 mg β-环糊精溶于30 mL去离子水即得中浓度促渗剂供试液(β-环糊精质量浓度为0.65%)组;称取12.17 mg丹参多酚酸和384 mg β-环糊精溶于30 mL去离子水即得高浓度促渗剂供试液(β-环糊精质量浓度为1.3%)组。
2.2 大鼠肠段的选择及肠黏膜的剥离雄性SD大鼠,禁食16~18 h后,3%戊巴比妥钠腹腔注射(12 mL/kg)麻醉,选择小肠(十二指肠、空肠、回肠)以及结肠为考察肠段。沿腹中线打开腹腔,自幽门1 cm处往下10 cm止为十二指肠,自幽门15 cm处往下10 cm止为空肠,从盲肠上行20 cm开始往上10 cm止为回肠,盲肠下2 cm去除,接着的6 cm为结肠。用生理盐水清洗实验肠段,迅速置入K-R缓冲液中冰浴培养5 min,每部分实验肠段分别剪取7~9 cm长的部分,迅速剥离并去除浆膜侧的浆膜层,将已剥除浆膜层的同肠段肠黏膜分为两组固定在样品夹中,一组夹在丹酚酸B溶液组灌流池中,另一组夹在含β-环糊精促渗剂的灌流池中,扩散室的有效面积为0.5 cm2[6]。
2.3 尤斯灌流室实验 2.3.1 尤斯灌流室系统组成尤斯灌流池系统主要由三部分组成:尤斯室、电压电流钳、数据采集与分析系统。另外有配套系统:包括恒温水浴箱、5% CO2+95% O2混合气体循环系统等[7]。恒温水浴箱的 技术参数,功耗为1kW,水泵流速为6 L/min,恒温波动小于0.5 ℃。尤斯室见图1。

|
| A:丹酚酸B标准品;B:空白肠液;C:β-环糊精 图1 尤斯灌流室示意图 Fig.1 Schematic diagram of Ussing chamber |
K-R溶液电阻调零后(消除溶液电阻对肠组织的影响)根据分组情况,黏膜侧为给药侧,加入5 mL相应药物供试液,浆膜侧为接收侧加入5 mL K-R缓冲液。其中1、3、5、7通道加入丹酚酸B溶液,2、4、6、8通道加入含促渗剂β-环糊精的丹酚酸B溶液。扩散池的两边均通入混合气体(95% O2,5% CO2),并于37.5 ℃水浴恒温维持肠黏膜的生物活性。加入药物溶液和K-R缓冲液后,需要10~15 min使电生理参数稳定下来,电生理参数稳定下来后开始计时[8],并每隔30 s给肠段一个间隔0.2 s,强度为5 mV的刺激。分别在开始计时后的30、60、90、120、150、180 min时,于接收侧取样0.5 mL,同时立即补充等温度等体积的K-R缓冲液。取得的0.5 mL样品于13 000 r/min离心15 min,取上清液,HPLC测定药物。
2.4 数据处理单位面积累积透过量Qtn 可由下式求算:
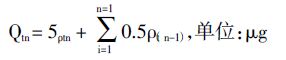
其中,ρtn为设计时间点扩散池接收侧的药物质量浓度;0.5和5分别表示取样体积(mL)和加入的药物供试液的体积(mL)。 表观渗透系数Papp计算公式为:
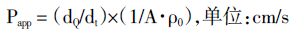
其中dQ/dt表示稳态时,时间-累积透过量线性回归所得的斜率;A为有效渗透面积(0.5cm2),ρ0为加入给药侧初始药物供试液的质量浓度。
采用SPSS 18.5软件进行统计学分析,实验数据采用单因素方差和t-检验的方法来比较。
3 实验结果 3.1 分析方法建立 3.1.1 色谱条件Agilent ZORBAX SB-C18(5 μm,4.6×150 mm)色谱柱,流动相为有机相为乙腈-甲醇(5∶2),水相为0.2%甲酸水,有机相与水相比例为35∶65(V∶V),流速为1.0 mL/min,柱温为30 ℃,检测波长为288 nm,进样量为20 μL。
3.1.2 标准曲线绘制精密称取丹酚酸B标准品(1.64 mg)溶于100 mL容量瓶,得到浓度为16.4 μg/mL的母液,母液吸取5~10 mL容量瓶得到8.2 μg/mL对照品溶液,母液吸取10~100 mL容量瓶得到1.64 μg/mL,母液吸取2~50 mL容量瓶得到0.656 μg/mL对照品溶液,母液吸取1~100 mL容量瓶得到0.164 μg/mL对照品溶液。按照上述色谱条件,进样20 μL,记录峰面积,以样品色谱峰面积A对浓度C(μg/mL)进行线性回归,得标准曲线,回归方程为C=1.664 6×104A-7.630 3×102,r=0.999 9,丹酚酸B在0.164~16.4 μg/mL范围内线性良好[9]。
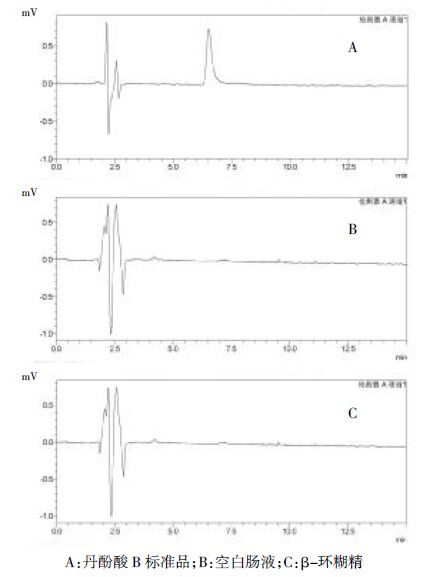
3.1.3 专属性考察分别取丹酚酸B标准品溶液、空白肠液、β-环糊精溶液进样,在上述色谱条件下分别测定,色谱图见图2。 由图2可知,空白肠液和β-环糊精在此色谱条件下对丹酚酸B测定无干扰。
|
| A:丹酚酸B 标准品;B:空白肠液;C:β-环糊精 图2 HPLC色谱图 Fig.2 HPLC chromatogram |
选取8.200、1.640、0.656 μg/mL 3个浓度的标准品溶液,于1天内重复测定5次,计算日内相对标准偏差;连续测定3天,计算日间相对标准偏差。实验结果,日内、日间相对标准偏差均小于3%,精密度符合方法学要求。结果见表1。
| 浓度(μg/mL) | n | 日内精密度 | 日间精密度 | ||
| 平均值(μg/mL) | RSD% | 平均值(μg/mL) | RSD% | ||
| 0.656 | 5 | 0.656±0.06 | 1.12 | 0.656±0.12 | 2.30 |
| 1.640 | 5 | 1.640±0.19 | 1.68 | 1.640±0.22 | 1.14 |
| 8.200 | 5 | 8.200±0.44 | 1.31 | 8.200±0.48 | 1.23 |
取8.200、1.640、0.656 μg/mL 3个浓度的标准品溶液各1份,用HPLC法测定丹酚酸B的浓度,测定方法回收率。结果见表2。
| x±s | ||||||||
| 浓度(μg/mL) | n | 回收率% | 平均值(x±s,%) | RSD(%) | ||||
| 1 | 2 | 3 | 4 | 5 | ||||
| 0.656 | 5 | 100.20 | 100.15 | 100.22 | 100.10 | 99.98 | 100.88±1.10 | 1.11 |
| 1.640 | 5 | 103.16 | 103.82 | 99.98 | 102.17 | 102.66 | 101.82±1.83 | 1.78 |
| 8.200 | 5 | 101.36 | 98.71 | 101.56 | 102.11 | 103.13 | 100.05±1.25 | 1.24 |
考察丹酚酸B于12 h内在K-R试液中的稳定性,结果见表3。
| 时间(h) | 0 | 1 | 2 | 4 | 6 | 8 | 10 | 12 |
| K-R试液浓度(%) | 100 | 100 | 98.32 | 90.08 | 85.66 | 78.94 | 60.60 | 55.77 |
| Vc+K-R试液浓度(%) | 100 | 100 | 99.10 | 96.75 | 95.64 | 94.66 | 92.83 | 91.77 |
结果显示,12 h后丹酚酸B仅为初始浓度的55.77%。查文献可知[10],丹酚酸B在酸性介质中稳定,加入浓度为1‰的维生素C之后,12 h后的浓度为初始浓度的91.77%,丹酚酸B比较稳定,满足实验要求。
3.2 β-环糊精对丹酚酸B促渗作用 3.2.1 累积透过量比较灌流池的1、3、5、7通道加入200 μg/mL丹酚酸B溶液,2、4、6、8通道加入β-环糊精浓度为0.13%的丹酚酸B溶液。两组溶液在十二指肠、空肠、回肠、结肠的累积透过量结果如图3所示。
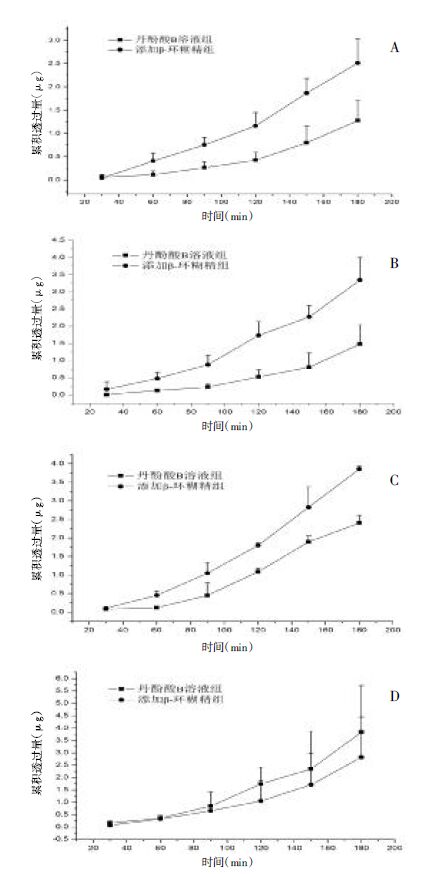
|
| 注:添加β-环糊精组vs.丹酚酸B溶液组:*P<0.05 图3 丹酚酸B累积透过量曲线(x±s, n=4) Fig.3 The cumulated amount curve of salvianolic acid B (x±s, n=4) |
如图3所示,添加促渗剂β-环糊精(β-环糊精浓度为0.13%)的丹酚酸B溶液组与丹酚酸B溶液组(丹酚酸B浓度为200 μg/mL)比较,在十二指肠、空肠、回肠3个肠段的累积透过量(n=4)都有明显提高。但是,添加β-环糊精组在结肠的累积透过量比正常丹酚酸B溶液组低。
3.2.2 表观渗透系数(Papp)比较丹酚酸B溶液组与添加β-环糊精的丹酚酸B溶液组在十二指肠、空肠、回肠的表观渗透系数见图4。
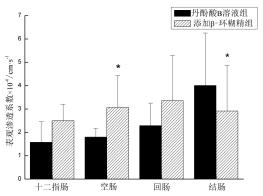
|
| 图4 丹酚酸B在不同肠段的表观渗透系数(x±s,n=4) Fig.4 The apparent permeability coefficient of salvianolic acid B in different intestine segments (x±s,n=4) |
由图4可知,添加β-环糊精(质量浓度0.13%)的丹酚酸B组在十二指肠、空肠、回肠的表观渗透系数均比丹酚酸B溶液组高,而结肠的结果相反。实验结果表明,丹酚酸B在4个肠段的透过情况为,以Papp值表示(cm/s):Papp十二指肠(1.46±1.60)×10-6<Papp空肠(1.74±1.30)×10-6<Papp回肠(2.28±0.97)×10-6<Papp结肠(3.50±2.00)×10-6,结果与文献[11]报道相一致。
3.2.3 电阻变化率比较紧密排列的上皮细胞和细胞间质组成上皮组织,其具有极性和紧密连接[7]。其中,紧密连接的形状和渗透性能够决定上皮组织的完整性及对物质的跨细胞电阻(TEER)[12]。初始电阻值为没加供试液之前肠段稳定下来的电阻值,丹酚酸B溶液组与添加β-环糊精的丹酚酸B溶液组的电阻变化率见图5。
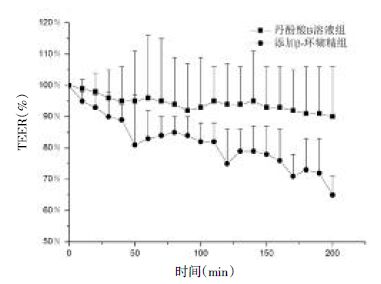
|
| 图5 肠段电阻变化率(x±s,n=4) Fig.5 The resistance change rates of intestinal segments (x±s,n=4) |
如图5所示,180 min后加丹酚酸B溶液组的肠段的电阻基本上没变化,为初始电阻值的90%去。而加β-环糊精组的肠段的电阻降为初始电阻值的65%。组织阻抗的降低可能与β-环糊精能作用于紧密连接蛋白,打开细胞旁路有关系[4]。
3.2.4 不同浓度促渗剂对丹酚酸B促渗作用比较丹酚酸B溶液组与低(0.13%)、中(0.65%)、高(1.3%)浓度β-环糊精促渗剂组的表观渗透系数比较,结果见图6。 比较丹酚酸B溶液组与低(0.13%)、中(0.65%)、高(1.3%)浓度β-环糊精促渗剂组的表观渗透系数发现[13],β-环糊精促渗剂的质量浓度与促渗效果并非呈正比关系,当β-环糊精的浓度从0.13%升到1.3%,丹酚酸B的表观渗透系数随着β-环糊精浓度升高而降低。质量浓度为0.13%的β-环糊精促渗效果优于质量浓度0.65%、1.3%的β-环糊精的促渗效果,甚至当β-环糊精浓度到1.3%时对于丹酚酸B溶液基本上没有促渗作用,机理有待进一步研究。
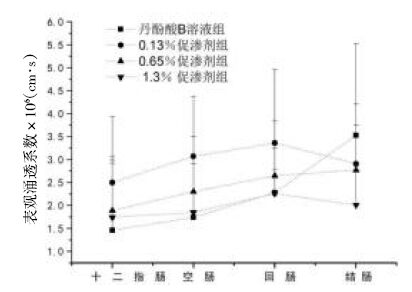
|
| 图6 不同浓度促渗剂对丹酚酸B促渗作用(x±s,n=4) Fig.6 Penetration effects of different concentrations of penetration enhancers on Salvianolic acid B(x±s,n=4) |
用恒温加速法考察了丹酚酸B在不同pH缓冲液下的稳定性,结果发现丹酚酸B在pH=1~7范围内,酸性越强,稳定性越好[10]。本实验采用K-R试液,pH在7~8之间,在此实验条件下丹酚酸B的含量会下降,对实验结果造成干扰。据报道,维生素C是一种水溶性维生素,水溶液呈酸性,而且是一类强抗氧化剂,具有保护其它抗氧化剂的作用[14]。因此,在K-R溶液中加入浓度为1‰的维生素C,使丹酚酸B在K-R中相对稳定,满足实验要求。
4.2 促渗方法的选择使用以打开紧密连接为机理的促渗剂时必须谨慎,由于促渗剂在体内的浓度和释放时间目前不可完全控制,因此可能在胃肠道某个部位中形成点状腐蚀;另外,促渗剂加入体系中后,TJ处于松弛状态,通道变宽至0.5~3 nm,在此情况下,细菌、病毒或内源性毒素可能透过防御体系进入体内循环。据报道,利用几种促渗剂的联合使用,或具有稳定增溶或复合作用的辅料与促渗剂联合应用的方法,通过各自不同的作用特点的兼顾,发生协同作用,这样既有利于减少药品用量或者降低毒副作用,也有利于制剂的设计[15]?笃谘芯恐锌煽悸橇街执偕亮靡云诖俳し铀酈在肠黏膜的透过性。
4.3 考察药物肠吸收机制的方法选择近年来研究药物肠吸收机制的方法主要有扩散池法、单向灌流法、单层细胞模型法和翻转肠囊法[16]。尤期室灌流技术是研究药物在胃肠道吸收情况,常用的体外研究方法之一。此方法通过与循环水浴锅相连的恒温装置来保持灌流室温度,并且通过气体通道向灌流室通入混合气,从而最大程度的达到保持灌流室中离体组织的活性和完整性的作用。尤期室灌流方法弥补了以往研究中的一些缺陷,例如:使用Caco-2单层细胞模型法缺乏黏膜层的透过研究,而黏膜层为药物主要吸收屏障之一;另外,翻转肠囊法容易影响通透性,在翻转肠囊后较易造成细胞形态发生改变[17]。此外,尤期室灌流方法可以分别考察药物在不同特定肠段的吸收和透过情况,并且通过对肠段的浆膜层进行剥离,与药物在肠部的吸收情况更接近,因此该模型常用于考察促渗剂作用的部位差异及筛选促渗剂种类[18]。
4.4 电生理参数测量结果讨论尤期室灌流对电生理参数测量结果表明,以未加供试液之前肠段的稳定电阻值为初始电阻值,180 min后,加丹酚酸B溶液组的肠段的电阻基本上没变化,为初始电阻值的90%。而加β-环糊精组的肠段的电阻值降为初始电阻值的65%。此种组织阻抗降低的现象产生的原因可能与β-环糊精能作用于紧密连接蛋白,打开细胞旁路有关系。据报道,细胞间紧密连接在小肠中分布面积较小,只占整个小肠面积的0.1%,因此实验结果显示,组织阻抗的降低幅度并不是很大[15]。
4.5 不同质量浓度促渗剂的促渗作用考察在本实验中,促渗剂的质量浓度与促渗效果并非呈简单的正比关系,丹酚酸B的表观渗透系数随着β-环糊精浓度升高而降低,当促渗剂浓度超过一定值时,促渗效果反而差,目前此机制尚不明确。分析其原因可能是当β-环糊精的质量浓度较低时,促渗作用占主导作用;当β-环糊精质量浓度增加到一定程度时,由于β-环糊精自身能作用于紧密连接蛋白,打开细胞旁路,因此,β-环糊精通过细胞旁路吸收,与药物吸收形成竞争,当这种竞争作用占主导作用时,反而使药物透过量降低[19],此推论仍需进一步验证。
| [1] | 于金玲. 丹酚酸B药理作用研究进展[J].天津药学, 2012, 24(3):64-68. |
| [2] | 刘 嘉,李俊松,狄留庆,等. 丹酚酸B及其磷脂复合物在SD大鼠的生物利用度研究[J].中国药学杂志,2010,45(18):1408-1401. |
| [3] | 朱金墙,闫 晨,康立源. 丹酚酸B的稳定性及其降解机理研究进展[J].中国中医药信息杂志,2010,17(12):113-115. |
| [4] | 徐晓琰,恽 菲,狄留庆,等. 环糊精包合药物胃肠道转运过程及机制研究进展[J]. 中草药, 2012,43(10):2062-2065. |
| [5] | Cardinali A, Rotondo F, Minervini F, et al. Assessment of verbascoside absorption in human colonic tissues using the Ussing chamber model[J]. Food Research International, 2013, 54(1):132-138. |
| [6] | 赵博欣,孙亚彬,段 炼,等. 应用Ussing Chamber技术评价芹菜素与柚皮素经大鼠肠黏膜透过特征[J].中国药学杂志, 2011,46(20):1581-1586. |
| [7] | 孙志洪,贺志雄,张庆丽,等. 尤斯灌流系统在动物胃肠道屏障及营养物质转运中的应用[J]. 动物营养学报,2010,22(3):511-518. |
| [8] | 黎国富,杨 劲,华小懿,等. Ussing Chamber模型研究甘草酸二铵经大鼠肠黏膜的转运和代谢[J].中国中药杂志, 2010,35(17):2261-2266. |
| [9] | 郭秀君,刘志东,黄 瑜,等. 丹酚酸B立方液晶纳米粒的制备及大鼠在体肠吸收[J]. 天津中医药大学学报,2014,33(4):177-180. |
| [10] | 张春光,崔翰明,张秋燕,等. 丹参提取物中的丹酚酸B在不同pH条件下的稳定性研究[J]. 中国实验方剂学杂志,2009,15(1):3-5. |
| [11] | 刘 睿,刘志东,张伯礼,等.丹 酚酸B大鼠在体肠吸收研究[J].中国新药杂志, 2008,17(10):852-854+860. |
| [12] | 刘晓雷,张 莉,顾 星,等. Ussing chamber技术在药物肠吸收方面的应用进展[J]. 中国新药杂志,2015,24(6):644-648. |
| [13] | 蔡文贺,林德贵. 不同浓度氮酮、薄荷醇对盐酸特比萘芬体外经皮渗透作用的影响[J]. 畜牧兽医学报,2009,40(8):1249-1252. |
| [14] | 莫凤奎,朱澄云,黄松鹤,等. 维生素E和维生素C对大豆磷脂脂质体的抗氧化作用[J]. 中国药物化学杂志,1997,7(2):46-49. |
| [15] | 陈水娟.二甲基-β-环糊精和壳聚糖提高难溶性药物BMCP25口服生物利用度研究[D].上海:华东理工大学,2012. |
| [16] | 段 炼.辣椒素的肠道转运特性与TRPV1通道及多药耐药蛋白间的关系[D].广州:南方医科大学,2013. |
| [17] | 单进军,狄留庆,吴 皓. 口服吸收模型在中药研究中的应用进展[J]. 南京中医药大学学报,2007,23(4):270-272. |
| [18] | 李光华. 口服药物吸收的研究进展[J]. 天津药学, 2014,26(2):69-71. |
| [19] | 贾立华,付 聪,丁桥兰,等. DM-β-CD对盐酸二氢埃托啡离体鼻黏膜渗透的影响[J]. 中国新药杂志,2007,16(7):551-553. |
2. College of Traditional Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China;
3. First People's Hospital in Wu'an, Wu'an 056300, China
 2016, Vol. 33
2016, Vol. 33