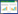文章信息
- 苏冷高娃, 陈书, 张耀丹, 杨坤宝, 白颖慧, 鲁碧楠, 庞宗然
- SU Leng-gao-wa, CHEN Shu, ZHANG Yao-dan, YANG Kun-bao, BAI Ying-hui, LU Bi-nan, PANG Zong-ran
- 苦瓜-人参预防给药对高脂诱导肥胖小鼠胰岛素抵抗的影响
- Effect of preventive administration of Momordica charantia-Panax ginseng herb on insulin resistance in high fat diet-induced obesity mice
- 天津中医药, 2016, 33(10): 604-609
- Tianjin Journal of Traditional Chinese Medicine, 2016, 33(10): 604-609
- http://dx.doi.org/10.11656/j.issn.1672-1519.2016.10.08
-
文章历史
- 收稿日期: 2016-05-17
随着人们生活方式与饮食结构的改变,肥胖发病率明显增多,由此引发了糖尿病(DM)等代谢性疾病,严重危害人类健康,已成为全球性的健康问题。胰岛素抵抗(IR)是肥胖与2型糖尿病(T2DM)发生过程中共同的病理生理机制,也是一项评判肥胖是否向T2DM发展的指标[1]。因此,改善肥胖及IR成为防治T2DM的关键所在。苦瓜、人参作为传统中药其单味药或复方常被用来干预和治疗T2DM,有研究显示苦瓜、人参可改善胰岛素抵抗[2-5],但临床上很少单独使用苦瓜、人参治疗IR,并且苦瓜、人参改善IR的有效性和安全性的系统性评价也鲜见报道。因此,本研究采用高脂诱导肥胖IR小鼠模型,探讨苦瓜、人参及苦瓜-人参对药预防给药对肥胖IR的影响。
1 材料 1.1 实验动物C57BL/6J小鼠60只,SPF级,雄性,6周龄,空腹体质量(20±1)g,北京华阜康生物科技股份有限公司提供,许可证号:SCXK(京)2014-0004。所有实验小鼠均于12 h/12 h光暗周期下,自由摄取食物和水。
1.2 主要药品及试剂人参,吉林产地,购自北京三和药业有限公司;鲜苦瓜,北京房山区,购自北京市天福园种植中心;盐酸二甲双胍片,规格0.25 g,北京双鹤药业股份有限公司;葡萄糖注射液,规格20 mL:10 g,湖南科伦制药有限公司;甘油三酯(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、葡萄糖(GLU)试剂,中生北控生物制剂科技股份有限公司;小鼠胰岛素酶联免疫吸附法(ELISA)检测试剂盒,冬歌生物技术有限公司;Research Diets Inc公司DIO(diet induced obesity)系列饲料,高脂饲料(HFD)为45kcal%啮齿类D12451,低脂饲料(LFD)10kcal%D12450H,HFD及其对照LFD供能比例见表 1。
| 种类 | LFD | HFD | |||
| gm% | kcal% | gm% | kcal% | ||
| 蛋白质 | 19.20 | 20 | 24.00 | 20 | |
| 碳水化合物 | 67.30 | 70 | 41.00 | 35 | |
| 脂肪 | 4.30 | 10 | 24.00 | 45 | |
| 其他 | 9.20 | 0 | 11.00 | 0 | |
| 共计 | 100.00 | 100 | 100.00 | 100 | |
| kcal/gm | 3.85 | - | 4.73 | - | |
血糖试纸、血糖仪(强生稳豪型),强生(中国)医疗器材有限公司;电子天平,YP2002N,上海菁海仪器有限公司;日立7020全自动生化分析仪,日立(中国)有限公司;多功能酶标仪,Synergy系列,美国伯腾仪器有限公司;荧光倒置显微镜,奥林巴斯(中国)有限公司;旋转蒸发器,RE-52A,上海亚荣生化仪器厂。
2 方法 2.1 苦瓜、人参、苦瓜-人参对药制备方法苦瓜:全苦瓜洗净去籽称质量,切片后放入榨汁机,取其液体冷藏保存;人参:粗碎成5 mm左右颗粒,加适量去离子水浸泡过夜,加10倍水冷凝回流提取两次,时间为1.5 h、1 h,过滤后收集提取液,于旋转蒸发器中浓缩后4 ℃保存备用。苦瓜-人参:取苦瓜、人参浓缩液体,按人参:苦瓜=1:10比例配置。
2.2 动物分组及给药方法以普通维持饲料适应性饲养5 d后,将60只C57BL/6J小鼠(SPF级)按随机数字表法分6组:空白对照组、模型组(HF组)、HF+苦瓜组、HF+人参组、HF+苦瓜-人参对药组、HF+二甲双胍组,每组10只。空白对照组饲以LFD,HF及各给药干预组饲以HFD,苦瓜、人参、苦瓜-人参对药、二甲双胍给药量分别为1.3 g/mL、0.13 g/mL、1.43 g/mL、0.25 g/kg,以上给药量均按体表面积折算小鼠每日给药量,空白对照、HF组对照溶剂为蒸馏水,给药体积按每周空腹体质量计算,灌胃给药,干预时间16周。
2.3 动态监测摄食量及空腹体质量每日测摄食量并记录,每周测空腹体质量,禁食时间为12 h。
2.4 口服葡萄糖耐量实验(OGTT)每隔4周,末次给药后,小鼠禁食不禁水12 h,称质量计算灌胃剂量(按2 g/kg给予25%的葡萄糖溶液),于空腹及糖负荷后15、30、60、90、120 min剪尾法取血,以强生血糖仪测定血糖值。
2.5 小鼠血清空腹血糖(FPG)、空腹血清胰岛素(FINS)及血脂水平测定全自动生化仪检测各组小鼠血清FPG、TG、HDL、LDL的水平。ELISA方法测定血清中FINS的水平。
2.6 IR评价指标稳态模式评估法(HOMA-IR)评价IR水平,计算法为FPG(mmoL)×FINS(mIU/L)/22.5;胰岛素敏感指数(ISI)为胰岛素敏感性评价指标, ISI=ln[1/(FPG×FINS)]。
2.7 取材并计算内脏脂肪指数干预16周,末次给药后禁食12 h眶静脉取血,室温静置2 h,3500 r/min离心12 min后取血清。处死后剖开腹腔,分离内脏脂肪(双侧肾周脂肪、睾周脂肪)及皮下脂肪,分别称量记录其湿重,计算内脏脂肪指数(内脏脂肪重量/小鼠空腹体质量×100)、皮下脂肪指数(皮下脂肪重量/小鼠空腹体质量×100)。以4%多聚甲醛固定睾周脂肪组织,以备后续检测。
2.8 小鼠脂肪细胞形态观察苏木精-伊红(HE)染色观察小鼠睾周脂肪细胞形态。
2.9 统计学分析所有数据经SPSS20.0软件分析处理,计量资料以均数±标准差(x±s)表示,两组间比较采用两样本均数的t检验;多组间比较采用单因素方差分析(one-way ANOVA),以P < 0.05表示差异有统计学意义。
3 结果 3.1 苦瓜、人参、苦瓜-人参对药对小鼠摄食量的影响各组摄食量随饲养时间均逐渐减少,周平均摄食量空白对照组>HF+苦瓜组>HF+二甲双胍组>HF+苦瓜-人参对药组>HF+人参组>HF组。见图 1。
|
| 图 1 各组小鼠单位体质量摄食量的影响 Fig. 1 Effects of drug intervention on the unit weight of food intake in mice of each group |
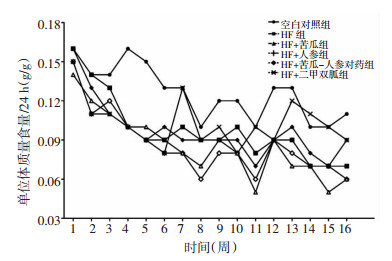
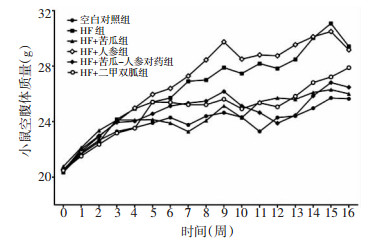
各组体质量增长比(与初始体质量比)见表 2,与空白对照组体质量增长18%比较HF组体质量增长32%,同时各给药干预组除HF+苦瓜组外体质量均增长20%以上。各组小鼠体质量及脂肪指数变化如图 2、3所示,与空白对照组比较,HF组体质量及皮下脂肪指数明显升高(P < 0.01,P < 0.001)。与HF组比较,HF+苦瓜组体质量及皮下脂肪指数均减少(P < 0.05,P < 0.01),而HF+苦瓜-人参对药组仅皮下脂肪指数明显减少(P < 0.001)。各组内脏脂肪指数无统计学差异。
| 组别 | 初始体质量(g) | HF16周体质量(g) | 体质量增加比(%) |
| 空白对照组 | 20.39 | 24.16 | 18 |
| HF组 | 20.35 | 26.89 | 32 |
| HF+苦瓜组 | 20.77 | 24.67 | 18 |
| HF+人参组 | 20.54 | 27.40 | 33 |
| HF+苦瓜-人参对药组 | 20.46 | 24.88 | 21 |
| HF+二甲双胍组 | 20.48 | 25.18 | 22 |
|
| 图 2 各组小鼠空腹体质量 Fig. 2 Body weight in mice with empty stomach of each group |
|
| 图 3 各组小鼠内脏、皮下脂肪指数(x±s) Fig. 3 Fat index of viscera and subcutaneous fat in mice of each group (x±s) 与HF组比较,***P<0.001,**P<0.01。 |
如图 4所示,与空白对照组相比,HF组血清中FPG水平显著升高(P < 0.05)。与HF组相比,HF+人参组FPG水平明显降低(P < 0.001)。组间血清HDL、LDL水平有升高趋势,但差异无统计学意义(P > 0.05)。
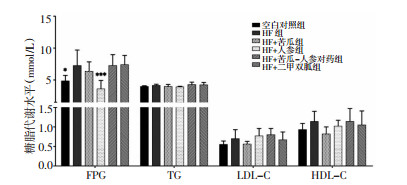
|
| 图 4 各组小鼠血清中糖脂水平(x±s) Fig. 4 Blood-glucose and lipid levels of serum in mice of each group (x±s) 与HF组比较,***P < 0.001,*P < 0.01。 |
如图 5所示,与空白对照组相比,HF组血清FINS水平均显著升高(P < 0.001),与HF组相比,HF+苦瓜-人参对药组、HF+二甲双胍组FINS水平均显著降低(P < 0.01)。
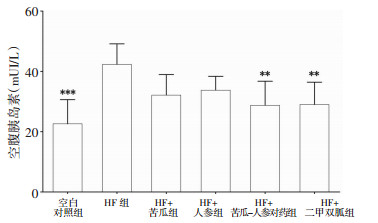
|
| 图 5 各组小鼠FINS水平(x±s) Fig. 5 FINS levels in mice of each graup(x±s) 与HF组比较,***P < 0.001,**P < 0.01。 |
OGTT考察各组糖耐量受损(IGT)情况,血糖随时间变化曲线如图 6上所示,计算曲线下面积(图 6下):HF组>空白对照组,差异无统计学意义,HF+人参组 < HF组(P < 0.001)。
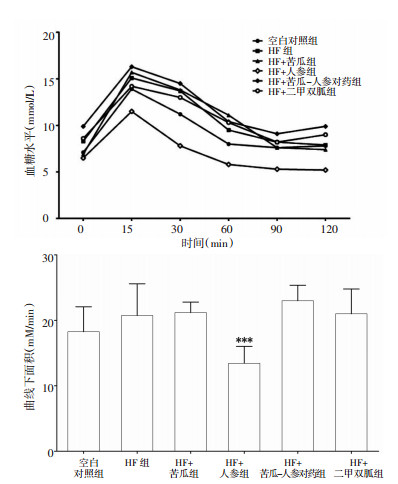
|
| 图 6 各组小鼠糖耐量(x±s) Fig. 6 Glucose tolerance in mice of each group(x±s) 与HF组比较,***P < 0.001。 |
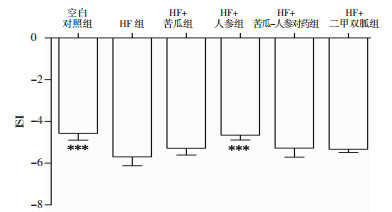
与空白对照组比较,HF组HOMA-IR水平明显升高(P < 0.001),而与HF组比较,HF+人参组HOMA-IR水平明显降低(P < 0.001),见图 7。HF组ISI低于空白对照组(P < 0.001),而HF+人参组较HF组ISI水平明显升高(P < 0.001),见图 8。
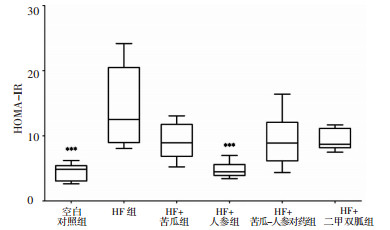
|
| 图 7 各组小鼠IR水平(x±s) Fig. 7 The level of insulin resistance in mice of each group(x±s) 与HF组比较,***P < 0.001。 |
|
| 图 8 各组小鼠ISI(x±s) Fig. 8 ISI in mice of each group (x±s) 与HF组比较,***P < 0.001。 |
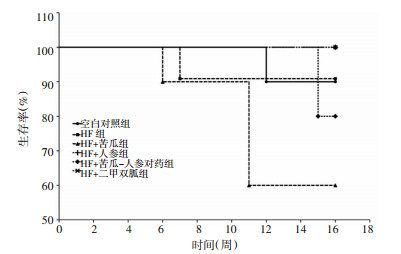
各组小鼠生存曲线如图 9所示,HF+人参、HF+二甲双胍组存活率最高(100%),HF+苦瓜组出现死亡时间最早、死亡动物数最多、生存率最低(60%)。
|
| 图 9 各组小鼠高脂饮食诱导16周后生存率 Fig. 9 16 weeks survival ratio of HF diets in mice of each group |
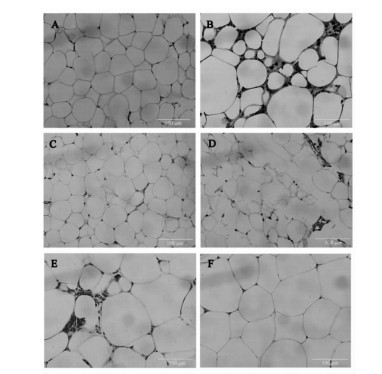
如图 10所示,空白对照组(A)脂肪细胞大小相近,排列紧密。HF组(B)脂肪细胞体积增大,排列不规则且疏散,细胞间有新生脂肪细胞,可见炎细胞浸润灶。HF+苦瓜组(C)脂肪细胞部分增大,排列紧实但不规则。HF+人参组(D)脂肪细胞大小不一,可见脂肪囊泡,扩张血管处可见新生脂肪及炎症细胞。HF+苦瓜-人参对药组(E)胞内脂质减少,细胞膜皱缩,细胞间可见新生脂肪细胞。HF+二甲双胍组(F)脂肪细胞体积增大,排列相对紧实,未见血管充血。
|
| 图 各组小鼠脂肪细胞形态(HE染色,×400) Fig. The form of adipocytes in mice of each group(HE staining, ×400) A.空白对照组; B.HF组; C.HF+苦瓜组; D.HF+人参组; E.HF+苦瓜-人参对药组; F.HF+二甲双胍组 |
近年肥胖及T2DM呈现出全球流行态势,肥胖和糖尿病的共同发病机制为胰岛素抵抗。有效控制肥胖、改善血脂紊乱,提高外周组织对胰岛素的敏感性,可以从源头上预防肥胖转化为T2DM及其并发症[6-8]。目前肥胖的临床治疗有生活方式的改变、药物及减肥手术[9-11]等,生活方式的改变依从性低;药物减肥因腹泻、抽筋、增加心血管风险等不良反应而不能长期使用,因此许多非处方药物已被美国食品药品监督管理局(FDA)禁止[12],且大部分药物通常停止用药后体质量会恢复。减肥手术一般术后维持难度较大。因此探讨能够长期服用的药食两用中药对维持体质量、维护减肥效果,预防肥胖胰岛素抵抗,并对延缓肥胖转化T2DM的研究十分必要,其应用前景广泛。
苦瓜(Momordica charantia L.)是药食两用植物,性寒味苦,入心脾胃、清热解暑、明目解毒之功效,果实可食用,富含皂苷、糖、苦瓜素、三萜类化合物等活性成分,具有降血糖、减肥、抗癌、抗病毒等功能特性[13-14]。苦瓜在糖尿病上的应用主要有降血糖、减肥、改善肥胖引起的胰岛素抵抗作用[15-18]。人参(Panax ginseng C. A. Mey)是中药上品,为大补元气、固脱生津的极品,用于神经衰弱、糖尿病、心血管疾病及身体虚弱等病症,现代药理研究表明人参具有调节免疫力、改善微循环、调节血糖等作用,其主要活性成分为多种皂苷类,在防治糖尿病及其并发症方面具有显著效果[19-22],网络药理学最新研究成果提示,人参皂苷改善胰岛素抵抗可能与AMPK通路、PI3K通路、JNK通路有关[23]。苦瓜、人参又是笔者前期研究成果菩达茶、菩人丹的主要成分,菩达茶(苦瓜、人参、绿茶)是前期实验研究中发现并上市的在调脂降糖方面疗效确切的药物[24-25]。苦瓜、人参是菩人丹的君药与臣药,菩人丹具有调节糖脂代谢紊乱、降低胰岛素抵抗的作用[26]。因此,本实验以苦瓜、人参为研究对象,考察其对肥胖胰岛素抵抗小鼠糖脂代谢、胰岛素敏感性及脂肪细胞形态的影响,进而系统评价苦瓜、人参单独使用与“一寒一热,一补一泻”配伍使用改善肥胖、胰岛素抵抗的不同特点。
高脂饮食是导致胰岛素抵抗、肥胖、T2DM的重要环境因素[27]。高脂诱导肥胖胰岛素抵抗(DIO-IR)动物模型对于探讨中医药防治肥胖及T2DM等代谢性疾病的发生具有重要意义。本实验成功复制出了肥胖胰岛素抵抗模型,与空白对照组比较,HF组小鼠表现出空腹体质量、皮下脂肪、FPG、FINS水平均显著升高,且HOMA-IR与ISI结果提示发生胰岛素抵抗,而在给予HFD同时药物干预的各组小鼠,以上特征的表现则不尽相同。OGTT、HOMA-IR及ISI结果表明人参修复肥胖小鼠糖耐量损伤、改善胰岛素抵抗效果最显著。苦瓜在小鼠减轻体质量、降低FPG方面的作用有优势。而在降低高脂诱导小鼠体质量及空腹胰岛素方面苦瓜-人参对药则更有优势,人参干预后小鼠体质量增加33%,而苦瓜-人参对药组体质量仅增加21%,且皮下脂肪指数明显降低,这可能与人参皂苷Rb1成脂作用[28]与苦瓜减少体内脂肪作用[29]相互拮抗导致的结果,但具体作用机理有待进一步研究,结果表明苦瓜-人参对药配伍使用能够改善因肥胖胰岛素抵抗而形成的代偿性胰岛素增加[30]。从睾周脂肪细胞形态上看,3组药物在不同程度上改善了肥胖小鼠的脂肪细胞形态,苦瓜能够改善脂肪细胞排列,人参对脂肪细胞增大改善作用显著,苦瓜-人参对药对减少胞内脂质有明显作用。
苦瓜-人参对药改善高脂诱导肥胖小鼠胰岛素抵抗的作用特点主要体现在预防体质量及皮下脂肪含量的增加,降低空腹胰岛素水平,虽然有一定疗效但其药效物质基础和作用机制尚不明确,除此之外苦瓜、人参配伍使用有否明显的药物相互作用,亦有待于进一步探明。
| [1] | Skoczen S, Wojcik M, Fijorek K, et al. Expression of the Central Obesity and Type 2 Diabetes Mellitus Genes is Associated with Insulin Resistance in Young Obese Children[J]. Exper Clin Endo Diab, 2015, 123 (4) : 252–259. DOI:10.1055/s-00000017 |
| [2] | Attele AS, Zhou YP, Xie JT, et al. Antidiabetic effects of Panax ginseng berry extract and the identification of an effective component[J]. Diabetes, 2002, 51 (6) : 1851–1858. DOI:10.2337/diabetes.51.6.1851 |
| [3] | Miura T, Itoh C, Iwamoto N, et al. Hypoglycemic activity of the fruit of the Momordica charantia in type 2 diabetic mice[J]. Journal of Nutritional Science & Vitaminology, 2001, 47 (5) : 340–344. |
| [4] | Cheng HL, Huang HK, Chang CI, et al. A cell-based screening identifies compounds from the stem of Momordica charantia that overcome insulin resistance and activate AMP-activated protein kinase[J]. Journal of Agricultural & Food Chemistry, 2008, 56 (16) : 6835–6843. |
| [5] | 张小华, 张汝学, 贾正平, 等. 中药及活性成分治疗胰岛素抵抗分子机制研究进展[J]. 中药材, 2007, 4 (4) : 493. |
| [6] | 克里斯托弗, 卡利亚尼, 弗雷德里克. 约翰·霍普金斯糖尿病指南:糖尿病的治疗与管理[M]. 北京: 科学技术文献出版社, 2015 |
| [7] | 甘立霞. 2型糖尿病基础研究中的难题与突破[J]. 第三军医大学学报, 2014, 36 (15) : 1543–1547. |
| [8] | 姜金鹏, 张俊杰, 秦鉴. 肥胖组织功能障碍在肥胖相关胰岛素抵抗中的作用[J]. 医学综述, 2015, 1 (6) : 23–25. |
| [9] | 张洪波, 万琪琪, 梁华, 等. 脂肪组织与胰岛素抵抗[J]. 中国细胞生物学学报, 2013, 32 (3) : 471–477. |
| [10] | Thomas JG, Bond DS, Sarwer DB, et al. Technology for behavioral assessment and intervention in bariatric surgery[J]. Sur Obe Rel Dis, 2011, 7 (4) : 548–557. DOI:10.1016/j.soard.2011.02.009 |
| [11] | Zhaoping Li, Maglione M, Tu W, et al. Meta-analysis: pharmacologic treatment of obesity[J]. Annals of Internal Medicine, 2005, 142 (7) : 532–546. DOI:10.7326/0003-4819-142-7-200504050-00012 |
| [12] | Kinch MS, Umlauf S, Plummer M. An analysis of FDA-approved drugs for metabolic diseases[J]. Drug Discov Today, 2015, 20 (6) : 648–651. DOI:10.1016/j.drudis.2015.02.002 |
| [13] | 吴茂玉, 李丹丹, 马晓燕. 苦瓜降血糖活性成分提取与评价方法研究进展[J]. 食品研究与开发, 2015, 36 (1) : 140–142. |
| [14] | 陈敬鑫, 张子沛, 罗金凤, 等. 苦瓜保健功能的研究进展[J]. 食品科学, 2012, 33 (1) : 271–275. |
| [15] | 屈玮, 陈彦光, 吴祖强, 等. 苦瓜提取物抑制3T3-L1脂肪细胞脂肪沉积研究[J]. 食品科学, 2014, 35 (5) : 188–192. |
| [16] | 董英, 钱希文, 白娟, 等. 苦瓜改善胰岛素抵抗功能与作用机制研究进展[J]. 食品科学, 2013, 34 (21) : 369–374. |
| [17] | 杨静玉, 王春明, 侯悦, 等. 苦瓜乙醇提取物对肥胖大鼠糖代谢和内脏脂肪的影响[J]. 中草药, 2012, 43 (10) : 2002–2008. |
| [18] | 曾珂, 吴晓骏, 曹家庆, 等. 苦瓜提取物对高脂饲料诱导肥胖大鼠的减肥作用[J]. 沈阳药科大学学报, 2012, 29 (6) : 473–478. |
| [19] | 何景, 曾沧江. 中国植物志[M]. 北京: 科学出版社, 2004 : 128 |
| [20] | 尚文斌, 杨颖, 陈名道. 人参及其主要成分抗糖尿病作用机制[J]. 国际内分泌代谢杂志, 2007, 27 (2) : 115–116. |
| [21] | 尚文斌, 于希忠, 王国强, 等. 人参皂苷Rb1改善高脂喂养肥胖小鼠胰岛素抵抗和脂肪异位沉积[J]. 中国中药杂志, 2013, 38 (23) : 4119–4129. |
| [22] | 卜其涛.人参皂苷Rb3的分离及其抗糖尿病和调血脂活性研究[D].长春:吉林农业大学, 2011. http://cdmd.cnki.com.cn/article/cdmd-10193-1011150560.htm |
| [23] | 林卫东, 陈超, 梁生旺, 等. 人参皂苷改善胰岛素抵抗的网络药理学[J]. 中成药, 2016, 38 (7) : 1455–1461. |
| [24] | 贾春华, 魏晓芬, 庞宗然, 等. 菩达茶降血糖作用临床观察[J]. 河北中医, 2002, 24 (7) : 483–485. |
| [25] | 赵文, 秦淑贞, 王庭欣, 等.菩达茶对动物血糖和血脂的调节作用[C].北京:营养与保健食品研究及科学进展学术资料汇编, 2002. http://cpfd.cnki.com.cn/article/cpfdtotal-egyn200201001016.htm |
| [26] | 庞宗然, 赵玉堂, 李静华, 等. 菩人丹超微粉对肥胖型2型糖尿病大鼠糖代谢相关指标的影响[J]. 中国实验方剂学杂志, 2010, 16 (5) : 107–110. |
| [27] | Omar B, Pacini G, Ahren B. Differential Development of Glucose Intolerance and Pancreatic Islet Adaptation in Multiple Diet Induced Obesity Models[J]. Nutrients, 2012, 4 (10) : 1367–1381. |
| [28] | 郑思道, 于雯, 王宁元. MicroRNA介导的人参及其活性成分药理作用与机制[J]. 世界中西医结合杂志, 2016, 11 (6) : 880. |
| [29] | 杨娣, 孟大利, 曹家庆, 等. 苦瓜皂(甾)苷的现代药学和降血糖作用的研究进展[J]. 中草药, 2013, 44 (24) : 3582–3591. |
| [30] | 李瑾英, 吕德珍. 中西医结合治疗肥胖高胰岛素血症20例[J]. 当代医学, 2011, 16 (34) : 151. |
 2016, Vol. 33
2016, Vol. 33