文章信息
- 刘爽, 石欢, 周震
- LIU Shuang, SHI Huan, ZHOU Zhen
- 化痰通络法对rt-PA溶栓后急性脑梗死大鼠神经细胞凋亡及Caspase-12表达的影响
- Effect on apoptosis of neural cell and Caspase-12 expression in rat cortex accepted Huatan Tongluo formula with thrombolysis pherapy after acute cerebral infarction
- 天津中医药, 2016, 33(10): 610-613
- Tianjin Journal of Traditional Chinese Medicine, 2016, 33(10): 610-613
- http://dx.doi.org/10.11656/j.issn.1672-1519.2016.10.09
-
文章历史
- 收稿日期: 2016-05-01
2. 北京市大兴区中医医院, 北京 102600
急性脑梗死发病急骤,病情变化迅速,早期有效的治疗对患者十分重要。超早期溶栓治疗是急性脑梗死的有效治疗方法,然而溶栓治疗后缺血再灌注损伤可导致缺血区域和周边半暗带区的神经细胞坏死与凋亡,进一步加重脑组织神经细胞继发性损伤[1],严重影响着患者的预后[2]。内质网(ER)稳态的紊乱,特别是内质网应激(ERS)参与了脑缺血/再灌注后神经细胞凋亡的发生,可能是其中的关键因素[3],近年来受到广泛关注。长时间过强的ERS反应下,内质网稳态若不能及时重新建立,半胱氨酸天冬氨酸蛋白酶12(Caspase-12)作为特异性介质可使ERS不依赖于其他通路,而直接独立诱导细胞凋亡。本次研究通过观察化痰通络法中药对急性脑梗死大鼠溶栓治疗后大脑皮质梗死区Caspase-12蛋白和基因表达的影响,探讨其抑制神经细胞凋亡的可能作用机制。
1 实验材料 1.1 动物选取清洁级,体质量为200~250 g的健康SD大鼠160只,雄雌各半。大鼠均购自:北京大学医学部实验动物科学部[许可证号:SZXK(京)2011-00120]。
1.2 试剂实时定量荧光聚合酸链式反应(Real Time PCR)试剂如Oligo dT 、dNTP、核糖核酸(RNA)抑制酶[均购自宝生物工程(大连)有限公司];Caspase-12引物(上海生物工程有限公司合成);Quanti Tect TM SYBR Green PCR Kit(购自QIAGEN公司);逆转录酶、Go Taq Green Master mix(购自美国Promega);Tunel试剂盒(购自碧云天生物试剂有限公司)等。
1.3 药物化痰通络法方药组成:天麻、半夏、胆南星、丹参、川芎、地龙、酒大黄7味中药,共5付(400 g)加入10倍水煎煮,共3次,每次30 min,浓缩至生药溶液500 mL(浓度为0.8 g/mL)。于天津中医药大学第二附属医院制剂室制备药物,4 ℃保存备用。注射用重组组织纤溶酶原激活剂(rt-PA)购自德国勃林格殷格翰公司(批号005765201304),血栓诱导剂购自长春国奥药业有限公司(批号20081218)。
1.4 实验仪器日本OLYMPU-IX71倒置显微镜和图像分析系统、美国Beckman-coulter流式细胞仪、实时定量荧光PCR仪(RG-3000,Rotor-Gene生产)等。
2 实验方法 2.1 动物模型的建立首先要进行栓子的制备,完成后参照张新江等[4]方法建立大鼠大脑中动脉栓塞模型(MCAO)。rt-PA组、实验组和模型组大鼠均进行造模。假手术组同模型制作,但只在注射时以生理盐水0.3 mL代替栓子溶液。
2.2 动物分组与给药方法160只健康SD大鼠,按随机数字表随机分为假手术组40只、模型组40只、rt-PA组40只、实验组40只。选取造模后6 h、24 h,3 d、7 d 4个时相[5],各组各时相选取10只大鼠进行相应检测。rt-PA组及实验组进行rt-PA溶栓治疗:于血栓注入后3 h,将浓度为5.67 mg/kg的rt-PA加入生理盐水2 mL中,一次性由鼠尾静脉缓慢注入(20 min)。同时实验组结合化痰通络法中药灌胃治疗,rt-PA组给予等剂量蒸馏水替代中药灌胃治疗,参照文献[6]计算给药剂量。假手术组及模型组在与灌服中药相同时间点采用与中药相等剂量的蒸馏水灌胃,同时于溶栓相同的时间点用与rt-PA溶剂相等剂量的生理盐水由大鼠尾静脉缓慢注入(同上)。
2.3 实验室指标检测方法各组分别于6 h、24 h、3 d、7 d 4个时间点经相应处理将大鼠断头处死,并选取需要检测的大鼠梗死部位脑组织。按照核蛋白和胞浆蛋白提取试剂盒说明抽提组织的总蛋白质,并进行蛋白质定量(单位:g/L)。采用蛋白印迹法(Western Blot)、实时定量荧光PCR法检测凋亡性信号途径中Caspase-12蛋白与基因表达,采用原位末端标记法(TUNEL法)检测神经细胞凋亡情况。
2.4 统计方法采用SPSS 18.0统计学软件处理,计量资料以均数±标准差(x±s)表示,计量资料组间比较采用单因素方差分析,组间两两比较若方差齐采用LSD法,方差不齐采用Dunnett’s T3法,P < 0.05为差异有统计学意义。
3 实验结果 3.1 Western Blot结果同一组内,和6 h相比,模型组7 d时Caspase-12蛋白相对丰度值明显增加(P < 0.05),其余各组各时相Caspase-12蛋白相对丰度值均无统计学差异(P > 0.05),但均以1 d时相对丰度值为最高。同一时相内,与假手术组相比,模型组各时相中Caspase-12蛋白相对丰度值均明显增加(P < 0.05)。与模型组相比,除rt-PA组7 d时降低无统计学意义(P > 0.05),rt-PA组和实验组在其他时相Caspase-12蛋白相对丰度值均明显降低(P < 0.05)。与rt-PA组相比,实验组在4个时相Caspase-12蛋白相对丰度值差异均无统计学意义(P > 0.05),但存在降低趋势。见表 1,图 1。
| 组别 | 动物数 | 6h | 24 h | 3 d | 7 d |
| 假手术组 | 40 | 0.91±0.06 | 0.95±0.08 | 0.92±0.11 | 0.87±0.06 |
| 模型组 | 40 | 1.13±0.02* | 1.26±0.11* | 1.21±0.06* | 1.04±0.03#* |
| rt-PA组 | 40 | 0.98±0.01△ | 1.03±0.06△ | 0.98±0.09△ | 0.93±0.09 |
| 实验组 | 40 | 0.91±0.06△ | 1.01±0.02△ | 0.94±0.09△ | 0.90±0.04△ |
| 注:同一组内和6h相比,#P < 0.05;同一时相内,和假手术组相比,*P < 0.05;和模型组相比,△P < 0.05。 | |||||

|
| 图 1 各组不同时相大脑梗死组织Caspase-12蛋白的相对丰度值 Fig. 1 Caspase-12 protein in cerebrum infarct tissue at each time |
同一组内,和6 h相比,各组Caspase-12 mRNA表达量以1 d为最高,差异具有统计学意义(P < 0.05),其他时相均无统计学差异(P > 0.05),均符合脑梗死发展规律。同一时相内,与假手术组相比,模型组4个时相Caspase-12 mRNA表达量均明显增高(P < 0.05);与模型组相比,rt-PA组和实验组4个时相Caspase-12 mRNA表达量均明显降低(P < 0.05);与rt-PA组相比,实验组在1 d和7 d时Caspase-12 mRNA表达量明显下降(P < 0.05)。见表 2。
| 组别 | 动物数 | 6h | 24 h | 3d | 7d |
| 假手术组 | 40 | 0.63±0.28 | 1.76±0.17# | 1.00±0.09 | 0.58±0.38 |
| 模型组 | 40 | 4.22±0.74* | 9.74±1.37#* | 5.06±0.36* | 2.81±0.18* |
| rt-PA组 | 40 | 1.31±0.23△ | 2.70±1.01#△ | 1.33±0.41△ | 1.08±0.18△ |
| 实验组 | 40 | 0.95±0.15△ | 2.11±0.12#△▲ | 1.07±0.25△▲ | 0.98±0.54△ |
| 注:同一组内和6h相比,#P < 0.05;同一时相内,和假手术组相比,*P < 0.05;和模型组相比,△P < 0.05;和rt-PA组相比,▲P < 0.05。 | |||||
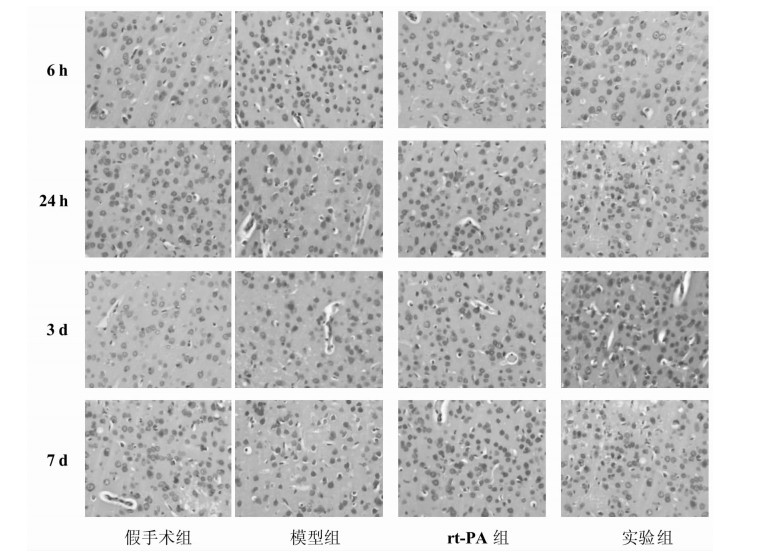
假手术组各个时相,神经元均着色均匀,可见深染核仁,少见红色凋亡神经元。6 h时:模型组可见部分红色凋亡神经元,神经元数量轻中度减少;rt-PA组和实验组可见少部分红色凋亡神经元,神经元数量轻度减少。24 h时:模型组大部分神经元高度肿胀,可见部分红色凋亡神经元,神经元数量明显减少;rt-PA组和实验组部分神经元中度肿胀,可见少部分红色凋亡神经元,神经元数量明显减少,其中实验组有明显的炎性细胞浸润现象。3 d时:模型组可见大部分红色凋亡神经元,神经元数量明显减少;rt-PA组和实验组可见部分红色凋亡神经元,神经元数量明显减少,其中实验组仍可见到明显的炎性细胞浸润现象。7 d时:模型组神经细胞明显减少,可见绝大部分为红色凋亡神经元;rt-PA组神经细胞明显减少,大部分为红色凋亡神经元;实验组神经细胞中度减少,部分为红色凋亡神经元。见图 2。
|
| 图 2 各组大鼠皮质组织病理学观察(HE染色,×40) Fig. 2 Cortical histopathology of rats' cortex in each group (HE staining, ×40) |
脑梗死归属于中医学中所讲的“中风病”范围。根据中医学中“急则治其标”的治疗原则,发病早期应投用化痰泻浊、祛瘀通络方药可切中病机[7]。化痰通络法方中天麻性味甘平,为治风之神药;半夏辛温、胆南星性苦微辛,具有清热化痰通络之功;地龙咸寒,能清热熄风通络;川芎辛散上行,为血中气药;丹参味苦微寒,可凉血活血,两药合用可达行气活血祛瘀之目的;酒大黄清热祛瘀泻浊,上述7味药合用共奏祛风化痰、清热泻浊、祛瘀通络之功效。在临床对于超早期急性脑梗死风痰瘀阻证患者,采用化痰通络法联合溶栓治疗也取得了满意的疗效。
ERS可以激活多条途径诱导细胞凋亡[8],尽管ERS介导的凋亡途径并没有完全阐明,但是内质网膜上的Caspase-12的活化已经被确认参与这个过程[8-9]。其中,Caspase-12是内质网应激导致凋亡的特异性介质,它使ERS可以不依赖于其他通路,而独立诱导细胞凋亡,并且Caspase12的表达上调也在脑缺血/再灌注动物模型中被发现证实。内质网应激引起凋亡时,胞浆内的Caspase12被转移至内质网表面,并被Caspase-7激活,移位到胞质后序贯激活Caspase-9与Caspase-3,进而引起细胞凋亡[10]。大脑中动脉栓塞1 h之后再灌注6~24 h,检测发现Caspase-12合成被活化,并且其定位与神经细胞的凋亡相一致,同时随着缺血/再灌注时间的延长,保护性因子GRP78/Bip的活性亦被Caspase-12抑制[11]。
本实验研究结果显示:rt-PA溶栓后可以部分的抑制MCAO梗死区出现的明显神经元凋亡现象,再通过联合化痰通络法中药治疗,神经细胞凋亡明显减少。而分子生物学机制研究进一步提示,实验组可显著降低模型大鼠梗死区域脑组织中升高的Caspase-12蛋白与基因的表达,效果优于单纯应用rt-PA溶栓治疗组。综上所述,本实验选择ERS特异性分子Caspase-12作为标志物,通过观察不同时相Caspase-12蛋白和基因的表达变化以及神经细胞凋亡情况,得出化痰通络法可以通过降低Caspase-12蛋白和基因的表达,部分抑制ERS后期神经细胞的凋亡,进一步防止急性脑梗死溶栓后缺血/再灌注的发生与发展。
| [1] | Cho S, Szeto HH, Kim E, et al. A novel cell permeable antioxidant peptide, SS31, attenuates ischemic brain by down-regulating CD36[J]. J Biol Chem, 2007, 282 (7) : 4634–4642. DOI:10.1074/jbc.M609388200 |
| [2] | Wang X, Tsuji K, Lee SR, et al. Mechanisms of hemorrhagic transformation after tissue plasminogen activator reperfusion therapy for ischemic stroke[J]. Stroke, 2004 (35) : 2726–2730. |
| [3] | 关丽英, 许彩民, 潘华珍. 内质网应激介导的细胞凋亡[J]. 生物化学与生物物理进展, 2007, 34 (11) : 1136–1141. |
| [4] | 张新江, 常丽英, 张苏明, 等. 大鼠自体血栓大脑中动脉闭塞模型的改良[J]. 卒中与神经疾病, 2003, 10 (1) : 12–15. |
| [5] | Magnoni S, Bake rA, George SJ, et al. Differential alterations in the expression and activity of matrixmetalloProteinases-2 and -9 after transient cerebral ischemia in mice[J]. Neurobiology of Disease, 2004 (17) : 188–197. |
| [6] | 徐叔云. 药理实验方法学[M]. 北京: 人民卫生出版社, 2002 : 1 |
| [7] | 黄宇虹.中风病急性期证候学研究[D].天津:天津中医药大学, 2005:29. http://cdmd.cnki.com.cn/article/cdmd-10063-2005120273.htm |
| [8] | 刘春蕾, 何昆仑, 王莉莉. 基于内质网应激途径的细胞保护策略的研究进展[J]. 中国药理学通报, 2011, 27 (4) : 455–458. |
| [9] | Ohse T, Inagi R, Tanaka T, et al. Albumin induces endo-plasmic reticulum stress and apoptosis in renal proximal tubular cells[J]. Kidney Int, 2006, 70 (8) : 1447–1455. DOI:10.1038/sj.ki.5001704 |
| [10] | Roy S, Sharom JR, Houde C, et al. Confinement of caspase-12 proteolytic activity to autoprocessing[J]. PNAS, 2008, 105 (11) : 4133–4138. DOI:10.1073/pnas.0706658105 |
| [11] | Wang M, Wey S, Zhang Y, et al. Role of the unfolded protein response regulator GRP78/BiP in development, cancer and neurological disorders[J]. Antioxid Redox Signal, 2009, 11 (9) : 2307–2316. DOI:10.1089/ars.2009.2485 |
2. Traditional Chinese Medicine Hospital of Beijing Daxing District, Beijing 102600, China
 2016, Vol. 33
2016, Vol. 33