文章信息
- 冯倩茹, 叶柳青, 刘园园, 龚又明, 李红艳, 王艳
- FENG Qian-ru, YE Liu-qing, LIU Yuan-yuan, GONG You-ming, LI Hong-yan, WANG Yan
- 鹅掌楸苷和光甘草定协同抗氧化作用研究
- Study on synergistic antioxidant activities of Liriodendrin and Glabridin
- 天津中医药大学学报, 2016, 33(10): 624-628
- Journal of Tianjin University of Traditional Chinese Medicine, 2016, 33(10): 624-628
- http://dx.doi.org/10.11656/j.issn.1672-1519.2016.10.12
-
文章历史
- 收稿日期: 2016-05-12
2. 天津中医药大学中药学院, 天津 300193;
3. 南开大学药学院, 天津 300071
鹅掌楸苷(LIR)为白色粉末,熔点为259~261 ℃,分子式为C34H46O18[1],可从刺五加、大血藤等植物中分离得到。鹅掌楸苷已经被证实具有抗炎、镇痛[2]、抗心律失常、改善心肌缺血、钙通道拮抗等作用[3]。但其抗氧化活性及与其他物质协同抗氧化作用还未见报道。光甘草定(GLA)为黄酮类物质,生物活性广泛,具有突出的抑制酪氨酸酶作用、抗炎、抗骨质疏松等[4]。
根据文献报道,中药多种成分均具有抗氧化活性,现已应用于油脂食品的抗氧化,药品和化妆品的抗氧化、抗衰老及抗肿瘤作用。笔者在研究鹅掌楸苷和光甘草定抗氧化活性的基础上,将两者进行配伍,研究两者的抗氧化协同作用,以期达到在相同药效下降低成本的目的,对药品和化妆品的临床应用具有重要意义。同时为本课题组后期筛选两者最佳配比及制剂研究提供一定的数据依据和理论基础。
1 材料和仪器 1.1 材料与试剂鹅掌楸苷(实验室自制),光甘草定(中国药品生物制品鉴定所,纯度>98%);1,1-二苯基-2-苦苯肼(DPPH,天津市康科德科技有限公司);2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS,南京奥多福尼生物科技有限公司);甲醇、无水乙醇、过硫酸钾(天津市康科德科技有限公司)。
1.2 仪器多功能微孔板检测仪infinite 200®PRO[帝肯(上海)贸易有限公司];调速振荡器HY-1型(上海亚荣生化仪器厂);精密分析天平BP121S型(瑞士托雷斯公司)。
2 方法 2.1 溶液及样品的制备 2.1.1 鹅掌楸苷的制备大血藤烘干,粉碎,过40目筛。取粉末1 kg,95%乙醇回流提取90 min,重复2次。合并滤液,过滤浓缩得到浸膏。浸膏中加入去离子水,3 000 r/min条件下离心30 min,上清液经X-5型大孔树脂初步纯化,重结晶得到含量为97.48%的鹅掌楸苷样品[3]。
2.1.2 DPPH溶液的制备称取DPPH粉末,精确称定,以甲醇为溶剂,定容于500 mL容量瓶内,配制浓度为9.8×10-5 mol/L的DPPH溶液,0~4 ℃避光保存,备用[5]。
2.1.3 ABTS溶液的制备将7 mmol/L ABTS和2.45 mmol/L的过硫酸钾1:1混合,在室温避光条件下静置过夜,将生成的ABTS溶液用乙醇稀释,使其在30 ℃,734 nm波长下的吸光度为0.70±0.02,即得到ABTS工作液[6]。
2.2 DPPH自由基清除实验取96孔板,分别加入上述DPPH溶液100 μL和甲醇溶液,再加入不同浓度的鹅掌楸苷、光甘草定和复配后溶液100 μL[7]。复配的鹅掌楸苷和光甘草定的质量比依次为1:3,1:1,3:1。避光反应30 min,使用多功能微孔板检测仪测517 nm处的吸光度,计算清除率,用SPSS 17.0软件计算IC50。实验平行测定3次,保证准确性。
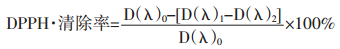 |
式中,D(λ)0为100 μL DPPH+100 μL甲醇的吸光度;D(λ)1为100 μL DPPH+100 μL样品的吸光度;D(λ)2为100 μL样品+100 μL甲醇的吸光度[8]。
2.3 ABTS自由基清除实验取96孔板,分别加入ABTS 100 μL,再加入不同浓度的鹅掌楸苷、光甘草定和复配后溶液100 μL[9]。复配的鹅掌楸苷和光甘草定的质量比依次为1:1,1:3,3:1。避光反应6 min,使用多功能微孔板检测仪测734 nm处的吸光度,计算清除率,用SPSS软件计算IC50。实验平行测定3次,保证准确性。
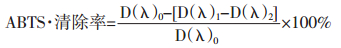 |
式中,D(λ)0为100 μL ABTS+100 μL水的吸光度;D(λ)1为100 μL ABTS+100 μL样品的吸光度;D(λ)2为100 μL样品+100 μL水的吸光度。
2.4 Isobologram分析法分析鹅掌楸苷和光甘草定的相互作用根据鹅掌楸苷和光甘草定分别单独作用得到IC50,为全面分析两者相互作用选取掌楸苷和光甘草定的质量比依次为1:3,1:1,3:1[9]。复配后样品稀释不同浓度,分别测定对DPPH和ABTS自由基的清除作用。
2.5 数据分析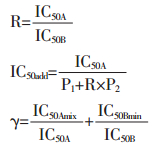 |
IC50Amix、IC50Bmix分别为复配组中A、B两种抗氧化剂的IC50值;IC50A和IC50B分别为A、B单独作用时的IC50值。若γ=1,表示相互作用为相加;若γ < 1,表示相互作用为协同作用,并且γ值越小说明协同作用越强;若γ>1,表示相互作用为拮抗作用[10]。
3 结果与分析 3.1 鹅掌楸苷和光甘草定对DPPH自由基的清除作用 3.1.1 鹅掌楸苷和光甘草定单独作用对DPPH自由基的清除作用由图 1可知,鹅掌楸苷和光甘草定均对DPPH自由基有清除作用,并且随着鹅掌楸苷和光甘草定质量浓度的增加,对DPPH的清除率随之增加。鹅掌楸苷和光甘草定的IC50分别为161.63 mg/L、79.81 mg/L,清除能力为光甘草定大于鹅掌楸苷,两者对DPPH自由基均有较好的清除作用,表明两者均具有较强的抗氧化能力。
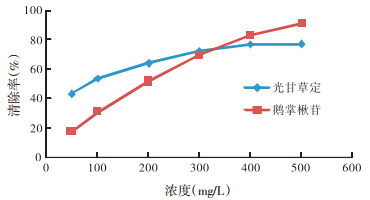
|
| 图 1 光甘草定和鹅掌楸苷对DPPH的清除率 Fig. 1 DPPH radical scavenging capacity of GLA and LIR ` |
由表 1可知,鹅掌楸苷和光甘草定的复配比为1:3、1:1和3:1时,随光甘草定质量浓度的增加,对DPPH的清除率随之增加。复配后IC50值分别为374.12、99.68和59.34 mg/L。因此对DPPH的清除作用大小为:复配比3:1>1:1>1:3。
| 鹅掌楸苷和光甘草定固定比例 | 质量浓度(mg/L) | 清除率(%) | |
| 光甘草定 | 鹅掌楸苷 | ||
| 1:1 | 250 | 250 | 76.30 |
| 125 | 125 | 61.81 | |
| 25 | 25 | 32.00 | |
| 2.5 | 2.5 | 15.58 | |
| 0.25 | 0.25 | 10.59 | |
| 3:1 | 125 | 375 | 89.98 |
| 62.5 | 187.5 | 72.86 | |
| 12.5 | 37.5 | 30.80 | |
| 1.25 | 3.75 | 15.23 | |
| 0.125 | 0.375 | 11.07 | |
| 1:3 | 375 | 125 | 63.30 |
| 187.5 | 62.5 | 36.74 | |
| 37.5 | 12.5 | 20.56 | |
| 3.75 | 1.25 | 8.77 | |
| 0.375 | 0.125 | 4.03 | |
由图 2结果显示,复配比为3:1的效应点(IC50值)落在相加线和95%可信限的左边,表示鹅掌楸苷和光甘草定复配比为3:1为协同作用;复配比为1:1的效应点(IC50值)落在相加线和95%可信限之间,表示鹅掌楸苷和光甘草定复配比为1:1为相加作用;复配比为1:3的效应点(IC50值)落在相加线和95%可信限的右边,表示鹅掌楸苷和光甘草定复配比为1:3为拮抗作用[11]。
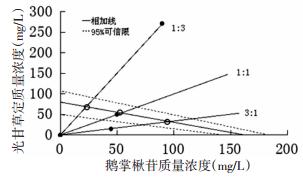
|
| 图 2 鹅掌楸苷和光甘草定复配后DPPH自由基的清除作用的Isobologram分析图 Fig. 2 Isobolographic plot of DPPH radical scavenging capacity of GLA combined with LIR -●-表示复配后实际IC50值(IC50mix);-○-表示复配后理论IC50值(IC50add) |
根据鹅掌楸苷和光甘草定单体及复配后得到的IC50值,按照2.5项下统计方法进行统计,分别计算光甘草定实际IC50值(ICGLA50mix),鹅掌楸苷实际IC50值(IC50LIRmix),复配后实际IC50值(IC50mix),复配后理论IC50值(IC50add)及相互作用指数γ,并对所得结果IC50mix和IC50add进行t检验,结果见表 2。
| 组合 | 比例 | ICGLA50mix(mg/L) | IC50LIRmix(mg/L) | IC50mix(mg/L) | IC50add(x±s,mg/L) | γ |
| LIR:GLA | 1:1 | 50 | 50 | 100 | 106.860±15.09 | 1 |
| 3:1 | 15 | 45 | 59 | 128.660±19.20* | 0 | |
| 1:3 | 281 | 94 | 374 | 091.378±15.23* | 4 | |
| 注:与IC50mix比较,*P < 0.01。 | ||||||
由表 2可知,在鹅掌楸苷和光甘草定清除DPPH的实验中,在复配比为3:1时IC50mix值小于IC50add,并且相互作用指数γ < 1,鹅掌楸苷和光甘草定配比为3:1时表现为协同作用。在复配比为1:1时IC50mix值虽小于IC50add,但处在置信区间内,因此复配比为1:1表现为相加作用。在复配比为1:3时IC50mix值大于IC50add,并且相互作用指数γ>1,因此复配比为1:3表现为拮抗作用。
3.2 鹅掌楸苷和光甘草定对ABTS自由基的清除作用 3.2.1 鹅掌楸苷和光甘草定单独作用对ABTS自由基的清除作用由图 3可知,鹅掌楸苷和光甘草定均对ABTS自由基有清除作用,鹅掌楸苷和光甘草定随着质量浓度的增加,对ABTS的清除率随之增加。鹅掌楸苷和光甘草定的IC50分别为118.66、102.81 mg/L,表明两者对ABTS自由基均有较好的清除作用。

|
| 图 3 鹅掌楸苷和光甘草定对ABTS的清除率 Fig. 3 ABTS radical scavenging capacity of GLA and LIR |
由表 3可知,鹅掌楸苷和光甘草定的复配比为1:3、3:1和1:1时,随光甘草定质量浓度的增加,对ABTS的清除率随之增加。复配后IC50值分别为10.07、24.64和17.13 mg/L。因此对DPPH的清除作用大小为:复配比1:3>1:1>3:1。
| 鹅掌楸苷和光甘草定固定比例 | 质量浓度(mg/L) | 清除率(%) | |
| 鹅掌楸苷 | 光甘草定 | ||
| 1:1 | 25 | 25 | 76.42 |
| 12.5 | 12.5 | 59.22 | |
| 5 | 5 | 29.15 | |
| 2.5 | 2.5 | 25.69 | |
| 0.25 | 0.25 | 8.80 | |
| 12.5 | 37.5 | 80.98 | |
| 1:3 | 6.25 | 18.75 | 65.65 |
| 2.5 | 7.5 | 46.66 | |
| 1.25 | 3.75 | 36.71 | |
| 0.125 | 0.375 | 10.05 | |
| 37.5 | 12.5 | 75.45 | |
| 18.75 | 6.25 | 48.16 | |
| 3:1 | 7.5 | 2.5 | 26.05 |
| 3.75 | 1.25 | 2.62 | |
| 0.375 | 0.125 | 0.21 | |
由图 4结果显示,鹅掌楸苷和光甘草定复配比为1:3、1:1和3:1的效应点(IC50值)均落在相加线和95%可信限左边,表示鹅掌楸苷和光甘草定复配比为1:3、1:1和3:1均表现为协同作用。
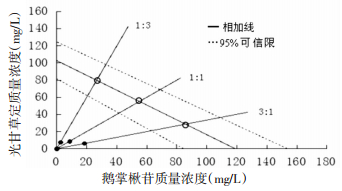
|
| 图 4 鹅掌楸苷和光甘草定复配后对ABTS自由基清除作用的Isobologram分析图 Fig. 4 Isobolographic plot of ABTS radical scavenging capacity of GLA combined with LIR -●-表示复配后实际IC50值(IC50mix);-○-表示复配后理论IC50值(IC50add) |
根据鹅掌楸苷和光甘草定单体及复配后对ABTS自由基清除作用的IC50值,分别计算光甘草定实际IC50值(ICGLA50mix),鹅掌楸苷实际IC50值(IC50LIRmix),复配后实际IC50值(IC50mix),复配后理论IC50值(IC50add)及相互作用指数γ,并对所得结果IC50mix和IC50add进行t检验,结果见表 4。
| 组合 | 比例 | ICGLA50mix(mg/L) | IC50LIRmix(mg/L) | IC50mix(mg/L) | IC50add(x±s,mg/L) | γ |
| LIR:GLA | 1:1 | 8.56 | 8.56 | 17.13 | 110.17±14.21* | 0.155 |
| 3:1 | 6.16 | 18.48 | 24.64 | 114.26±15.14* | 0.216 | |
| 1:3 | 7.55 | 2.518 | 10.07 | 106.36±14.73* | 0.095 | |
| 注:与IC50mix比较,*P < 0.01。 | ||||||
由表 4可知,在鹅掌楸苷和光甘草定清除ABTS的实验中,IC50mix值均小于IC50add,并且相互作用指数γ均 < 1,表明鹅掌楸苷和光甘草定在复配为1:1、1:3和3:1时均对ABTS有协同作用,并且复配组合中协同作用强弱为:1:3>1:1>3:1。
4 结论与讨论笔者采用了常用的测定药物抗氧化实验方法:DPPH和ABTS清除实验,测定了鹅掌楸苷和光甘草定在一定复配比例下的相互作用,并结合常用测定药物相互作用的Isobologram分析法[12],更加直观的对相互作用进行分析。实验结果显示,鹅掌楸苷和光甘草定配比为3:1时对DPPH自由基清除表现为协同作用,1:1表现为相加作用,1:3表现为拮抗作用。复配为1:1、1:3和3:1时均对ABTS有协同作用,并且复配组合中协同作用强弱为:1:3>1:1>3:1。
值得一提的是在复配中两者只对ABTS表现出了极强的协同抗氧化效果,可能与DPPH和ABTS自由基清除实验的机制不同有关。DPPH自由基清除实验的机制是向DPPH自由基溶液中加入自由基清除剂,孤对电子被配对,深紫色的DPPH自由基被还原成黄色DPPH-H非自由基形式,其褪色程度与所接受的电子数量成定量关系[13]。ABTS自由基清除实验的机制ABTS在适当的氧化剂作用下氧化成绿色的ABTS+,在抗氧化物存在时ABTS+的产生会被抑制[14]。而对于协同作用的机制,相关报道认为当两种或者两种以上的抗氧化剂复配使用时,单个抗氧化剂在氧化之后,很可能使得产生的游离基相互作用生成新的抗氧化物质,继续发挥抗氧化作用,使其抗氧化性能得以增强[15]。因此,对于鹅掌楸苷与光甘草定的抗氧化协同机制还需进一步研究。
| [1] | 罗超, 于瑞婷, 刘洪卫, 等. 白皮锦鸡儿酚类化合物及其生物活性[J]. 天然产物研究与开发, 2015, 27 (3) : 386–392, 445. |
| [2] | Jung HJ, Park HJ, Kim RG, et al. In vivo "anti-inflammatory and antinociceptive effects of liriodendrin isolated from the stem bark of Acanthopanax senticosus"[J]. Planta Medica, 2003, 69 (7) : 610–616. DOI:10.1055/s-2003-41127 |
| [3] | Li DH, Wang Y, Lv YS, et al. Preparative purification of liriodendrin from sargentodoxa cuneata by macroporous resin[J]. BioMed Research International, 2015 (861256) : 9. |
| [4] | 叶柳青, 王艳, 韩宛盈, 等. 光甘草定羟丙基-β-环糊精包合物的制备及其对透皮吸收的影响研究[J]. 天津中医药, 2015, 32 (10) : 622–625. |
| [5] | 赵骏, 张毅, 李钥. 20种中草药醇提液与水提液清除自由基活性的比较[J]. 天津中医药, 2007, 24 (1) : 69–70. |
| [6] | 李华, 李勇, 吴莹, 等. ABTS°+法测定葡萄酒抗氧化活性的研究[J]. 西北农林科技大学学报, 2009, 37 (11) : 90–96. |
| [7] | 王笑晴. 基于DPPH自由基清除能力的姜黄提取物抗氧化活性评价[J]. 药物评价研究, 2011, 34 (5) : 360–363. |
| [8] | 郑大贵, 叶青, 叶红德, 等.DPPH·法评价VC、异VC及其衍生物的抗氧化性能[J].2008, 29(4): 113-115. |
| [9] | 周玮婧, 隋勇, 孙智达, 等. 荔枝皮原花青素与VC、VE的协同抗氧化研究[J]. 食品科学, 2012, 33 (3) : 6–8. |
| [10] | 刘瑾, 邱海霞, 梅兴国, 等. 等高线图解分析法:评价药物相互作用的方法[J]. 国外医学·药学分册, 2006, 33 (6) : 459–461. |
| [11] | 刘军军, 刘金兰, 李帅, 等. 拳参黄酮与VC、芦丁协同抗氧化作用研究[J]. 化学与生物工程, 2014, 31 (6) : 34–37. |
| [12] | 安静.当归提取物中不同组分配伍的协同抗炎、抗氧化作用研究[D].北京:北京中医药大学, 2014. http://www.oalib.com/references/17242319 |
| [13] | 李铉军, 崔胜云. 抗坏血酸清除DPPH自由基的作用机理[J]. 食品科学, 2011, 32 (1) : 86–90. |
| [14] | 刘小兵, 朴建华, 田园. 几种生物活性物质体外抗氧化能力评价技术的研究[J]. 卫生研究, 2009, 38 (3) : 280–282. |
| [15] | 刘晓慧, 孟庆, 李伟, 等. 茶多酚类化合物与维生素协同抗氧化机理研究进展[J]. 热带作物学报, 2012, 33 (12) : 2305–2310. |
2. School of Traditional Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China;
3. College of Pharmacy, Nankai University, Tianjin 300071, China
 2016, Vol. 33
2016, Vol. 33