文章信息
- 黄春丽, 张德芹, 张青霞, 文静
- HUANG Chun-li, ZHANG De-qin, ZHANG Qing-xia, WEN Jing
- 和颜坤泰胶囊对卵巢去势大鼠子宫形态及细胞凋亡的影响
- Anti-apoptotic and uterotrophic effects of Heyan Kuntai capsules in uterus of ovariectomized rats
- 天津中医药, 2016, 33(11): 675-681
- Tianjin Journal of traditional Chinese Medicine, 2016, 33(11): 675-681
- http://dx.doi.org/10.11656/j.issn.1672-1519.2016.11.11
-
文章历史
- 收稿日期: 2016-04-21
更年期综合征(CLS)是指妇女在绝经前后由于卵巢功能衰退的内分泌变化所引起的各器官系统的综合证候群[1],是女性特定阶段的常见病和多发病,严重影响了更年期妇女的生活质量[2]。中医药治疗更年期综合征在临床已开展多年[3-5],除能显著地改善临床症状外,还有不良反应小的优势。目前用于研究更年期综合征动物模型较多,卵巢去势模型是其中一种较为经典的动物模型,通过摘除卵巢切断雌激素的来源造成雌激素低下的环境模拟更年期[6],在围绝经期病症模型的研究中用途较广[7]。和颜坤泰胶囊由熟地黄、黄连、白芍、黄芩、阿胶、茯苓6 味药物组成,功能滋阴清热、安神除烦,临床用于治疗更年期综合征取得了良好的效果[8-9]。张绍芬、段燕康等[10-11]已做了和颜坤泰胶囊对更年期大鼠的部分基础药效学研究,实验结果显示和颜坤泰胶囊可调节雌激素水平明显改善更年期各种症状,但其作用机制尚不明确。本课题组前期实验表明和颜坤泰胶囊可较明显的提高卵巢去势大鼠的子宫系数,本实验以卵巢去势大鼠为更年期模型,通过对去卵巢大鼠子宫形态及细胞凋亡的检测,从子宫细胞凋亡方面探讨和颜坤泰胶囊治疗更年期综合征的作用机制,以期为其临床应用提供更多实验依据。
1 材料与仪器 1.1 动物雌性SD 大鼠,体质量(200±20)g,由北京华阜康生物科技股份有限公司提供,动物合格证编号:SCXK(京)2002-0003。实验前1 周饲养于天津中医药大学实验动物中心,自由饮食,温度18~22℃。
1.2 药物和颜泰胶囊:贵阳新天药业股份有限公司产品,批号130107;莉芙敏:德国夏普天然药物制药公司产品,批号200801;补佳乐:DELPHARMLilleS.A.A 生产,由拜耳医药保健有限公司广州分公司分包装,批号074A。
1.3 试剂与仪器Trizol 试剂(美国Invitrogen 公司,批号66008);anscriptor First strand cDNA SynthesisKit(美国Applied Biosystems 公司,批号10274023);BRGreen PCR Master Mix(美国Applied Biosystems 公司,批号11226200);引物合成(上海生工生物工程股份有限公司合成);Tunel 试剂盒(Roche in situ celldeath detection kit cat,批号11684817910);Bcl-2 抗体(ABCAM 公司,批号AB7973);Bax 抗体(ABCAM公司,批号AB7977);二抗(DAKO 公司,批号K5007);DBA 显色试剂盒(DAKO 公司,批号K5007)。
ALLEGRA-64R 高速离心机(美国MolecularDevices 公司),PC - 1000 PCR 逆转录仪(美国PERKIN ELMER 公司),CFX96 型Real-Time PCR仪(美国Bio-Red 公司),BMJ-1 生物组织包埋机(天津航空机电公司),ASP300S 全自动封闭脱水机(LEICA 公司),RM2135 病理切片机(LEICA 公司)。见表 1。
| 引物 | 序列 |
| Bcl-2 | fwd 5’-CCCTGGCATCTTCTCCTTC-3’ |
| rev 5’-CATCTCCCTGTTGACGCTC-3’ | |
| Bax | fwd 5’-GCAGAGGATTGCTGATG-3’ |
| rev 5’-CTCAGCCCATCTTCTTCCAG-3’ | |
| β-actin | fwd 5’-ACGGTCAGGTCACTATCG-3’ |
| rev5’-GGCATAGAGGTCTTTACGGATG -3’ |
参照文献[12]卵巢去势大鼠造模方法,选择健康雌性SD 大鼠64 只,体质量(200±20)g,禁食12 h,以3.5%的水合氯醛腹腔注射麻醉,将大鼠俯卧置于固定台上,从背部最末肋骨下,在腋中线和距脊柱外侧约2 cm 交叉处,剪除长毛,用安尔碘消毒后切开皮肤和背肌约1.5 cm,切口视野中可见一乳白色发亮的脂肪团,卵巢即包埋其中,用小镊子轻轻夹住脂肪团拉出切口外,分离脂肪团,可见一团细线状不规则呈黄红色的卵巢,剪取时先将卵巢下输卵管(包括脂肪)用细线结扎,再摘除卵巢,术后顺势将子宫角送回腹腔中,用青霉素清洗创口,缝合肌肉及皮肤,同法摘除另侧卵巢。留取其中8 只大鼠做假手术,方法同上,找出卵巢不摘除。大鼠术后连续3 d 腹腔注射青霉素以防感染。术后第5 天开始阴道涂片观察持续5 d,每日1 次,呈现不规则动情周期的即为造模成功。
2.2 分组及给药选择符合模型标准的大鼠48 只,按随机数字表法分为6 组,模型组,补佳乐组,莉芙敏组,和颜坤泰胶囊高、中、低剂量组,以及假手术组和正常组,每组8 只。补佳乐组按0.2 mg/kg 灌胃给予;莉芙敏组剂量为60 mg 生药/kg;和颜坤泰胶囊高、中、低剂量组分别为:8、4、2 g 生药/kg;各组每日灌胃1 次,连续8 周,每次用药体积按每100 g 体质量灌胃1mL。模型组,假手术组及正常组灌胃等体积的蒸馏水。计算用药治疗期间各组大鼠每日均饲以普通饲料,自由进食、饮水,每周称质量1 次。
2.3 标本采集给药8 周后,末次给药前禁食12 h,给药1 h 后,3.5%水合氯醛腹腔注射麻醉,腹主动脉采血,3 500 r/min,离心15 min,分离血清,分装冻存备用;迅速摘除子宫剥离周围脂肪组织,一半浸入10%福尔马林溶液,用于病理及免疫组化检测。一半冻存,用于RT-PCR 检测。
2.4 指标检测 2.4.1 子宫病理的检测取出浸于福尔马林溶液中的固定好的子宫组织,通过改刀成所需大小,放入包埋盒内并做标记,放入全自动封闭脱水机脱水,二甲苯透明,在全自动包埋机上对组织进行石蜡包埋。包埋后的蜡块进行切片,石蜡切片厚度为4 μm,水浴锅中伸展,裱于干净载玻片上,62 ℃烤片3 h,二甲苯脱蜡10 min,苏木精-伊红(HE)染色,中性树胶封片。利用高倍倒置显微镜对所得病理片进行观察,拍照,用Image-Pru Plus 6.0 软件进行统计。
2.4.2 子宫细胞凋亡检测同上将固定好的子宫组织脱水,包埋,切片后脱蜡至水,用Tunel 试剂盒测子宫细胞凋亡率,操作按说明进行,将子宫切片常规脱蜡至水,滴加末端标记酶及荧光抗体,DAB显色,苏木素复染,显微镜下检测细胞凋亡情况(细胞核中有棕黄色颗粒者为阳性细胞,即为凋亡细胞),采用Image-Pro Plus 6.0 显微图像分析系统扫描后并分析结果,每张切片随机挑选3 个视野,以阳性染色细胞百分比代表细胞凋亡率。
2.4.3 子宫Bcl-2 和Bax 蛋白的检测切片脱蜡后置入乙二胺四乙酸(EDTA)抗原修复缓冲液(pH8.0)的修复盒中进行抗原修复,放入3%过氧化氢溶液阻断内源性过氧化物酶,血清封闭,加一抗,4 ℃孵育过夜。加二抗,室温孵育50 min。DAB 显色,显微镜下控制显色时间,阳性为棕黄色,自来水冲洗切片终止显色。苏木素复染细胞核,盐酸酒精分化,脱水,中性树胶封片。每个组织随机挑选3 个高倍镜下视野进行拍照。应用Image-Pro Plus 6.0 软件对每张照片进行分析得出每张照片阳性面积的比率(阳性面积/总面积)即为阳性面积百分比。
2.4.4 子宫Bcl-2 mRNA 和Bax mRNA 的检测采用RT-PCR 法检测,引物均由上海生工生物工程股份有限公司合成序列见表 1。取子宫组织,加入1 mLTrizol 按说明提取RNA 并检测其浓度与纯度,A260/A280 在1.8~2.0 即可。按照Transcriptor First strandcDNASynthesis 试剂盒说明书进行反转录,反应条件:25 ℃ 10 min,48 ℃ 30 min,95 ℃ 5min。聚合酶反应,其中逆转录产物0.5 μL,PCR 主反应液12.5 μL,上下游引物1 μL,加无酶双蒸水至总反应体系25 μL,反应条件:95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,40cycles。以β-actin 作为参照基因,用2-△△CT 方法计算各基因的相对表达量。
2.5 统计学方法实验结果用SPSS 18.0 统计软件进行分析,结果以均数±标准差(x±s)表示,组间比较采用单因素方差分析,组间两两比较若方差齐采用LSD 法,若方差不齐采用Dunnett’s T3 法,P<0.05 表示差异具有统计学意义。
3 结果 3.1 和颜坤泰胶囊对去势大鼠子宫横截面积和厚度的影响给药8 周后,与正常组相比,模型组大鼠子宫横截面积和子宫壁厚显著减小(P<0.01);与模型组相比,和颜坤泰胶囊低剂量组(2 g/kg)子宫横截面积显著增加(P<0.05),和颜泰胶囊中、低(4、2 g/kg)剂量组子宫壁厚显著增加(P<0.05,P<0.01);补佳乐组子宫横截面积及子宫壁厚显著增加(P<0.01)。结果见表 2。
| 组别 | 动物数 | 剂量(g/kg) | 子宫横截面积(μm2) | 子宫壁厚(μm) | |
| 正常组 | 8 | - | 63 013.98±10 191.80 | 141.26±11.71 | |
| 假手术组 | 8 | - | 49 515.31±6 430.71 | 125.35±8.27 | |
| 模型组 | 8 | - | 17 177.12±4 089.59## | 73.53±8.74## | |
| 补佳乐组 | 8 | 0.2×10-3 | 44 450.66±9 729.71** | 118.38±13.10** | |
| 莉芙敏组 | 8 | 0.06 | 20 945.88±4 969.72 | 81.21±9.57 | |
| 和颜坤泰高剂量组 | 8 | 8 | 18 694.62±1 501.15 | 77.11±3.13 | |
| 和颜坤泰中剂量组 | 8 | 4 | 22 505.78±4 023.70 | 84.43±7.36* | |
| 和颜坤泰低剂量组 | 8 | 2 | 24 943.82±2 793.69* | 89.02±4.92** | |
| 注:与正常组比,##P<0.01;与模型组比,*P<0.05,**P<0.01。 | |||||
给药8 周后,与正常组相比,模型组大鼠子宫肌层面积和肌层厚度显著减小(P<0.01);与模型组相比,和颜坤泰胶囊低剂量组(2 g/kg)子宫肌层面积显著增加(P<0.05),和颜坤泰胶囊中、低(4、2 g/kg)剂量组子宫肌层厚度显著增加(P<0.05,P<0.01);补佳乐组子宫肌层面积及厚度显著增加(P<0.01)。结果见表 3。
| 组别 | 动物数 | 剂量(g/kg) | 子宫肌层面积(μm2) | 子宫肌层厚度(μm) |
| 正常组 | 8 | - | 36 392.38±5 423.62 | 107.40±8.07 |
| 假手术组 | 8 | - | 27 547.92±5 414.30 | 93.30±9.02 |
| 模型组 | 8 | - | 11 567.18±2 745.56## | 60.34±7.17## |
| 补佳乐组 | 8 | 0.2×10-3 | 25 712.21±4 195.52** | 90.22±7.69** |
| 莉芙敏组 | 8 | 0.06 | 14 175.54±3 717.43 | 66.71±8.80 |
| 和颜坤泰高剂量组 | 8 | 8 | 12 634.52± 959.88 | 63.39±2.41 |
| 和颜坤泰中剂量组 | 8 | 4 | 13 789.07±4 090.87 | 65.72±9.27* |
| 和颜坤泰低剂量组 | 8 | 2 | 17 361.99±1 961.95* | 74.25±4.41** |
| 注:与正常组比,##P<0.01;与模型组比,*P<0.05,**P<0.01。 | ||||
给药8 周后,与正常组相比,模型组大鼠子宫内膜面积和内膜厚度显著减小(P<0.01);与模型组相比,和颜坤泰胶囊低剂量组(2 g/kg)子宫内膜面积显著增加(P<0.01),和颜坤泰胶囊中、低(4、2 g/kg)剂量组子宫内膜厚度显著增加(P<0.05,P<0.01);补佳乐组子宫内膜面积及厚度显著增加(P<0.01)。结果见表 4。
| 组别 | 动物数 | 剂量(g/kg) | 子宫肌层面积(μm2) | 子宫肌层厚度(μm) |
| 正常组 | 8 | - | 147.73±13.85 | 6.85±0.32 |
| 假手术组 | 8 | - | 129.31± 8.16 | 6.41±0.20 |
| 模型组 | 8 | - | 75.34± 8.82## | 4.89±0.29## |
| 补佳乐组 | 8 | 0.2×10-3 | 121.69±13.48** | 6.22±0.34** |
| 莉芙敏组 | 8 | 0.06 | 83.07± 9.28 | 5.14±0.28 |
| 和颜坤泰高剂量组 | 8 | 8 | 78.94± 3.10 | 5.01±0.10 |
| 和颜坤泰中剂量组 | 8 | 4 | 85.81± 7.54 | 5.22±0.23* |
| 和颜坤泰低剂量组 | 8 | 2 | 90.38± 4.84** | 5.36±0.14** |
| 注:与正常组比,##P<0.01;与模型组比,*P<0.05,**P<0.01。 | ||||
给药8 周后,与正常组相比,模型组大鼠子宫上皮厚度和腺体数显著减小(P<0.01);与模型组相比,和颜坤泰胶囊中、低(4、2 g/kg)剂量组子宫上皮厚度显著增加(P<0.05,P<0.01),和颜坤泰胶囊低剂量组(2 g/kg)子宫腺体数显著增加(P<0.05);补佳乐组子宫上皮厚度显著增加(P<0.01),腺体数显著增加(P<0.05)。结果见表 5,图 1。
| 组别 | 动物数 | 剂量(g/kg) | 子宫上皮 厚度(μm) | 子宫腺 体数(个) |
| 正常组 | 8 | - | 89.22±19.78 | 33.67±10.71 |
| 假手术组 | 8 | - | 81.65±14.83 | 25.50± 9.14 |
| 模型组 | 8 | - | 40.96± 1.68## | 12.00± 2.68## |
| 补佳乐组 | 8 | 0.2×10-3 | 65.12± 8.90** | 21.17± 3.66* |
| 莉芙敏组 | 8 | 0.06 | 40.80± 5.28 | 13.33± 7.09 |
| 和颜坤泰高剂量组 | 8 | 8 | 42.67± 9.29 | 16.99± 4.90 |
| 和颜坤泰中剂量组 | 8 | 4 | 51.41± 4.83* | 17.83± 3.76 |
| 和颜坤泰低剂量组 | 8 | 2 | 61.95± 5.42** | 19.17± 3.13* |
| 注:与正常组比,##P<0.01;与模型组比,*P<0.05,**P<0.01。 | ||||
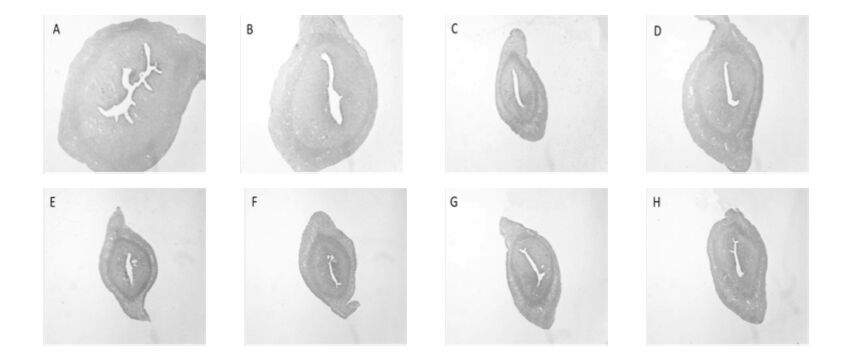
|
| 图 1 和颜坤泰胶囊对卵巢去势大鼠子宫形态学的影响(×40) Fig. 1 Effects of Heyan Kuntai capsules on uterus morphology of ovariectomized rats(×40) A:正常组;B:假手术组;C:模型组;D:补佳乐组;E:莉芙敏组;F: 和颜坤泰胶囊高剂量组;G: 和颜坤泰胶囊中剂量组;H: 和颜坤泰胶囊低剂量组 |
给药8 周后,与正常组相比,模型组大鼠子宫细胞凋亡率显著上升(P<0.01),Bcl-2 阳性面积百分比显著下降(P<0.01),Bax 阳性面积百分比显著上升(P<0.01);与模型组相比,和颜坤泰胶囊中、低(4、2 g/kg)剂量组细胞凋亡率显著下降(P<0.05,P<0.01),Bcl-2 阳性面积百分比显著升高(P<0.05,P<0.01),Bax 阳性面积百分比显著下降(P<0.05,P<0.01);补佳乐组子宫细胞凋亡率显著下降(P<0.01),Bcl-2 阳性面积百分比显著上升(P<0.01),Bax 阳性面积百分比显著下降(P<0.01);莉芙敏组子宫细胞凋亡率显著下降(P<0.05),Bcl-2 阳性面积百分比显著上升(P<0.05),Bax 阳性面积百分比显著下降(P<0.05)。结果见表 6,图 2-4。
| 组别 | 动物数 | 剂量(g/kg) | 组别细胞凋亡率(%) | Bcl-2 阳性面积百分比(%) | Bax 阳性面积百分比(%) |
| 正常组 | 8 | - | 4.17±0.48 | 24.67±2.32 | 7.13±1.29 |
| 假手术组 | 8 | - | 6.72±0.56 | 18.84±1.69 | 10.72±1.64 |
| 模型组 | 8 | - | 18.12±1.49## | 9.60±1.15## | 16.85±1.00## |
| 补佳乐组 | 8 | 0.2×10-3 | 9.24±1.49** | 17.84±1.43** | 11.28±2.13** |
| 莉芙敏组 | 8 | 0.06 | 13.36±2.26* | 11.61±1.29* | 14.61±1.10* |
| 和颜坤泰高剂量组 | 8 | 8 | 16.93±2.03 | 10.52±0.59 | 16.06±1.04 |
| 和颜坤泰中剂量组 | 8 | 4 | 14.63±0.77* | 12.19±2.11* | 14.50±2.05* |
| 和颜坤泰低剂量组 | 8 | 2 | 10.96±1.15** | 15.25±2.24** | 13.53±1.36** |
| 注:与正常组比,##P<0.01;与模型组比,*P<0.05,**P<0.01。 | |||||
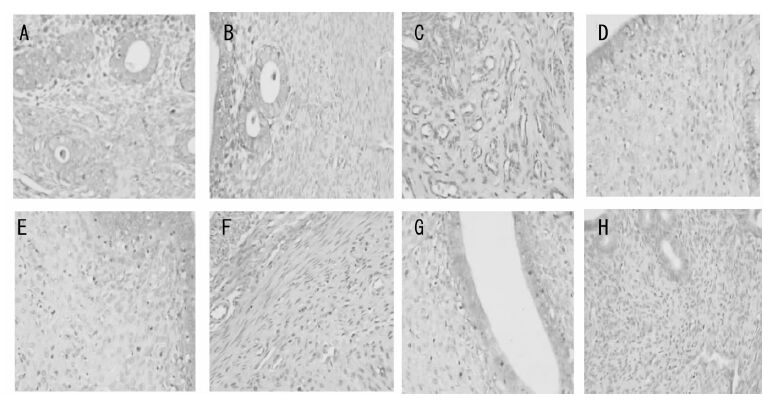
|
| 图 2 和颜坤泰胶囊对卵巢去势大鼠子宫细胞凋亡的影响(×400) Fig. 2 Effects of Heyan Kuntai capsules on cell apoptosis in uterus of ovariectomized rats(×400) A:正常组;B:假手术组;C:模型组;D:补佳乐组;E:莉芙敏组;F:和颜坤泰胶囊高剂量组;G:和颜坤泰胶囊中剂量组;H:和颜坤泰胶囊低剂量组 |
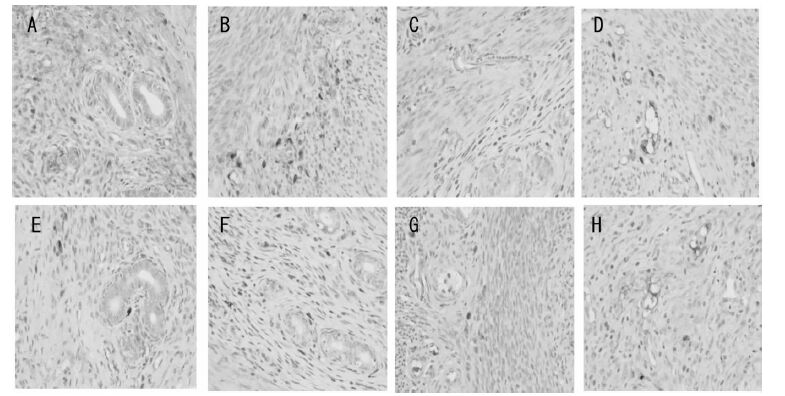
|
| 图 3 和颜坤泰胶囊对卵巢去势大鼠子宫Bcl-2 蛋白阳性表达的比较(×400) Fig. 3 Effects of Heyan Kuntai capsules on expression of Bcl-2 protein in uterus of ovariectomized rats(×400) A:正常组;B:假手术组;C:模型组;D:补佳乐组;E:莉芙敏组;F:和颜坤泰胶囊高剂量组;G:和颜坤泰胶囊中剂量组;H:和颜坤泰胶囊低剂量组 |
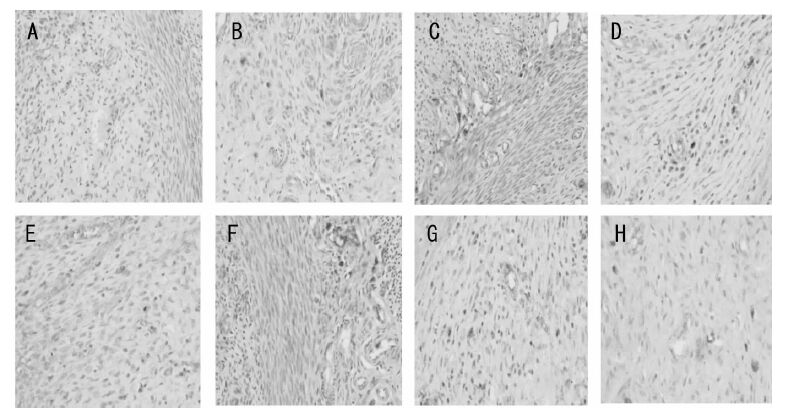
|
| 图 4 和颜坤泰胶囊对卵巢去势大鼠子宫Bax 蛋白阳性表达的比较(×400) Fig. 4 Effects of Heyan Kuntai capsules on expression of Bax protein in uterus of ovariectomized rats(×400) A:正常组;B:假手术组;C:模型组;D:补佳乐组;E:莉芙敏组;F:和颜坤泰胶囊高剂量组;G:和颜坤泰胶囊中剂量组;H:和颜坤泰胶囊低剂量组 |
给药8 周后,与正常组相比,模型组大鼠子宫Bcl-2 mRNA 表达显著降低(P<0.01),BaxmRNA 表达显著上升(P<0.01);与模型组相比,和颜坤泰胶囊中、低(4、2 g/kg)剂量组子宫Bcl-2mRNA 表达显著增加(P<0.05,P<0.01),Bax mRNA表达显著降低(P<0.05,P<0.01)。补佳乐组子宫Bcl-2mRNA 表达显著增加(P<0.01),Bax mRNA 表达显著降低(P<0.01);莉芙敏组子宫Bcl-2 mRNA 表达显著增加(P<0.05),BaxmRNA 表达显著降低(P<0.05)。结果见表 7。
| 组别 | 动物数 | 剂量(g/kg) | Bcl-2 mRNA相对含量 | Bax mRNA相对含量 |
| 正常组 | 8 | - | 0.87±0.16 | 1.09±0.12 |
| 假手术组 | 8 | - | 0.68±0.17 | 1.15±0.15 |
| 模型组 | 8 | - | 0.32±0.04## | 1.65±0.15## |
| 补佳乐组 | 8 | 0.2×10-3 | 0.63±0.14** | 1.24±0.13** |
| 莉芙敏组 | 8 | 0.06 | 0.52±0.07* | 1.42±0.08* |
| 和颜坤泰高剂量组 | 8 | 8 | 0.36±0.08 | 1.67±0.11 |
| 和颜坤泰中剂量组 | 8 | 4 | 0.50±0.17* | 1.47±0.11* |
| 和颜坤泰低剂量组 | 8 | 2 | 0.58±0.13** | 1.30±0.08** |
| 注:与正常组比;##P<0.01;与模型组比,*P<0.05,**P<0.01。 | ||||
子宫是雌性动物生成月经和孕育胎儿的场所,是性激素的主要靶器官,由子宫内膜、肌层和外膜组成,其中子宫内膜由上皮和固有层构成。子宫结构和功能的正常对于女性生殖和全身机能的调节具有重要意义。妇女进入更年期后,由于下丘脑-垂体-卵巢轴的衰退,卵巢分泌的雌激素减少,子宫内膜逐渐萎缩,细胞凋亡加速,最终导致子宫萎缩,失去其应有的功能[13]。本实验通过卵巢去势大鼠模拟人类更年期综合征,实验结果显示:摘除卵巢后大鼠子宫明显萎缩,横截面积减小,肌层和内膜变薄,腺体减少,内膜细胞凋亡率明显升高,给予和颜坤泰胶囊治疗后,去势大鼠子宫横截面积增大,子宫内膜、肌层增厚,腺体数增加,推测和颜坤泰胶囊可能直接作用于子宫,促进大鼠子宫上皮生长,提高腺体数目,改善子宫内膜状态,缓解子宫萎缩。表明和颜坤泰胶囊具有一定的营养子宫并改善其功能的作用。
细胞凋亡普遍存在于多种组织和器官,性激素诱导并维持性器官及组织的发生发育,其撤退导致相应性腺组织的退行性病变,这是细胞凋亡的一种典型模式[14]。目前公认的参与凋亡的主要通路有线粒体通路和死亡受体通路。Bcl-2 蛋白家族在细胞凋亡中起重要调节作用[15],它们共同构成一个非常复杂的相互作用网络,调控细胞凋亡。Bcl-2 家族可以分为两类:一类是抗细胞凋亡基因,其代表是Bcl-2 基因,研究已证实Bcl-2 基因通过抑制细胞凋亡从而延长多种细胞寿命[16];另一类是促细胞凋亡基因,其代表是Bax 基因,而Bax 基因的过量表达,可以加速细胞死亡[17]。Bcl-2 家族影响细胞凋亡的途径比较复杂,有实验表明,Bcl-2 家族成员通过调节线粒体外膜的通透性和完整性调控细胞的凋亡[18-19]。本实验发现,摘除卵巢后,大鼠子宫内膜细胞凋亡率明显升高,内膜Bax 阳性表达上升,而Bcl-2 的阳性表达下降,说明雌激素下降后子宫细胞表达趋向凋亡。给予和颜坤泰胶囊治疗后抑制了细胞凋亡率,上调了Bcl-2 蛋白的表达,下调了Bax蛋白的表达,推测和颜坤泰胶囊抑制细胞凋亡的机制可能主要是对Bc1-2 表达的上调作用以及对Bax表达的下调作用。
综上,和颜坤泰胶囊能有效的抑制子宫细胞凋亡缓解子宫萎缩,这对于子宫结构衰变的防护及改善有积极的意义。其抑制子宫细胞凋亡的机制可能是通过调控Bcl-2 和Bax 的基因与蛋白的表达,然而对其是通过什么途径来调控Bcl-2 家族蛋白的表达的研究还有待进一步深入。本实验结果有助于从子宫细胞凋亡方向了解和颜坤泰胶囊治疗更年期综合征的分子基础,从而为明确其药理作用和机制提供新的靶标。
| [1] | Mandal A, Chaudhuri ABD. Anthropometric-hormonal correlation:an overview[J]. J Life Sci, 2010, 2 (2) : 65–71. |
| [2] | 彭连双, 张志强, 孙建辉, 等. 知柏地黄丸加减治疗女性更年期综合征108例疗效观察[J]. 中医临床研究, 2015, 7 (16) : 124–125. |
| [3] | 刘惠玉. 知柏地黄丸治疗女性更年期综合征105例[J]. 中医临床研究, 2015, 7 (17) : 118. |
| [4] | 李晨晨, 孙立军. 更年期方治疗围绝经期心肾不交型失眠50例总结[J]. 湖南中医杂志, 2015, 31 (11) : 79–80. |
| [5] | 姜岩. 加味逍遥丸联合乌鸡白凤丸治疗更年期综合征疗效观察[J]. 中国冶金工业医学杂志, 2015, 32 (6) : 674. |
| [6] | 王烨, 徐莲薇, 朱芝玲. 调更汤对围绝经期雌性大鼠生殖内分泌影响的实验研究[J]. 上海中医药杂志, 2014, 48 (12) : 72–74. |
| [7] | 蔡熙, 黄晖, 王岚. 围绝经期动物模型的研究进展[J]. 中国实验方剂学杂志, 2007, 10 : 71–73. |
| [8] | 吴琼. 坤泰胶囊改善围绝经期综合征的疗效分析[J]. 实用妇科内分泌杂志, 2015, 2 (6) : 47–49. |
| [9] | 关素珍, 蒋赟. 坤泰胶囊对更年期综合征患者性激素及血脂的影响[J]. 实验方剂学杂志, 2014, 20 (20) : 218–221. |
| [10] | 张绍芬, 刘旸, 谢倩, 等. 坤泰胶囊(更年宁心胶囊)对更年期大鼠卵巢及子宫内膜组织形态的影响[J]. 中华老年医学, 2004, 23 (9) : 648–652. |
| [11] | 段燕康, 李芳, 李进东, 等. 坤泰胶囊对更年期雌鼠激素水平及围绝经期综合征的影响[J]. 中国医院药学, 2014, 34 (6) : 432–435. |
| [12] | 陈奇. 中药药效研究思路与方法[M]. 北京: 人民卫生出版社, 2005 : 949 |
| [13] | 徐睿来. 清热更年方对更年期模型大鼠作用的实验研究[J]. 现代预防医学, 2011, 38 (5) : 866–868. |
| [14] | 薛晓鸥, 牛建昭, 王继峰, 等. 大豆异黄酮对去卵巢大鼠子宫细胞凋亡影响的研究[J]. 中日友好医院学报, 2005, 19 (1) : 28–31. |
| [15] | Ouyang YB, Giffard RG. Cellular neuroprotective mechanisms in cerebral ischemia:Bcl-2 family proteins and protection of mitochon-drial function[J]. Cell Calcium, 2004, 36 (3/4) : 303–311. |
| [16] | Zhang H, Li Q, Li Z, et al. The protection of Bcl-2 over expression on rat cortical neuronal injury caused by analogous ischemia/reper-fusion in vitro[J]. Neurosci Res, 2008, 62 (2) : 140–146. DOI:10.1016/j.neures.2008.07.002 |
| [17] | 刁振奇, 柳璐, 李云涛, 等. 细胞凋亡机制的研究进展[J]. 郑州铁路职业技术学院学报, 2010, 22 (3) : 37–40. |
| [18] | Lin HH, Chen JH, Huang CC, et al. Apoptotic effect of3, 4-dihy-droxybenzoic acid on human gastric carcinoma cells involving JNK/p38MAPK signaling activation[J]. Int J Cancer, 2007, 120 (11) : 156–161. |
| [19] | Brajuskovicg, R iickisv, Cer vics, et al. BCL-2 and Bax protein in-teraction in B-lymphoeytes of peripheral blood in patients with chroni lymphocytic leukemia[J]. Vojnosanit Pregl, 2005, 62 (5) : 357–363. DOI:10.2298/VSP0505357B |
 2016, Vol. 33
2016, Vol. 33