文章信息
- 顾星, 姚少姿, 皮佳鑫, 刘博缨, 韩煦, 刘志东
- GU Xing, YAO Shao-zi, PI Jia-xin, LIU Bo-ying, HAN Xu, LIU Zhi-dong
- 基于Ussing Chamber技术的红景天苷大鼠肠黏膜透过性研究
- Study on permeabilities of Salidroside via rat mesentery mucosa by using Ussing Chamber
- 天津中医药, 2016, 33(11): 689-693
- Tianjin Journal of traditional Chinese Medicine, 2016, 33(11): 689-693
- http://dx.doi.org/10.11656/j.issn.1672-1519.2016.11.14
-
文章历史
- 收稿日期: 2016-04-25
2. 天津中医药大学, 天津市现代中药重点实验室-省部共建国家重点实验室培育基地, 天津 300193
红景天苷(Salidroside) 是景天科红景天属(Rhodiola rosea L.)红景天的主要药效成分之一,具有耐缺氧、抗衰老,治疗糖尿病、冠心病、肺源心脏病及老年痴呆症,降血脂、降血糖,增强免疫功能,抗肝纤维化等作用[1]。红景天苷属于酚类物质,极性大,亲水性强,油水分配系数较小[2],胃肠道黏膜透过性差,口服生物利用度低,从而影响了红景天苷的疗效充分发挥,限制了其广泛应用。对于红景天苷的口服吸收的机制还尚不明确,可能原因有肠黏膜紧密连接的阻碍[3]、主动外排作用[4]等。UssingChamber 技术早期用于研究上皮组织的离子转运,目前,其应用主要集中在药学领域,具有快捷、简便等特点,能在离体情况下模拟胃肠道生理环境,通过监测组织的电生理变化,比较真实地反映上皮细胞在体内的实时状态,常用于药物的渗透性和转运机制的研究[5]。本实验采用Ussing Chamber 技术,以红景天苷为模型药物,初步研究红景天苷在大鼠肠黏膜中的透过情况,为红景天苷的进一步开发利用提供一定理论依据。
1 仪器与材料 1.1 实验仪器Ussing Chamber 仪器(美国生理仪器公司,信号采集系统为ADInstruments Pty Ltd,数据处理软件为LabChart7.2);超高效液相-质谱/质谱(UPLC-MS/MS,Agilent 1690 型UPLC 色谱仪,Agilent 6460 Triple Quad LC/MS 型三重四极杆串联质谱仪);DKB-501A 型水浴锅(上海精宏实验设备有限公司);台式通用冷冻离心机(美国ThermoFisher 公司);XP205 电子天平(瑞士METTLERTOLEDO 公司);ALC -110.4 电子天平(德国ACCULAB 公司);Milli -Q 超纯水系统(美国Millipore 公司)。
1.2 实验材料红景天苷(Salidroside/Sal,中新药业,批号:W16-1-3,纯度≥98.0%);维拉帕米(Verapamil/Ver,Sigma,MDL No.:MFCD00055208,纯度≥99.0%);十二烷基硫酸钠(SDS)、二水磷酸二氢钠(NaH2PO4·2H2O)、无水氯化钙(CaCl2)、氯化钠(NaCl 分析纯)、氯化钾(KCl)、碳酸氢钠(NaHCO3)、六水氯化镁(MgCl2·6H2O)和葡萄糖(D-glucose)均为分析纯。
1.3 实验动物健康SD 大鼠,雄性,大鼠体质量250~300 g,购买自中国人民解放军军事医学科学院卫生环境医学研究所,动物合格证号:SCXK-(军)2014-0001。相关研究遵照动物实验原则进行。
2 方法与结果 2.1 溶液配制 2.1.1 Krebs-Ringer(K-R)溶液及K-R 肠液的配制称取CaCl2:2.78 g,KCl:3.51 g,MgCl2·6H2O:2.44 g,NaH2PO4·2H2O:1.44 g 置于烧杯中,加去离子水500 mL 充分溶解,即得储备液;称取NaCl:6.84 g,NaHCO3:2.10 g,D-glucose:1.98 g 置于1 000 mL 容量瓶中,加入适量去离子水充分溶解,加入储备液50 mL,以去离子水定容摇匀,再通入混合气体(95%O2-5%CO2)15 min,待pH 值变为7.2~7.4 时,即得K-R 溶液。截取适宜长度的大鼠肠段,用冰浴过的生理盐水冲洗干净后,置于K-R 溶液中,于37.5 ℃下共孵育一段时间,即得K-R 肠溶液。
2.1.2 对照品溶液配制取Sal 对照品,精密称量,以K-R 溶液为溶剂制备成每1 mL 含2.5 mg Sal 的母液。
2.1.3 供试品溶液配制分别精密吸取“2.1.2”项下的Sal 对照品母液,用K-R 溶液稀释为50、100、200、400 mg/L Sal 溶液。
分别精密吸取已配制的2.5 g/L Ver 溶液和“2.1.2”项下的Sal 对照品母液,用K-R 溶液稀释为100 mg/L Sal-100 mg/L Ver、100 mg/L Sal-200 mg/LVer 溶液[6]。
分别取SDS,精密称量,加入K-R 溶液溶解,再分别精密吸取“2.1.2”项下的Sal 对照品母液,用KR溶液稀释为100 mg/L Sal -0.5 g/L SDS、100 mg/LSal-1 g/L SDS、100mg/L Sal-2 g/L SDS 溶液。
2.2 Ussing Chamber 实验 2.2.1 系统装置准备Ussing Chamber 系统主要由以下部分组成:尤斯室、电压电流钳、数据采集系统与数据分析软件,另外有配有恒温水浴箱、混合气体(95% O2-5% CO2)循环系统等。将电极头(由琼脂糖、3 mol/mL KCl 等组成)接入装置,尤斯室两边各加入5 mL K-R 溶液,将系统电压和电流调零,以消除溶液和系统电阻对肠黏膜的影响。
2.2.2 大鼠肠黏膜制备将大鼠禁食16~18 h 后,断颈处死,即刻开腹取出不同肠段。选择十二指肠、空肠、回肠、结肠为考察肠段,每个肠段分别截取10~15 cm,用生理盐水冲洗干净,置入冰浴的K-R溶液中培养10 min。每个肠段剪取2~3 cm,于冰浴板上小心剥离浆膜层,将分离好的肠黏膜固定于样本夹中即可。
2.2.3 接收液收集与处理将制备好的样本固定于尤斯室中,即刻于装置的黏膜侧和浆膜侧分别加入5 mL K-R 溶液,并开始采集各项电生理指标(钳制电压为5 mV,每1 min 给1 次电刺激,持续时间为0.2 s)。实验中持续通入混合气体(95% O2-5%CO2)、并于37.5 ℃水浴维持肠黏膜的生物活性,平衡15~20min 待大鼠肠黏膜各项电生理指标稳定后[7],取出装置中的K-R 溶液,于黏膜侧和浆膜侧分别添加37.5 ℃水浴保温的5 mL 药液和新鲜K-R 溶液,并分别在加药后15、30、60、90、120、150、180 min,从浆膜侧取0.5 mL 接收液并立即补加新鲜K-R 溶液,将所取的接收液离心(12 000 r/min、4 ℃)10 min,取上清液于UPLC-MS/MS 进样分析。
2.3 分析方法建立 2.3.1 液相色谱-质谱条件液相色谱条件:色谱柱为Agilent Eclipse Plus C18 柱(2.1mm×50mm,1.8μm),柱温为30 ℃,进样量3 μL,流速:0.3 mL/min。流动相为:乙腈(A)-水(B),0~1.5 min:9%~10% A,1.5~3 min:10%-60% A,3~4 min:60%~9% A,4~6 min:9% A。
质谱条件为:电喷雾离子源(ESI),负离子模式,多级反应监测(MRM),碰撞电压为120 V,碰撞能0 eV,雾化气流速为13.0 L/min,雾化气温度为350 ℃,检测离子对为299.11→299.11 m/z。
2.3.2 线性关系将Sal 母液以空白K-R 肠溶液依次稀释浓度梯度为23.4、45.8、93.5、187.0、374.0、748.0、1 496.0、3 740.0 μg/L,于“2.4.1”项下的方法进样分析,以浓度对峰面积做线性回归得$\hat Y$=14.243X+30.318(r2=0.999 1),表明Sal 在23.4~3 740.0 μg/L 范围内线性关系良好。
2.3.3 精密度将浓度分别为46.8、187.0、1 496.0μg/L的Sal 溶液测定日内精密度RSD 值分别为2.86%、1.70%、0.99%,日间精密度RSD 值分别为6.18%、4.74%、3.91%。表明日内、日间精密度良好。
2.3.4 稳定性将接收液分别于0、2、4、6、8、10、12 h于“2.4.1”项下的方法进样分析。以峰面积计算RSD值为1.94%,说明样品在12 h 之内测定稳定性良好。
2.4 数据处理 2.4.1 单位面积累积透过量(Qtn)、单位面积转运速率(Flux)[8]和表观渗透系数(Papp)计算公式如下:
Qm=5ρtn+Σi=1n-10.5ρt(n-1),单位:ng
其中,ρtn 为设计时间点扩散池接收侧的药物质量浓度;0.5 和5 分别表示取样体积和加入供试液的体积(mL);
FluxdQ/dt·A,单位:ng/cm·min
Papp=(dQ/dt)×(1/A·ρ0),单位:cm/s
其中dQ/dt表示稳态时时间-累积透过量线性回归所得的斜率;ρ0 为给药侧供试液的初始质量浓度,A 为有效渗透面积( 0.5 cm2)。
2.4.2 肠黏膜跨膜电阻统计从开始记录组织电生理参数起,各通道每1 min 采集得到一个电阻值,再将每一个取样时间点与上一个取样时间点的该段时间内所有电阻值取平均值,作为该取样时间点的电阻值(给药前平衡时间内平均电阻值作为取样时间点零时刻的电阻值)。
2.4.3 统计学方法采用SPSS18.0 软件进行数据分析,结果以均数±标准差(x±s)表示,组间比较采用单因素方差分析,以P<0.05 为差异有统计学意义。
2.5 实验结果 2.5.1 大鼠肠黏膜活性研究在Ussing Chamber 实验过程中,通常以肠黏膜跨膜电阻来检测或者评价组织完整性并反应其活性[5]。本实验监测了大鼠各离体肠段(Sal 给药浓度为100 mg/L)在180 min内的跨膜电阻。由图 1 结果可知,各肠段跨膜电阻值在一正常范围值内波动;十二指肠、空肠、回肠和结肠的平均跨膜电阻值分别为(77.45±40.78)Ω/0.5 cm2、(82.95±48.02)Ω/0.5 cm2、(75.65±33.00)Ω/0.5 cm2、(86.67±52.26)Ω/0.5 cm2。结果表明实验时间内肠黏膜的生物活性较好。
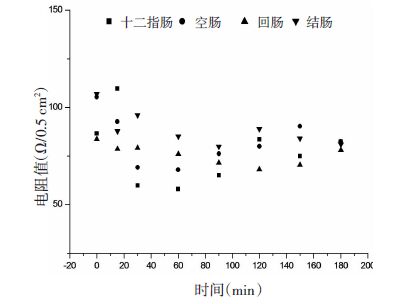
|
| 图 1 十二指肠、空肠、回肠和结肠的电阻值(n=11) Fig. 1 Resistance of duodenum,jejunum,ileumand colon(n=11) |
本实验以Ussing Chamber 技术,研究不同浓度的Sal 溶液在大鼠肠黏膜的透过情况。Sal 给药浓度分别为50、100、200、400mg/L 时,随着浓度的增加,大鼠各个肠段(十二指肠、空肠、回肠和结肠)对Sal Flux 显著增加(P<0.01)。而随着Sal 的浓度增加时,各肠段组内的Papp差异无显著性(P>0.05)。不同浓度下十二指肠、空肠、回肠和结肠总的Papp(Total)分别为(6.30±1.86)×10-6cm/s、(7.26±2.09)×10-6cm/s、(6.17±2.11)×10-6cm/s 和(6.67±1.46)×10-6cm/s,组间差异无显著性(P>0.05)。结果表明,Sal 在大鼠全肠段均有吸收,无明显的吸收窗,且Sal 的肠吸收具有浓度依赖性,以被动吸收为主。结果见表 1、表 2。
| Sal 给药浓度(mg/L) | 动物数 | Flux[ng/(min·cm)] | ||||
| 十二指肠 | 空肠 | 回肠 | 结肠 | |||
| 50 | 4 | 15.88±7.87 | 23.52±9.42 | 18.84±6.80 | 22.07±5.34 | |
| 100 | 4 | 38.46±11.85** | 39.52±7.76** | 35.63±8.52** | 38.54±8.74** | |
| 200 | 4 | 78.97±19.98** | 74.81±15.03** | 70.77±21.35** | 81.88±22.80** | |
| 400 | 4 | 170.30±28.87** | 205.70±49.98** | 171.09±81.09** | 151.66±26.82** | |
| 注:与Sal 给药50 mg/L 组比较,**P<0.01。 | ||||||
| Sal 给药浓度(mg/L) | 动物数 | Papp(×10-6cm/s) | |||
| 十二指肠 | 空肠 | 回肠 | 结肠 | ||
| 50 | 4 | 5.29±2.62 | 7.80±3.12 | 6.19±2.23 | 7.37±1.78 |
| 100 | 4 | 6.27±1.93 | 6.52±1.26 | 5.58±1.19 | 6.42±1.46 |
| 200 | 4 | 6.56±1.71 | 6.21±1.23 | 5.89±1.80 | 6.57±1.77 |
| 400 | 4 | 7.10±1.20 | 8.52±2.07 | 7.03±3.33 | 6.33±1.12 |
| Total | 4 | 6.30±1.86 | 7.26±2.09 | 6.17±2.11 | 6.67±1.46 |
| 注:不同浓度下,不同肠段之间相互比较,P>0.05。 | |||||
Ver 常被用作P-糖蛋白抑制剂来研究口服药物的转运机制[6, 9-10]。本实验分别以100、200 mg/L Sal 给药50 mg/L 两个给药浓度作为对照,考察Ver 对Sal 大鼠肠黏膜吸收的影响[4]。由表 3 结果可知,100 mg/L Ver 对100、200 mg/L Sal 在大鼠各肠段吸收并无显著促进作用(P>0.05)。本实验研究结果表明,大鼠离体肠黏膜对Sal 的吸收可能没有P-糖蛋白的参与。
| 组别 | 动物数 | Papp(×10-6cm/s) | |||
| 十二指肠 | 空肠 | 回肠 | 结肠 | ||
| 对照(100 mg/L Sal) | 4 | 6.27±1.93 | 6.52±1.26 | 5.58±1.19 | 6.42±1.46 |
| 100 mg/L Sal-100 mg/L Ver | 4 | 8.08±2.19 | 5.81±0.86 | 6.78±2.39 | 7.80±3.04 |
| 对照(200 mg/L Sal) | 4 | 6.56±1.71 | 6.21±1.23 | 5.89±1.80 | 6.57±1.77 |
| 200 mg/L Sal-100 mg/L Ver | 4 | 6.96±4.15 | 4.47±1.15 | 7.73±2.51 | 8.46±1.88 |
SDS 是一种阴离子表面活性剂,属于比较安全的口服吸收促进剂,打开紧密连接而促进药物的吸收是其促渗的作用机制之一[11]。本实验以100 mg/L Sal 作为对照,考察不同浓度的SDS(浓度分别为0.5、1、2 g/L)对Sal 的大鼠肠黏膜透过性影响。在十二指肠和空肠中,加入一定浓度的SDS,其Papp 无显著增加。在回肠中,随着加入SDS 浓度的升高,Papp 显著增加,当SDS 浓度为2 g/L 时,其Papp 增加至15.42×10-6cm/s(P<0.01),为对照组的2.76 倍。在结肠中加入一定浓度的SDS,Papp 也显著增加(P<0.05)。结果表明,一定浓度的SDS 能够显著促进Sal 在回肠和结肠的吸收。见表 4。
| 组别 | 动物数 | Papp(×10-6cm/s) | |||
| 十二指肠 | 空肠 | 回肠 | 结肠 | ||
| 对照(100 mg/L Sal) | 4 | 6.27±1.93 | 6.52±1.26 | 5.58±1.19 | 6.42±1.46 |
| 100 mg/L Sal-0.5 g/L SDS | 4 | 5.01±0.47 | 5.03±1.60 | 7.44±1.41 | 10.00±0.72* |
| 100 mg/L Sal-1 g/L SDS | 4 | 5.13±1.06 | 5.29±4.13 | 9.47±1.43* | 11.70±2.10* |
| 100 mg/L Sal-2 g/L SDS | 4 | 5.10±1.02 | 7.95±2.71 | 15.42±4.82** | 10.00±2.27* |
| 注:与对照组比较,*P<0.05,**P<0.01。 | |||||
Ussing Chamber 技术被国外学者誉为肠道屏障功能研究的金标准,常用于肠通透性、转运机制及保护肠道屏障功能机制等方面的研究[12],在实验过程中,通过监测肠黏膜跨膜电阻来检测或者评价组织完整性以及反映其活性[13-14]。在Ungell 等[15]利用Ussing Chamber 技术的研究中,要求大鼠小肠组织的跨膜电阻不得小于70 Ω/cm2。本实验在180 min 内监测到各肠段黏膜跨膜电阻始终在一定范围内波动,表明肠黏膜完整且活性状态良好[5]。而其他浓度的Sal(50、200、400 mg/L)以及加入Ver、SDS 后,对肠黏膜的电阻值并无影响,各肠段的电阻值(数据未列出)均在正常范围内波动。在数据处理过程中,以跨膜电阻作为参考指标,将电阻值超出范围的肠黏膜对应的相关参数不纳入数据统计,保证了实验结果更为真实可靠。
3.2 不同浓度Sal 肠黏膜透过情况本实验结果可知,各肠段对Sal 均有吸收且吸收程度相当,Sal在大鼠肠黏膜中转运具有浓度依赖性,主要以被动转运为主。Watanabe 等[16] 以Ussing Chamber 技术研究发现,当Papp> 2.5×10-5cm/s 时,可以认为药物容易被人体吸收。Sal 极性较大,亲水性强,属于溶解性好的药物,在本实验中发现Sal 于大鼠肠黏膜的累积百分透过率不足1%(数据未列出),按照口服药物的生物药剂学分类系统分类,Sal 属于高溶解性、低渗透性的Ⅲ类药物,而按照定量生物药剂学分类系统(QBCS)分类,由表 2 结果中各肠段的Papp(Total)可知,红景天苷属于边界药物(0.5 <q<1,2×10-6<Papp<10-5,其中q 为剂量数的倒数),对于该范围内的药物,对其吸收程度与剂量数和渗透性的相关性难以作出肯定的预测[17],仍需要广泛而深入的研究和探讨。
3.3 Sal 肠黏膜转运机制研究口服药物穿透小肠细胞的途径主要是细胞内途径和细胞间途径,药物经细胞内途径转运的机制包括被动扩散、外排泵参与的被动扩散和载体参与的主动转运3 种;大多数难以通过细胞间途径穿过生物膜的药物主要通过细胞间途径(与紧密连接相关)并以被动扩散的方式透过细胞膜,膜渗透性差的亲水性或水溶性药物的吸收及促进主要与细胞间的紧密连接相关[17]。Ver 是经典的P-糖蛋白抑制剂,而本实验发现100 mg/LVer 对100、200 mg/L Sal 在大鼠各肠段吸收并无促进作用,表明Sal 的大鼠肠吸收并没有P-糖蛋的参与,这与李科宇[4]以Caco-2 模型研究Sal 透过机制的结果并不一致,这可能与选择不同的评价模型有关,相关问题还需深入研究。
SDS 作为一种较安全的口服吸收促进剂,有学者以Caco-2 模型证明了SDS 可以打开紧密连接[11]从而促进药物的吸收。根据本实验结果,在十二指肠和空肠中,0.5、1、2 g/L SDS 对Sal 的吸收并无促进作用;而0.5、1、2 g/L SDS 能够显著增加大鼠回肠和结肠对Sal 的吸收,这可能与SDS 打开了回肠和结肠上皮细胞间的紧密连接有关。当然,对于口服药物在胃肠道中的转运是一个相当复杂的过程,并不仅仅受单方面因素的影响,而是多方因素共同作用的结果。
总的来说,以Ussing Chamber 技术在口服药物肠通透性和转运机制研究中,应用于难溶解性、低渗透性模型药物较多[15-16, 18],并且适用性较强,但是对于易溶解性、低渗透性模型药物的研究、尤其是对于转运机制方面研究相对较少,其适用性还需深入研究。
| [1] | 张雪松, 李英. 红景天苷现代药理作用概述[J]. 中国中西医结合肾病杂志, 2014, 3 (15) : 262–264. |
| [2] | 林俊芝, 邹亮, 傅超美, 等. 红景天苷和酪醇油水分配系数的测定及大鼠小肠吸收动力学研究[J]. 中成药, 2013, 3 (3) : 483–486. |
| [3] | 韦志坤, 程爱国. 肠黏膜细胞的紧密连接与肠壁通透性的研究进展[J]. 世界华人消化杂志, 2011, 19 (4) : 394–399. |
| [4] | 李科宇. 在大鼠体内红景天苷吸收、代谢及排泄过程的考察[D]. 吉林:延边大学, 2010. |
| [5] | Lane LC. A guide to Ussing chamber studies of mouse intestine[J]. Am J Physiol Gastrointest Liver Physiol, 2009, 296 (6) : 1151–1166. DOI:10.1152/ajpgi.90649.2008 |
| [6] | 黄海英. 基于P-GP转运体研究复方马蹄香抗焦虑胶囊主要成分的吸收机制[D]. 北京:北京中医药大学,2015. |
| [7] | Hongyu L, David NS, Martin JH. Transepithelial electrical measurements with the Ussing Chamber[J]. J Cyst Fibros, 2004, 3 (2) : 123–126. |
| [8] | 黎国富, 杨劲, 华小懿, 等. Ussing Chamber模型研究甘草酸二铵经大鼠肠黏膜的转运和代谢[J]. 中国中医药杂志, 2010, 35 (17) : 2261–2266. |
| [9] | 段炼. 辣椒素的肠道转运特性与TRPV1通道及多药耐药蛋白间的关系[D]. 广州:南方医科大学, 2013. |
| [10] | 沙先谊. 9-硝基喜树碱小肠吸收机制及其自微乳化给药系统的研究[D]. 上海:复旦大学, 2005. |
| [11] | Lecuyse EL, Sutton SC. In vitro models for selection of development candidate. Permeability studies to define mechanisms of absorption enhancement[J]. Adv Drug Deliv Rev, 1997, 23 (1-3) : 163–183. DOI:10.1016/S0169-409X(96)00434-6 |
| [12] | Guo N, Hu ZW, Fan XX, et al. Simultaneous determination of salidroside and its aglycone metabolite p -tyrosol in rat plasma by liquid chromatography-tandem mass spectrometry[J]. Molecules, 2012, 17 (4) : 4733–4754. |
| [13] | 杨振, 秦环龙. Ussing Chamber在肠道屏障功能研究中的进展[J]. 肠外与肠内营养, 2006, 13 (4) : 233–236. |
| [14] | 刘晓雷, 张莉, 顾星, 等. Ussing chamber技术在药物肠吸收方面的应用进展[J]. 中国新药杂志, 2015, 24 (6) : 644–648. |
| [15] | Ungell AL, Nylanders U, Gonschior AK, et al. Membrane transport of drugs in different regions of the intestinal tract of the ra t[J]. J Pharm Sci, 1998, 87 (3) : 360–366. DOI:10.1021/js970218s |
| [16] | Watanabe E, Takahashi M, Hayashi M. A possibility to predict the absorbability of poorly water-soluble drugs in humans based on rat intestinal permeability assessed by an in vitro chamber method[J]. Eur J Pharm Biopharm, 2004, 58 (3) : 659–665. DOI:10.1016/j.ejpb.2004.03.029 |
| [17] | 平其能. 中药成分的胃肠道转运与剂型设计[M]. 北京: 化学工业出版社, 2010 |
| [18] | 赵博欣, 孙亚彬, 段炼. 应用Ussing Chamber技术评价芹菜素与柚皮素经大鼠肠黏膜透过特征[J]. 中国药学杂志, 2011, 46 (20) : 1581–1586. |
2. Tianjin State Key Laboratory of Modern Chinese Medicine-Province and Ministry Co-established State Key Laboratory Cultivation Base, Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
 2016, Vol. 33
2016, Vol. 33