文章信息
- 张琦, 王淼, 樊官伟, 朱彦
- ZHANG Qi, WANG Miao, FAN Guan-wei, ZHU Yan
- 丹参及其活性成分舒张血管的作用网络和差异靶标分析
- Differential targets and networks for vasorelaxation by active components of Radix Salviae Miltiorrhizae
- 天津中医药, 2016, 33(12): 705-709
- Tianjin Journal of Traditional Chinese Medicine, 2016, 33(12): 705-709
- http://dx.doi.org/10.11656/j.issn.1672-1519.2016.12.01
-
文章历史
- 收稿日期: 2016-07-28
2. 天津国际生物医药联合研究院, 天津 300457
心血管系统是一个相对封闭的管腔系统,血管舒缩对其生理功能具有至关重要的意义。而血管的舒缩功能主要受血液状态、血管内皮和平滑肌三方面相互作用的影响[1]。各种心血管疾病都会不同程度损害血管的舒缩功能,如最常见的高血压病,故改善血管舒缩功能对其治疗具有重要意义。众所周知,中医药对心血管疾病的治疗具有自身独特优势[2],而丹参就是改善血管舒缩功能的重要代表中药。丹参,中药学上认为具有活血调经,祛瘀止痛,凉血消痈,除烦安神[3]的功效,目前广泛用于心血管疾病的治疗[4]。药理学研究表明,丹参对十多种疾病具有治疗作用[5]。笔者主要探讨丹参舒张血管的作用机制。以“丹参”和“血管舒张”或“丹参”和“血管收缩”为关键词在美国公众医学(PubMed)数据库中,筛选得到17篇相关研究的英文文献;另外在中国知网(CNKI)中检索到7篇相关的中文研究论文。然后按照丹参提取物、丹参中分离出的单体、丹参素代谢物等不同化学成分分类,总结当前对丹参舒张血管作用机制的研究进展,分析丹参对血管活性作用靶标的差异和研究前景。
1 丹参不同舒张血管活成分及其作用机制 1.1 丹参总提取物Lam FF等的研究表明丹参水溶性成分和脂溶性成分均可抑制血管平滑肌细胞的Ca2+内流,舒张大鼠离体股主动脉。另外K+通道的开放也有部分贡献[6];而且Lam FF等发现丹参水提物能够抑制平滑肌细胞的Ca2+内流,舒张大鼠离体冠状动脉[7]。
1.2 丹参素/丹参素钠丹参素是丹参中分离出的一种水溶性有效成分。丹参素钠是丹参素的钠盐,故将两者列入同一类别。Zhang N等[8]发现低剂量(0.1~0.3 g/L)丹参素钠瞬时增加Ca2+内流,微弱收缩离体大鼠胸主动脉;高剂量(1~3 g/L)丹参素钠开放血管平滑肌细胞非选择性K+通道和小电导钙敏感性K+通道,显著舒张血管环。张洁等[9]应用膜片钳技术发现丹参素能激活猪冠脉平滑肌细胞高电导钙激活钾通道[K(Ca)],进一步说明丹参素舒张血管和钾通道的开放相关。另外,Wang D等[10]发现丹参素能够促进内皮细胞合成前列环素(PGI2),进而舒张血管。
1.3 丹酚酸B丹酚酸B也是一种从丹参中提取出的水溶性成分,很多人专注于丹酚酸B的研究并取得很多成果。Kang DG等[11]发现丹酚酸B抑制血管紧张素转化酶(ACE)的活性舒张胸主动脉;而Lam FF等[12]发现丹酚酸B舒张主动脉的主要与抑制平滑肌细胞的Ca2+内流,其次是K+通道的开放有关。Pan C等[13]发现丹酚酸B对小鼠小动脉和冠状动脉均有舒张功能,主要通过促进内皮一氧化氮合酶(eNOS)系统产生一氧化氮(NO)舒张血管;Joe Y等[14]对小鼠主动动脉的研究也有类似发现。许波华[15]发现丹酚酸B不仅阻断平滑肌细胞受体操控性钙通道(ROCC)及电压依赖性钙通道(VDCC),也抑制三磷酸肌醇(IP3)受体介导的细胞内钙释放,最终舒张大鼠胸主动脉。Shou Q等[16]以日本大白兔胸主动脉为研究载体,发现丹酚酸B能够阻断外钙内流和兰尼碱受体依赖性的内钙释放,并激活一氧化氮-可溶性鸟苷酸环化酶-环磷酸鸟苷酸(NO-sGCcGMP)信号通路舒张血管;Chang CZ等[17]也发现丹酚酸B镁激活一氧化氮-可溶性鸟苷酸环化酶-蛋白激酶G(sGC-cGMP-PKG)通路、并且部分阻断Rho-激酶通路舒张血管。
1.4 丹参酮ⅡA/丹参酮ⅡA磺酸钠丹参酮ⅡA是丹参中分离出的脂溶性成分,丹参酮ⅡA磺酸钠为其钠盐,发挥作用的成分仍是丹参酮ⅡA。范英昌等[18]发现丹参酮ⅡA可以降低人脐静脉内皮细胞株(EVC-304)合成血管收缩因子内皮素(ET-1)和血栓素A2(TXA2),增加血管舒张因子NO的含量。李永胜等[19]发现丹参酮ⅡA可抑制血管紧张素Ⅱ(Ang Ⅱ)对猪胸主动脉内皮细胞分泌NO以及eNOS蛋白表达的负性作用。Fan G等[20]发现丹参酮ⅡA促进内皮细胞释放NO诱导大鼠胸主动脉的舒张。丹参酮ⅡA不仅影响内皮细胞释放血管舒缩因子,对平滑肌细胞离子通道的作用同样不容忽视,Yang Y等[21]发现丹参酮ⅡA磺酸钠通过激活大电导钙离子激活钾通道[BK(Ca)]舒张猪离体冠状动脉;Wu GB等[22]也发现丹参酮ⅡA对大鼠冠状动脉的舒张作用与激活BK(Ca)相关,而且丹参酮ⅡA诱导的内皮依赖性舒张与NO产生和细胞色素P450代谢物有关。王静[23]发现丹参酮ⅡA磺酸钠舒张大鼠离体肺动脉主要通过抑制外钙内流,其次是开放K (Ca)和抑制内钙释放。丹参酮ⅡA除了对正常的细胞株和动物有作用,对病理状态的大鼠也有显著效果,周亚光等[24]发现丹参酮ⅡA磺酸钠能够降低原发性高血压大鼠(SHR)血浆中的ET、AngⅡ的含量,Chan P等[25]也发现丹参酮ⅡA能够激活三磷酸腺苷敏感性钾通道[K(ATP)]降低细胞内Ca2+的浓度,舒张SHR大鼠主动脉。
1.5 二氢丹参酮和隐丹参酮二氢丹参酮和隐丹参酮都是从丹参中分离出来的亲脂性成分,Lam FF等发现二氢丹参酮通过抑制平滑肌细胞Ca2+内流,舒张大鼠离体冠状动脉[26];隐丹参酮也也能够抑制外钙内流,但是只能部分抑制CaCl2诱导的大鼠离体主动脉的收缩[27]。
1.6 丹参素异丙酯丹参素异丙酯(化学结构为β-(3,4-二羟基苯基)-α-羟基丙酸异丙酯)是丹参素在体内的主要代谢产物。Wang SP等[28]发现丹参素异丙酯抑制血管平滑肌细胞上受体介导的外钙内流和内钙释放舒张血管,K+通道的开放对血管舒张也有部分贡献。李静等[29]发现丹参素异丙酯内皮依赖性舒张大鼠肺小动脉,这种舒张作用不仅与NO、PGI2的产生有关,也与阻断ROCC和VDCC,激活K+通道有关。
2 现状和前景 2.1 血管活性研究现状和丹参作用点比较运用生物反应路径分析(IPA)归纳当前血管活性研究的最新通路(见图 1),对比前文可以看出丹参的作用点主要集中在:1)NO-sGC-cGMP通路和2)COXsAC-cAMP通路的激活产生NO和PGI2舒张血管;3)抑制内皮细胞分泌的ET-1、AngⅡ、TXA2以及氧自由基,进一步通过平滑肌上G蛋白偶联受体(GPCR)及下游的IP3受体抑制平滑肌的收缩而舒张血管;4)抑制Ca2+由钙通道进入平滑肌细胞,调控下游的RhoA/ROCK和兰尼碱受体(RYR2)对血管的收缩,实现血管舒张。
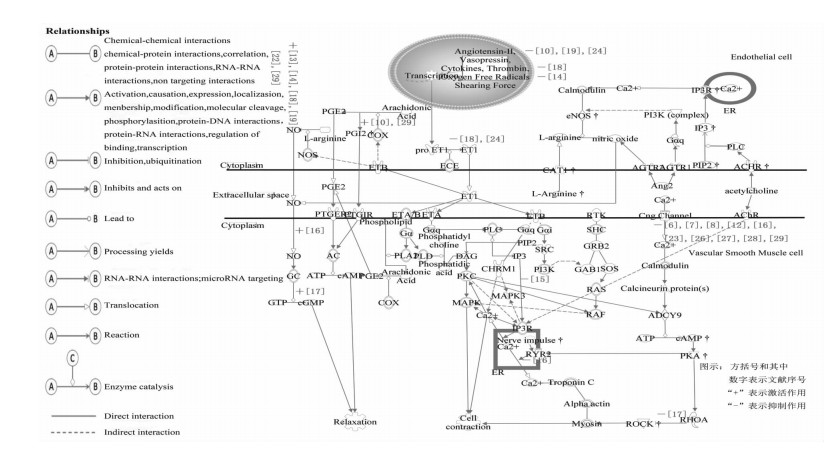
|
| 图 1 血管内皮和平滑肌细胞中舒缩血管相关信号通路和已知丹参作用靶点 Fig. 1 Signaling pathways for vasorelaxation between endothelial and smooth muscle cells and known targets of Radix Salviae Miltiorrhizae |
由于IPA只收录影响因子3以上的研究成果,所以除了以上4点,从表 1中可以知道丹参相关成分能够促进K+通道的开放,抑制平滑肌细胞外Ca2+内流,诱导血管舒张。这些钾通道主要包括K(ATP)、K (IR)、K (V)、K (Ca)[30], 血管平滑肌中又以K (ATP)、K (Ca)较为常见。而且对于钙通道,具体包括阻断外钙内流的VOCC和ROCC两种通道以及抑制细胞内钙库释放的IP3系统和兰尼碱受体。通过IPA通路图可以直观地看到一张血管舒缩作用网络,丹参舒张血管不仅与促进内皮细胞分泌舒血管因子(NO、PGI2)有关,对缩血管因子(TXA2、ET、AngⅡ)产生和血管平滑肌收缩的抑制也有很大贡献。血管收缩/舒张功能的平衡对血管正常功能的维持十分重要[31],血管舒张功能受损,可能是舒血管因子不足,也可能是缩血管因子过多;与中医理论“壮水之主,以制阳光;益火之源,以消阴翳”殊途同归。而丹参恰恰具有这种“双重性”功效,与化学药相比,丹参具有多种有效成分,多种作用机制共存的特点,不得不说是丹参的一大亮点,假以时日可能从丹参中发现更多具有“双重性”功效的成分。
| 药物成分 | 给药模型 | 药物活性 | 作用机制 | 文献来源 |
| 丹参水溶性提取物 | SD大鼠股主动脉环 | 舒张平滑肌 | 主要抑制平滑肌细胞Ca2+内流,其次开放K+通道 | [6] |
| SD大鼠冠状动脉环 | 舒张平滑肌 | 主要抑制平滑肌细胞Ca2+内流,K+通道的开放贡献较小 | [7] | |
| 丹参素/丹参素钠 | SD大鼠胸主动脉环 | 低剂量收缩血管 | 瞬时增加Ca2+内流 | [8] |
| 高剂量舒张血管 | 开放非选择性K+通道和小电导钙敏感K+通道 | [8] | ||
| 内皮依赖性舒张 | 提高COX-2的表达和PGI2的产生 | [10] | ||
| 猪冠脉动脉平滑肌细胞 | 激活K+通道 | 激活K (Ca) | [9] | |
| 丹酚酸B | SD大鼠胸主动脉环 | 内皮依赖性舒张血管 | 抑制ACE的活性 | [11] |
| 舒张平滑肌 | 主要抑制平滑肌细胞Ca2+内流,其次开放K+通道 | [12] | ||
| 舒张平滑肌 | 阻断ROCC和VDCC抑制Ca2+内流,抑制IP3介导的内钙释放 | [15] | ||
| C57小鼠微动脉/冠状动脉 | 激活eNOS通路 | 促进NO的产生 | [13] | |
| C57小鼠主动脉环 | 内皮依赖性舒张血管 | 抑制精氨酸酶的活性和活性氧的产生,增加NO产量 | [14] | |
| 日本大白兔胸主动脉环 | 舒张血管 | 抑制细胞膜上Ca2+通道的开放引起的Ca2+内流,抑制兰尼碱受体 依赖性的内钙释放,激活NO-sGC-cGMP信号通路 |
[16] | |
| 丹酚酸B镁 | 蛛网膜下腔出血SD大鼠 | 舒张血管 | 激活sGC-cGMP-PKG通路,部分阻断Rho-激酶通路 | [17] |
| 丹参酮ⅡA/ | 人脐静脉内皮细胞株 | 影响血管活性因子 | 降低ET-1和TXA2的含量,同时增加舒血管因子NO的含量 | [18] |
| 丹参酮Ⅱ A磺酸钠 | 猪胸主动脉内皮细胞 | 增加NO的分泌 | 抑制AngⅡ从而增加内皮细胞分泌NO以及促进eNOS表达 | [19] |
| SD大鼠胸主动脉环 | 内皮依赖性舒张血管 | 激活雌激素受体通路,提高eNOS表达,增加NO合成 | [20] | |
| 猪离体冠状动脉环 | 舒张平滑肌 | 激活BK (Ca) | [21] | |
| SD大鼠冠状动脉环 | 舒张血管 | NO和P450代谢物诱导的内皮性舒张,以及BK (Ca)的激活 | [22] | |
| SD大鼠肺动脉环 | 低剂量收缩血管 | 内皮释放缩血管因子 | [23] | |
| 高剂量舒张血管 | 主要抑制外钙内流,其次开放K (Ca)和抑制内钙释放 | [23] | ||
| SHR大鼠 | 影响血管活性因子 | 降低血浆ET、Ang Ⅱ含量 | [24] | |
| SHR大鼠主动脉环 | 舒张平滑肌 | 抑制K (ATP)降低细胞内Ca2+的浓度 | [25] | |
| 二氢丹参酮 | SD大鼠冠状动脉环 | 舒张平滑肌 | 抑制平滑肌细胞Ca2+内流 | [26] |
| 隐丹参酮 | SD大鼠冠状动脉环 | 部分舒张平滑肌 | 抑制平滑肌细胞Ca2+内流 | [27] |
| 丹参素异丙酯 | SD大鼠肠系膜动脉环 | 舒张平滑肌 | 抑制内钙的释放及ROCC和VDCC引起的Ca2+内流 | [28] |
| SD大鼠肺动脉环 | 舒张血管 | 促进血管内皮产生NO和PGI2产生的内皮依赖性舒张以及抑制 ROCC和VDCC引起的Ca2+内流、激活钾通道相关 |
[29] |
当前对丹参舒张血管的研究主要集中在主动脉,包括胸主动脉、冠状动脉、股主动脉、肺主动脉等;而对靶向性的微血管、外周血管研究较少,涉及到微动脉的只有两篇[13, 28]。有研究指出增加NO的产生是一种改善微循环障碍的新法[32],丹参既然能增加NO舒张主动脉,对微血管、微循环的作用应该也值得研究,可能取得可观的成果。另外,就是对配伍的研究,如笔者实验室近期的研究发现,在丹红注射液中丹参与红花的组合针对COX/PGI2介导的血管内皮依赖性舒张具有明显促进作用,而该作用的主要成分为丹参素[10]。今后对丹参舒张血管作用领域的研究中可以重点考察配伍使用的研究,如丹参葛根共提物[33-34]已经有人研究。多种含丹参成分的复方中成药具有不同程度的血管舒张效果,但复方配伍的规律和作用机制并不明确,有相当大的研究空间。而且,配伍不仅可以是中药成分和中药的联合使用[35],也可以是中药成分和西药的联合应用;在对丹参舒张血管功能的研究中,与西药配伍研究上基本处于空白状态,研究前景十分广阔。
| [1] | Ozkor MA, Quyyumi AA. Endothelium-Derived Hyperpolarizing Factor and Vascular Function[J]. Cardiology Research and Practice, 2011, 2011 : 1–12. |
| [2] | 陈晓玉. 中医药防治高血压病中的特色与优势[J]. 天津中医药, 2012, 29 (2) : 155–157. |
| [3] | 高学敏. 中药学[M]. 第7版. 北京: 中国中医药出版社, 2004 |
| [4] | 杨志霞, 林谦, 马利. 丹参对心血管疾病药理作用的文献研究[J]. 世界中西医结合杂志, 2012, 7 (2) : 93–96. |
| [5] | 许继文, 付春梅. 丹参的药理作用研究进展[J]. 医学综述, 2006, 12 (23) : 1467–1469. |
| [6] | Lam FF, Yeung JH, Cheung JH, et al. Pharmacological evidence for calcium channel inhibition by danshen (Salvia miltiorrhiza) on rat isolated femoral artery[J]. J Cardiovasc Pharmacol, 2006, 47 (1) : 139–145. DOI:10.1097/01.fjc.0000197540.12685.ce |
| [7] | Lam FF, Yeung JH, Chan KM, et al. Relaxant effects of danshen aqueous extract and its constituent danshensu on rat coronary artery are mediated by inhibition of calcium channels[J]. Vascul Pharmacol, 2007, 46 (4) : 271–277. DOI:10.1016/j.vph.2006.10.011 |
| [8] | Zhang N, Zou H, Jin L, et al. Biphasic effects of sodium danshensu on vessel function in isolated rat aorta[J]. Acta Pharmacol Sin, 2010, 31 (4) : 421–428. DOI:10.1038/aps.2010.24 |
| [9] | 张洁, 曾晓荣, 杨艳, 等. 丹参素对猪冠脉平滑肌细胞钙激活钾通道的作用[J]. 基础医学与临床, 2005, 25 (11) : 1054–1057. |
| [10] | Wang D, Fan G, Wang Y, et al. Vascular reactivity screen of Chinese medicine danhong injection identifies Danshensu as a NO-independent but PGI2-mediated relaxation factor[J]. J Cardiovasc Pharmacol, 2013, 62 (5) : 457–465. DOI:10.1097/FJC.0b013e3182a29657 |
| [11] | Kang DG, Oh H, Chung HT, et al. Inhibition of angiotensin converting enzyme by lithospermic acid B isolated from Radix Salviae miltiorrhiza Bunge[J]. Phytother Res, 2003, 17 (8) : 917–920. DOI:10.1002/(ISSN)1099-1573 |
| [12] | Lam FF, Yeung JH, Kwan YW, et al. Salvianolic acid B, an aqueous component of danshen (Salvia miltiorrhiza), relaxes rat coronary artery by inhibition of calcium channels[J]. Eur J Pharmacol, 2006, 553 (1-3) : 240–245. DOI:10.1016/j.ejphar.2006.09.030 |
| [13] | Pan C, Lou L, Huo Y, et al. Salvianolic acid B and tanshinone ⅡA attenuate myocardial ischemia injury in mice by NO production through multiple pathways[J]. Ther Adv Cardiovasc Dis, 2011, 5 (2) : 99–111. DOI:10.1177/1753944710396538 |
| [14] | Joe Y, Zheng M, Kim HJ, et al. Salvianolic acid B exerts vasoprotective effects through the modulation of heme oxygenase-1 and arginase activities[J]. J Pharmacol Exp Ther, 2012, 341 (3) : 850–858. DOI:10.1124/jpet.111.190736 |
| [15] | 许波华.丹酚酸B对心肌缺血大鼠血管新生及对正常大鼠离体胸主动脉环张力的影响[D].南京:南京中医药大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10315-1012402613.htm |
| [16] | Shou Q, Pan Y, Xu X, et al. Salvianolic acid B possesses vasodilation potential through NO and its related signals in rabbit thoracic aortic rings[J]. Eur J Pharmacol, 2012, 697 (1-3) : 81–87. DOI:10.1016/j.ejphar.2012.09.044 |
| [17] | Chang CZ, Wu SC, Kwan AL. Magnesium lithospermate B, an active extract of Salvia miltiorrhiza, mediates sGC/cGMP/PKG translocation in experimental vasospasm[J]. Biomed Res Int, 2014 : 272101. |
| [18] | 范英昌, 金树梅, 赵桂峰. 丹参酮ⅡA对EVC304细胞血管舒缩因子的影响[J]. 天津中医药大学学报, 2006, 25 (4) : 215–218. |
| [19] | 李永胜, 王照华, 梁黔生, 等. 丹参酮ⅡA对血管紧张素Ⅱ所致主动脉内皮细胞游离钙离子及产生一氧化氮的影响[J]. 中华高血压杂志, 2006, 14 (11) : 882–886. |
| [20] | Fan G, Zhu Y, Guo H, et al. Direct vasorelaxation by a novel phytoestrogen tanshinone ⅡA is mediated by nongenomic action of estrogen receptor through endothelial nitric oxide synthase activation and calcium mobilization[J]. J Cardiovasc Pharmacol, 2011, 57 (3) : 340–347. DOI:10.1097/FJC.0b013e31820a0da1 |
| [21] | Yang Y, Cai F, Li PY, et al. Activation of high conductance Ca (2+)-activated K (+) channels by sodium tanshinoneⅡ-A sulfonate (DS-201) in porcine coronary artery smooth muscle cells[J]. Eur J Pharmacol, 2008, 598 (1-3) : 9–15. DOI:10.1016/j.ejphar.2008.09.013 |
| [22] | Wu GB, Zhou EX, Qing DX. Tanshinone Ⅱ(A) elicited vasodilation in rat coronary arteriole:roles of nitric oxide and potassium channels[J]. Eur J Pharmacol, 2009, 617 (1-3) : 102–107. DOI:10.1016/j.ejphar.2009.06.046 |
| [23] | 王静.丹参酮ⅡA磺酸钠对大鼠离体肺动脉的作用及机制[D].西安:第四军医大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-90026-2010219633.htm |
| [24] | 周亚光, 屠恩远, 梁黔生, 等. 丹参酮对于高血压大鼠血浆中内皮素血管紧张素及心钠素的影响[J]. 中华中医药学刊, 2009, 27 (11) : 2294–2296. |
| [25] | Chan P, Liu IM, Li YX, et al. Antihypertension Induced by Tanshinone ⅡA Isolated from the Roots of Salvia miltiorrhiza[J]. Evid Based Complement Alternat Med, 2011 : 392627. |
| [26] | Lam FF, Yeung JH, Chan KM, et al. Dihydrotanshinone, a lipophilic component of Salvia miltiorrhiza (danshen), relaxes rat coronary artery by inhibition of calcium channels[J]. J Ethnopharmacol, 2008, 119 (2) : 318–321. DOI:10.1016/j.jep.2008.07.011 |
| [27] | Lam FF, Yeung JH, Chan KM, et al. Mechanisms of the dilator action of cryptotanshinone on rat coronary artery[J]. Eur J Pharmacol, 2008, 578 (2-3) : 253–260. DOI:10.1016/j.ejphar.2007.09.040 |
| [28] | Wang SP, Zang WJ, Kong SS, et al. Vasorelaxant effect of isopropyl 3-(3, 4-dihydroxyphenyl)-2-hydroxypropanoate, a novel metabolite from Salvia miltiorrhiza, on isolated rat mesenteric artery[J]. Eur J Pharmacol, 2008, 579 (1-3) : 283–288. DOI:10.1016/j.ejphar.2007.10.009 |
| [29] | 李静, 马欣, 臧伟进. 丹参素异丙酯对大鼠肺动脉的舒张作用及机制[J]. 中草药, 2009, 40 (1) : 82–86. |
| [30] | 任煜, 朱会超, 肖扬, 等. 血管离子通道的研究进展[J]. 天津中医药, 2013, 30 (9) : 573–576. |
| [31] | Triggle CR, Samuel SM, Ravishankar S, et al. The endothelium:influencing vascular smooth muscle in many ways[J]. Can J Physiol Pharmacol, 2012, 90 (6) : 713–738. DOI:10.1139/y2012-073 |
| [32] | Tousoulis D, Simopoulou C, Papageorgiou N, et al. Endothelial dysfunction in conduit arteries and in microcirculation. Novel therapeutic approaches[J]. Pharmacology & Therapeutics, 2014, 144 : 253–267. |
| [33] | Lam FF, Deng SY, Ng ES, et al. Mechanisms of the relaxant effect of a danshen and gegen formulation on rat isolated cerebral basilar artery[J]. J Ethnopharmacol, 2010, 132 (1) : 186–192. DOI:10.1016/j.jep.2010.08.015 |
| [34] | Ng CF, Koon CM, Cheung DW, et al. The anti-hypertensive effect of Danshen (Salvia miltiorrhiza) and Gegen (Pueraria lobata) formula in rats and its underlying mechanisms of vasorelaxation[J]. J Ethnopharmacol, 2011, 137 (3) : 1366–1372. DOI:10.1016/j.jep.2011.08.006 |
| [35] | 顾慧, 马叶涛, 寻明金, 等. 应用药物溶出/吸收仿生系统研究三七总皂苷与冰片的配伍规律[J]. 天津中医药, 2012, 29 (3) : 284–288. |
2. Tianjin International Joint Academy of Biotechnology & Medicine, Tianjin 300457, China
 2016, Vol. 33
2016, Vol. 33