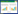文章信息
- 包秀丽, 刘婷婷, 张海涛, 张利民
- BAO Xiu-li, LIU Ting-ting, ZHANG Hai-tao, ZHANG Li-min
- 姜黄素通过Wnt/β-catenin信号通路抑制晶状体上皮细胞增殖的实验研究
- Curcumin regulation of human lens epithelail cell proliferation through Wnt/β-catenin signaling pathway
- 天津中医药, 2016, 33(12): 745-749
- Tianjin Journal of Traditional Chinese Medicine, 2016, 33(12): 745-749
- http://dx.doi.org/10.11656/j.issn.1672-1519.2016.12.11
-
文章历史
- 收稿日期: 2016-08-26
后囊膜混浊(PCO)是白内障囊外摘除术后最常见的并发症,大约有20%~40%的患者术后2~5 a会发生PCO。目前的研究认为PCO的发生主要是由于手术后残余的晶状体上皮细胞(LECs)增殖、迁移、发生上皮间充质转化,与沉积的胶原一起形成了晶状体囊袋内的纤维斑块[1]。姜黄素是姜黄的主要活性成分,近年来有研究发现姜黄素具有抑制肿瘤细胞生长、转移和抗炎作用。本实验在体外研究探讨了姜黄素对晶状体上皮细胞系HLE B-3细胞增殖的影响及其作用的信号通路,为今后PCO的防治提供部分实验依据。
1 材料与方法 1.1 材料与试剂SRA 01/04细胞株(中国医学科学院肿瘤细胞库);姜黄素(美国Sigma公司);右旋-缬氨酸基础培养液(DMEM)培养基、胎牛血清购自(美国Gibco公司);CCK -8试剂盒购自日本DOJINDO公司;甲基四唑蓝(MTT,美国Sigma公司); 脂质体转染试剂Lipofectamine 2000(美国Invitrogen公司); 小鼠抗人单克隆PCNA抗体、羊抗小鼠二抗(北京中杉公司);BCA蛋白定量试剂盒(Pierce公司);小鼠抗人β-catenin单克隆抗体、兔抗人cyclin D1单克隆抗体、兔抗人c-myc单克隆抗体、羊抗兔/小鼠二抗、小鼠抗人β-actin(Santa cruz公司)化学发光ECL法(Millipore公司);羊抗小鼠IgG Alexa Flour488(Invitrogen公司)。
1.2 仪器及试剂VD-650-U型超净工作台(上海楚度仪器设备有限公司);MCO-175型CO2培养箱(日本三洋集团);UV-1800 PC型紫外-可见分光光度计(广州科晓科学仪器有限公司);BS-300型全自动生化分析仪(深圳迈瑞生物医疗电子股份有限公司);Model-680型酶标仪(美国BIO-RAD公司);FACS Aria型流式细胞仪(美国BD公司);DYY-11型多用电泳仪、JY-SCZ2电泳槽(北京六一仪器厂); 倒置显微镜(日本Olympus IMT-413);共聚焦显微镜(德国Leica)。
1.3 细胞转染及实验分组将SRA 01/04细胞株放人含10%胎牛血清、DMEM培养液中,置于37℃、5%CO2的培养箱中培养。实验分为3组:Wnt3a组,姜黄素组,对照组。转染前l d,将对数生长期的细胞以每孔4×105的浓度接种于6孔板内,加入不含抗生素的DMEM(含15%胎牛血清)2 mL进行培养。Wnt3a组将4 μg构建的Wnt3a cDNA表达载体[1]和10 μL脂质体转染试剂Lipofectamine 2000分别用250 μL DMEM稀释,轻柔混匀,室温下孵育5 min,再将两者混合孵育20 min,加入6孔板的培养液中。姜黄素组在细胞转染Wnt3a cDNA表达载体后48 h加入20 μmol/L姜黄素, 为保证培养液中姜黄素的浓度,每24 h加入10 μmol/L姜黄素,加入姜黄素48 h后收集细胞做进一步分析测定,将pcDNA3-HA质粒转染作为对照组。
1.4 CCK-8细胞增殖实验细胞增殖能力用细胞增殖-毒性检测试剂盒(CCK8,购自东仁化学有限公司)检测。将Wnt3a组,姜黄素组和对照组细胞胰酶消化后接种至5个96孔板中,接种密度为2 000个/孔,每种细胞每板种18个复孔, 分别培养不同时间(1、2、3、4、5 d)后,每孔加5 g/L的CCK8溶液10 μL,37 ℃孵育3 h后, 酶标仪检测450 nm处的OD值,每组实验重复3次。
1.5 细胞免疫化学将pcDNA3-HA/SRA 01/04及Wnt3a/SRA 01/04细胞以5×104/mL提前铺于含有盖玻片的12孔盘中,4%多聚甲醛(PFA)固定10 min,磷酸盐缓冲液(PBS)冲洗,加入小鼠抗人单克隆PCNA抗体4 ℃孵育过夜,PBS冲洗,用羊抗小鼠二抗室温孵育30 min,二氨基联苯胺法(DAB)显色,苏木素复染,脱水,封片。于400×光学显微镜视野下计数阳性细胞数比例,每片计数10个视野,以阳性细胞百分数代表蛋白表达阳性率。
1.6 Western blotting在细胞中加入1×SDS细胞裂解液,获取细胞蛋白,BCA蛋白定量试剂盒测定蛋白质浓度后,取35 μg样品进行SDS-PAGE,电泳完毕后,应用电转仪将样品转移至PVDF膜,5%脱脂奶粉封闭1 h,分别加入一抗:小鼠抗人Wnt3a单克隆抗体(1:1 000)、兔抗人cyclin D1单克隆抗体(1: 1 000)和兔抗人c-myc单克隆抗体(1:1 000)4℃孵育过夜,洗膜后加入相应羊抗兔/小鼠二抗(1:5 000)室温孵育1 h,洗膜后化学发光ECL法显影,暗室曝光。以小鼠抗人β-actin(1:5 000)作为内参阳性对照。
1.7 免疫荧光将pcDNA3 -HA/SRA 01/04及Wnt3a/SRA 01/04细胞以5×104/mL提前铺于含有盖玻片的12孔盘中,4%多聚甲醛(PFA)固定10 min,PBS冲洗,50 mmol/L氯化铵焠灭游离PFA10 min;PBS冲洗,0.5% sponin室温处理10 min;PBS冲洗,3%BSA封闭室温1 h;PBS冲洗,加入小鼠抗人β-catenin单克隆抗体(1:50)4 ℃孵育过夜,PBS洗3次,加入羊抗小鼠IgG Alexa Flour488(1:200)避光室温1 h;PBS洗3次,加入4,6-二乙酰基-2-苯基吲哚酸盐(DAPI)染核,避光室温10 min;PBS洗2次,将盖玻片移至载玻片上,用抗荧光衰减封片剂mowoil封片,共聚焦显微镜观察、拍照。
1.8 统计学处理结果应用SPSS 16.0统计学软件处理系统进行定理。本研究测量指标的数据资料用均数±标准差(x±s)表示,组间的差异比较采用单因素方差分析,组间两两比较采用LSD-t检验,采用双尾检测法,以P<0.05为具有统计学意义。
2 结果 2.1 利用脂质体转染技术使SRA 01/04细胞中Wnt3a过表达收集经脂质体转染48 h后的SRA 01/04细胞蛋白,Western blot检测证实,与转染pcDNA3-HA的SRA 01/04细胞相比,转染Wnt3a cDNA表达载体的SRA 01/04细胞内Wnt3a蛋白表达明显升高,提示在SRA 01/04细胞中外源性Wnt3a基因得到了表达。见图 1。
|
| 图 1 pcDNA3-HA/SRA 01/04及Wnt3a/SRA 01/04细胞中Wnt3a蛋白的表达 Fig. 1 Expression of Wnt3a protein in pcDNA3-HA/SRA 01/04 and Wnt3a/SRA 01/04 cells 1:对照组;2:Wnt3a过表达组 |
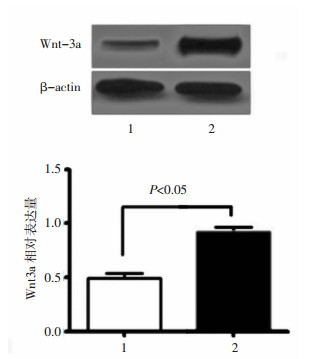
CCK-8实验检测结果显示,Wnt3a组OD值明显高于对照组及姜黄素组(F=7.219,P=0.016),证明SRA 01/04细胞转染Wnt3a cDNA表达载体后细胞增殖能力明显增强,组间两两比较姜黄素组OD值明显低于Wnt3a组(t=2.782,P=0.049),表明姜黄素抑制SRA 01/04细胞增殖。见图 2。
|
| 图 2 CCK8实验检测各组细胞在第1, 2, 3, 4, 5天的细胞增殖能力 Fig. 2 CCK8 assay was conducted to detect the proliferation ability of cells in 1, 2, 3, 4, and 5 d, respectively |
免疫细胞化学检测结果显示PCNA表达于SRA 01/04细胞的细胞核内,呈棕黄色,PCNA在姜黄素组和对照组的SRA 01/04细胞中表达阳性率较Wnt3a组低(23.6%±4.0%, 6.0%±1.6% vs 43.4%±5.4%,F=22.15,P=0.000 1),而在Wnt3a组中SRA 01/04细胞中表达阳性率较姜黄素组明显增加(43.4%±5.4% vs 23.6%±4.0%,t=2.951,P=0.018)。提示姜黄素能够抑制SRA 01/04细胞增殖。见图 3。

|
| 图 3 PCNA在各组细胞中的表达 Fig. 3 Expression of PCNA in each group 1:对照组;2:Wnt3a过表达组;3:Wnt3a过表达加姜黄素处理组 |
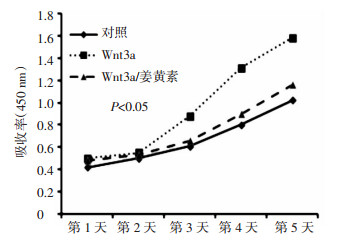
免疫荧光检测却发现β-catenin蛋白在Wnt3a组中SRA 01/04细胞胞浆和细胞核内大量积聚,而在对照细胞中却只分布在胞浆中,提示Wnt3a过表达引起细胞内的核转录激动因子β-catenin积聚并转入细胞核中,Wnt/β-catenin信号通路活化。而姜黄素组中β-catenin蛋白大部分分布于胞浆中,细胞核内只有少量β-catenin蛋白,说明姜黄素能够抑制Wnt/β-catenin信号通路的核转移。见图 4。
|
| 图 4 β-catenin在各组细胞中的表达 Fig. 4 Expression of β-catenin in each group 1:对照组;2:Wnt3a过表达组;3:Wnt3a过表达加姜黄素处理组 |
Western blotting检测结果显示,Wnt3a组的SRA 01/04细胞中Cyclin D1和c-Myc蛋白表达较对照组明显增加,而姜黄素组细胞中Cyclin D1和c-Myc蛋白表达明显减弱,表明Wnt/β-catenin信号通路活化后,可引起Cyclin D1和c-Myc的表达增加,而姜黄素能够抑制Wnt/β-catenin信号通路的核内靶基因Cyclin D1和c-Myc的表达。见图 5。
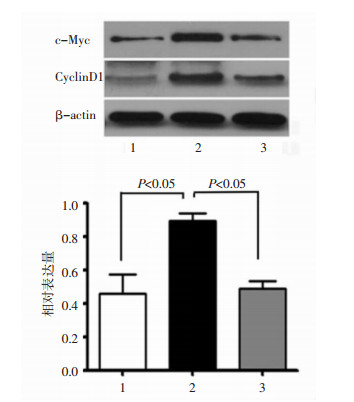
|
| 图 5 c-Myc和CyclingD1在各组细胞中的表达 Fig. 5 Expression of c-Myc and CyclingD1 in each group 1:对照组;2:Wnt3a过表达组;3:Wnt3a过表达加姜黄素处理组 |
姜黄素是姜黄中提取的一种植物多酚,也是姜黄药理作用的主要活性成分。中医认为姜黄能行气、散风活血、通经止痛,近年的研究证明姜黄具有防癌抗癌、抗纤维化、抗炎、抗氧化、清除自由基以及促进凋亡等作用[2-3]。已有研究发现,姜黄素能有效抑制EGF诱导的LEC增殖[4],而姜黄素-羟甲基-β-环糊精能够抑制兔眼PCO的发生,但其发生机制尚不清楚[5]。研究发现,姜黄素能够通过调节P53、PTEN、Caspase-3、Hedgehog及NF-κB等信号通路活性,发挥肿瘤抑制作用细胞及诱导凋亡[6-7],还可能通过下调Wnt/β-catenin通路抑制胶质瘤细胞增殖[8]。
笔者前期的实验发现Wnt/β-catenin信号通路与晶状体上皮细胞的增殖密切相关,β-catenin是经典Wnt信号通路中关键的信号蛋白,Wnt3a诱导经典Wnt信号通路活化,促进β-catenin在细胞质中积聚并转移入细胞核中,激活核内靶基因的转录[1]。其中,cyclin D1和c-Myc基因是Wnt/β-catenin信号通路重要的核内靶基因,也是细胞增殖的重要调控因子,其上调能够促进细胞由G1期向S期转换,促进处于休眠状态的细胞进入分裂期,从而影响细胞周期,从而促进晶状体上皮细胞增殖[9]。姜黄素还可以通过下调的β-catenin和c-Myc的表达抑制胶质瘤细胞的增殖[8]。通过Western blot和免疫荧光技术检测β-catenin蛋白的表达,观察到在转染Wnt3a cDNA后的SRA01/04细胞内存在β-catenin的核内积聚,证明转染后产生Wnt3a目的蛋白,并分泌到细胞外,与相关的膜受体结合并使细胞内的β-catenin转入细胞核内,活化Wnt/β-catenin信号通路,而姜黄素能够抑制Wnt3a诱导的β-catenin核转染,从而抑制Wnt/β-catenin信号通路的活化。
CCK-8实验结果显示姜黄素抑制SRA 01/04细胞的增殖。Kim TD等[10]发现姜黄素可以通过减弱Wnt信号通路及细胞间黏附,使HCT-116细胞停滞于G2/M期并使其凋亡。应用cDNA芯片的方法分析调节细胞周期相关的基因表达,结果发现姜黄素诱导细胞阻滞于G0/G1和/或G2/M期,从而抑制细胞增殖[11-12]。免疫细胞化学检测还发现,Wnt/β-catenin信号通路活化后SRA 01/04细胞核内PCNA蛋白呈现高表达,PCNA是真核细胞DNA合成时所必需的一种细胞周期调节酸性核蛋白,其在细胞核中阳性表达的程度与细胞增殖活性密切相关[13]。
本研究发现姜黄素通过抑制Wnt/β-catenin信号通路下调SRA 01/04细胞中cyclin D1和c-Myc蛋白表达。一些研究已表明姜黄素能够通过下调cyclin D1和c-Myc的表达,降低分裂期细胞的比例,从而抑制细胞增殖[12, 14]。在对姜黄素抑制肿瘤和心血管保护作用机制研究中发现姜黄素能够调节某些基因表达和相关的信号传导通路,基因芯片技术检测发现c-Myc是姜黄素治疗的重要靶基因。Myc是转录因子螺旋-环-亮氨酸拉链家族的成员之一,能够形成MYC-MAX复合物,Myc是一种肿瘤基因蛋白产物,参与肿瘤细胞增殖、分化和凋亡[15]。10 nmol的姜黄素可以将Myc mRNA的表达下调60%,还有实验发现姜黄素治疗后仅有21.95%的细胞表达Myc基因[15-16],而体内实验也证明姜黄素通过下调c-Myc基因表达抑制细胞增殖[17]。姜黄素可以下调cyclin D1和p21抑制从而非小细胞性肺癌的肿瘤干细胞的增殖,还可以降低髓母细胞瘤细胞的β-catenin和其靶基因cyclin D1的表达,使细胞周期停滞于G2/M期,抑制肿瘤的增殖[18]。这一结果与其他体外实验结果相似[19]。
本研究结果表明Wnt3a通过抑制Wnt/β -catenin信号通路下调cyclin D1和c-Myc的表达,进而发挥抑制人晶状体上皮细胞增殖作用。由于PCO的发生发展是一个多阶段逐步演变的过程,手术后残余的晶状体上皮细胞的异常增殖是PCO早期阶段重要的病理变化之一,提示姜黄素可作为PCO基因治疗或预防的新靶点。
| [1] | Bao XL, Song H, Chen Z, et al. Wnt3a promotes epithelial-mesenchymal transition, migration, and proliferation of lens epithelial cells[J]. Mol Vis, 2012, 18 : 1983–1990. |
| [2] | Zhang X, Chen Q, Wang Y, et al. Effects of curcumin on ion channels and transporters[J]. Front Physiol, 2014, 11 (5) : 94. |
| [3] | HE Y, Yue Y, Zheng X, et al. Curcumin, inflammation, and chronic diseases:how are they linked[J]. Molecules, 2015, 20 (5) : 9183–9213. DOI:10.3390/molecules20059183 |
| [4] | Hu YH, Huang XR, Qi MX, et al. Curcumin inhibits proliferation of human lens epithelial cells:a proteomic analysis[J]. J Zhejiang Univ Sci B, 2012, 13 (5) : 402–407. DOI:10.1631/jzus.B1100278 |
| [5] | Wang WY, Zhang ZJ, Wang J, et al. An experimental study on the effects of curcumin on posterior capsule opacification in young rabbit eyes[J]. Chin Med J (Engl), 2011, 124 (21) : 3527–3531. |
| [6] | Du WZ, Feng Y, Wang XF, et al. Curcumin suppresses malignant glioma cells growth and induces apoptosis by inhibition of SHH/GLI1 signaling pathway in vitro and vivo[J]. CNS Neuroci Ther, 2013, 19 (12) : 926–936. DOI:10.1111/cns.2013.19.issue-12 |
| [7] | Zanotto-Filho A1, Braganhol E, Edelweiss MI, et al. The curry spice curcumin selectively inhibits cancer cells growth in vitro and in preclinical model of glioblastoma[J]. J Nutr Biochem, 2012, 23 (96) : 591–601. |
| [8] | 马光涛, 张燕, 李晨龙, 等. 姜黄素通过Wnt/β-catenin信号通路调控胶质瘤细胞增殖和凋亡的实验研究[J]. 中华神经外科杂志, 2015, 31 (6) : 625–630. |
| [9] | 包秀丽, 宋慧, 汤欣. Wnt3a促进人晶状体上皮细胞增生及相关机制的研究[J]. 中华实验眼科杂志, 2012, 30 (6) : 500–504. |
| [10] | Kim TD, Fuchs JR, Schwartz E, et al. Pro-growth role of the JMJD2C histone demethylase in HCT-116 colon cancer cells and identification of curcuminoids as JMJD2 inhibitors[J]. Am J Transl Res, 2014, 6 (3) : 236–247. |
| [11] | Sobolewski C, Muller F, Cerella C, et al. Celecoxib prevents curcumin-induced apoptosis in a hematopoietic cancer cell model[J]. Mol Carcinog, 2015, 54 (10) : 999–1013. DOI:10.1002/mc.v54.10 |
| [12] | Xu MX, Zhao L, Deng C, et al. Curcumin suppresses proliferation and induces apoptosis of human hepatocellular carcinoma cells via the wnt signaling pathway[J]. Int J Oncol, 2013, 43 (6) : 1951–1959. |
| [13] | Konno S, Takebayashi Y, Aiba M, et al. Clinicopathological and prognostic significance of thymidine phosphorylase and proliferating cell nuclear antigen in gastric carcinoma[J]. Cancer Lett, 2001 (166) : 103–111. |
| [14] | Prakobwong S, Gupta SC, Kim JH, et al. Curcumin suppresses proliferation and induces apoptosis in human biliary cancer cells through modulation of multiple cell signaling pathways[J]. Carcinogenesis, 2011, 32 (9) : 1372–1380. DOI:10.1093/carcin/bgr032 |
| [15] | Zhou M, Fan C, Tian N, et al. Effects of curcumin on the gene expression profile of L-02 cells[J]. Biomed Rep, 2015, 3 (4) : 519–526. |
| [16] | Kakar SS, Roy D. Curcumin inhibits TPA induced expression of c-fos, c-jun and c-myc proto-oncogenes messenger RNAs in mouse skin[J]. Cancer Lett, 1994, 87 (1) : 85–89. DOI:10.1016/0304-3835(94)90413-8 |
| [17] | Chrapusta S, Sieinski W, Konopka B, et al. Estrogen and progestin receptor levels in uterine leiomyomata:relation to the tumour histology and the phase of menstrual cycle[J]. Eur J Gynaecol Oncol, 1990, 11 (5) : 381–387. |
| [18] | He M, Li Y, Zhang L, et al. Curcumin suppresses cell proliferation through inhibition of the Wnt/β-catenin signaling pathway in medulloblastoma[J]. Oncol Rep, 2014, 32 (1) : 173–180. |
| [19] | Kumar P, Kadakol A, Shasthrula PK, et al. Curcumin as an adjuvant to breast cancer treatment[J]. Anticancer Agents Med Chem, 2015, 15 (5) : 647–656. DOI:10.2174/1871520615666150101125918 |
 2016, Vol. 33
2016, Vol. 33