文章信息
- 于华, 贾伟娜, 刘金平, 朱彦, 王春华
- YU Hua, JIA Wei-na, LIU Jin-ping, ZHU Yan, WANG Chun-hua
- UPLC-Q-TOF-MS法分析连花清瘟胶囊的入血成分
- Analysis of absorbed components in rat plasma after oral administration of Lianhua Qingwen capsules by UPLC-Q-TOF-MS
- 天津中医药, 2016, 33(12): 756-759
- Tianjin Journal of Traditional Chinese Medicine, 2016, 33(12): 756-759
- http://dx.doi.org/10.11656/j.issn.1672-1519.2016.12.13
-
文章历史
- 收稿日期: 2016-07-01
2. 天津国际生物医药联合研究院中药新药研发中心, 天津 300457
连花清瘟胶囊由经典名方“麻杏石甘汤”和“银翘散”两种方剂化裁而来,由金银花、连翘、鱼腥草、大黄、甘草等13味中药制成,具有清瘟解毒、宣肺泄热之功效,常用于治疗流行性感冒属热毒袭肺症。本课题组前期对连花清瘟胶囊的化学组成、质控方法、抗病毒、抗炎的网络药理学[1-4]进行了系统的研究。但是连花清瘟胶囊在体内以何种成分、何种形式发挥作用, 至今未有研究报道。因此, 有必要对连花清瘟胶囊的入血成分进行详细的分析, 初步阐明其药效的物质基础。
本研究建立在前期对连花清瘟胶囊主要成分的定性及定量分析研究的基础上,采用UPLC-Q-TOFMS技术,通过对连花清瘟胶囊灌胃给药大鼠后的血浆、空白血浆以及混合对照品溶液进行对比分析,根据色谱峰保留时间、质谱裂解规律,结合文献和对照品的有关信息,对连花清瘟胶囊主要入血成分进行分析,为揭示该中药复方给药后发挥抗病毒、抗炎的体内药效物质提供了一定的实验依据。
1 仪器与药材 1.1 仪器与试剂Waters ACQUITY UPLCTM system超高效液相色谱仪(美国Waters公司);Waters Synapt HDMS G1 Q -TOF质谱仪(美国Waters公司);METTLER TOLEDO XP6十万分之一天平(瑞士METTLER公司);氮吹仪(美国Organomation Associates Inc);超声波清洗器(昆山市超声仪器有限公司);低温高速离心机(美国Thermo Forma公司);XW-80A涡旋混合器(上海沪西分析仪器厂);Milli -Q纯水仪(Millipore, Milford, MA, USA)。甲醇(色谱纯),购自美国Fisher Scientific公司;甲酸(色谱纯),购自美国Fisher Scientific公司。
1.2 材料连花清瘟胶囊由石家庄以岭药业有限公司提供(批号121003)。没食子酸(110831-201204)购自中国食品药品检定研究院;马钱苷酸、大黄酚葡萄糖苷、断氧马钱子苷、大黄素-8-O-葡萄糖苷、大黄素购自美国Sigma公司,其批号分别为:060513、02S14、01Y14、092413、07X12;绿原酸、隐绿原酸、芦丁、甘草素、甘草酸购自天津中新药业有限公司,其批号分别为:W00-5-3、W15-7-5、W14-2-9、W13-7-2、W13-0-3;新绿原酸、红景天苷、连翘酯苷E、獐牙菜苷、芹糖甘草苷、金丝桃苷、苦杏仁苷、芹糖异甘草苷、大黄酸购自四川维克奇生物科技有限公司,其批号分别为:130317、130228、130511、130311、130502、130222、130127、130201、130315;异甘草苷(13071823)购自上海同田生物技术有限公司;芒柄花黄素(13050801)购自成都曼斯特生物科技有限公司。以上标准品的纯度均≥98%。
1.3 实验动物健康雄性大鼠,许可证号:SCXK-(军)2012-0004,品系SD,级别SPF,体质量(200±20)g,购自中国军事科学院。
2 实验方法 2.1 色谱条件Waters ACQUITY UPLC BEH C18(100×2.1 mm,1.7 μm)色谱柱;流动相:甲醇B-0.1%甲酸水溶液A,梯度洗脱:0~11 min,5%~35% B;11~18 min,35%~55% B;18~22 min,55%~75% B;22~24 min,75%~90% B;24~25 min,90%~100% B;25~30 min,100% B;柱温50 ℃,流速0.3 mL/min,进样体积5 μL。
2.2 质谱条件离子源:ESI;电离模式:负离子;毛细管电压:2.6 KV;锥孔电压:45 V;离子源温度:100 ℃;脱溶剂气温度:350 ℃;脱溶剂氮气流速:600 L/h;一级扫描范围:m/z 150~1 000 Da。
2.3 对照品溶液和供试品溶液的制备 2.3.1 对照品溶液的制备取没食子酸、马钱苷酸、大黄酚葡萄糖苷、断氧马钱子苷、大黄素-8-O-葡萄糖苷、大黄素、绿原酸、隐绿原酸、芦丁、甘草素、甘草酸、新绿原酸、红景天苷、连翘酯苷E、獐牙菜苷、芹糖甘草苷、金丝桃苷、苦杏仁苷、芹糖异甘草苷、大黄酸、异甘草苷和芒柄花黄素对照品适量,精密称定,用甲醇溶解并定容得到浓度分别为1.0 g/L的对照品储备液。吸取各对照品溶液适量,用30%的甲醇水溶液稀释成各对照品浓度约为16.7 mg/L的混合对照品溶液,进样5 μL分析。
2.3.2 供试品溶液的制备称取连花清瘟胶囊适量,配制成浓度为0.2 g/mL的混悬水溶液,供灌胃用。
2.4 血浆样品的采集受试大鼠预适应一周,给药前12 h禁食不禁水,按照给药体积10 mL/kg(0.2 g/mL),临床4倍用药量)平行灌胃6只大鼠,于给药前及给药后0、5、10、15、20、30、60、90、120、180、240和360 min从大鼠眼眶后静脉丛取血约0.3~0.4 mL,置肝素抗凝管中,8 000 r/min离心10 min,分离血浆,于-80 ℃保存。
2.5 血浆样品的处理精密吸取各时间点血浆100 μL,按1:3(v/v)加入甲醇,涡旋3 min,沉淀蛋白,14 000 r/min离心10 min,吸取上清液,30 ℃氮气流挥干液体,加入5%甲醇50 μL复溶,涡旋混匀后,14 000 r/min离心10 min,取各上清液40 μL涡旋混匀,即得混合血浆样品,进样5 μL分析。
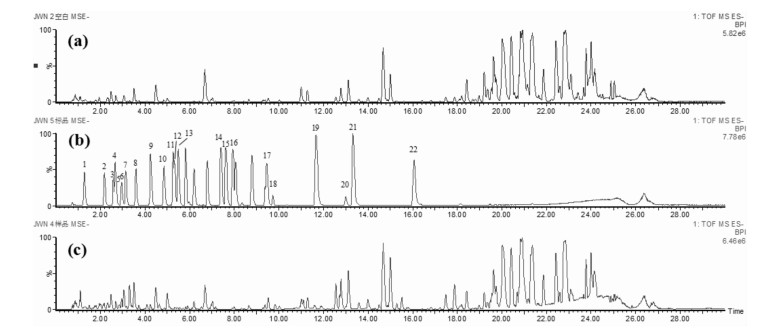
3 实验结果与讨论 3.1 负离子检测模式下样品的总离子流图同时采集空白血浆、混合对照品溶液、各采血时间点混合血浆负离子模式下的总离子流色谱图,见图 1。
|
| 图 1 空白血浆(a)、混合对照品溶液(b)、口服给药莲花清瘟胶囊后各采血时间点混合血浆(c)的UPLC-Q-TOF-MS负离子模式下的色谱图 Fig. 1 UPLC-Q-TOF-MS chromatograms of blank plasma (a), the mixed references solution (b), and the mixed plasma after oral administration of Lianhua-Qingwen (c) in negative ion mode |
由图 1可知大鼠血浆中的内源性物质不干扰22种成分的测定,基线平稳, 说明本实验选用的甲醇沉淀蛋白,然后用流动相初始浓度复溶血浆样品的样品前处理方法科学合理。将空白血浆与各采血时间点混合血浆的数据进行对比处理,扣除空白血浆中的内源性成分的干扰,结合色谱峰保留时间及质谱碎裂规律,发现22个化学成分都能被吸收进入血液,其中16个成分峰型较好,碎片信息准确,包括红景天苷(3)、连翘酯苷E(4)、马钱苷酸(5)、苦杏仁苷(8)、獐牙菜苷(9)、断氧马钱子苷(10)、芹糖甘草苷(13)、芹糖异甘草苷(14)、异甘草苷(15)、甘草素(16)、大黄素-8-O-葡萄糖苷(17)、大黄酚葡萄糖苷(18)、芒柄花黄素(19)、大黄酸(20)、甘草酸(21)、大黄素(22),主要为黄酮、蒽醌、苯丙素和环烯醚萜类化学成分,此外亦有五环三萜和其他类成分,具体的质谱数据见表 1。
| 序号 | TR (min) | Formula | [M-H]-(ppm) | MS2a | Identification |
| 1 | 1.272 | C7H6O5 | 169.0123(-1.4) | 125.0234[M-H-CO2]- | 没食子酸(Gallic acid)[9] |
| 2 | 2.169 | C16H17O9 | 353.0899(7.4) | 191.0180[M-H-Ca]- | 新绿原酸(Neochlorogenic acid)[10] |
| 3 | 2.588 | C14H20O7 | 299.1133(0.7) | 345.1186[M+HCOO]-, 179.0333[M-H-C8H8O]- | 红景天苷(Salidroside)[11] |
| 4 | 2.666 | C20H30O12 | 461.1854(-1.6) | 315.1057[M-H-Rha]-,135.0438[M-H-Rha-Glc-H2O]- | 连翘酯苷E (Forsythoside E)[12] |
| 5 | 2.716 | C16H24O10 | 375.1281(-1.0) | 125.0562[M-H-Glc-2CO2]- | 马钱苷酸(Loganic acid)[13] |
| 6 | 2.951 | C16H17O9 | 353.0532(6.5) | 191.0559[M-H-Ca]-, 179.0339[Caffeic acid-H]- | 绿原酸(Chlorogenic acid)[14] |
| 7 | 3.157 | C16H17O9 | 353.0918(-3.7) | 179.0338[Caffeic acid-H]- | 隐绿原酸(Cryptochlorogenic acid[14] |
| 8 | 3.598 | C20H27NO11 | 456.1495(-2.4) | 502.1537[M+HCOO]- | 苦杏仁苷(Amygdalin)[10] |
| 9 | 4.26 | C16H22O9 | 357.1198(3.4) | 403.1240[M+HCOO]-,393.0950[M+Cl]- | 獐牙菜苷(Sweroside)[13] |
| 10 | 4.885 | C17H24O11 | 403.1238(-0.5) | 807.2584[2M-H]- | 断氧马钱子苷(Secoxyloganin)[15] |
| 11 | 5.22 | C27H30O16 | 609.1426(4.8) | 301.0754[M-H-Rut]- | 芦丁(Rutin) |
| 12 | 5.334 | C21H20O12 | 463.0613(1.5) | 301.0337[M-H-Glc]- | 金丝桃苷(Hyperin)[17] |
| 13 | 5.469 | C26H30O13 | 549.1603(-0.9) | 255.0653[M-H-Api-Glc]- | 芹糖甘草苷(Liqumtm apioside)[18] |
| 14 | 7.361 | C26H30O13 | 549.1609(0.2) | 255.0785[M-H-Api-Glc]- | 芹糖异甘草苷(Isoliquiritin apioside)[18] |
| 15 | 7.638 | C21H22O9 | 417.1187(0.2) | 255.0781[M-H-Glc]- | 异甘草苷(Isoliquiritin)[18] |
| 16 | 7.951 | C15H12O4 | 255.0659(0.8) | 135.0851 [M-H-VP]-, 145.0498[M-H-RL]-, 117.0505 [M-H-RL-CO]- | 甘草素(Liquiritigenin)[19] |
| 17 | 9.474 | C21H20O10 | 431.0898(3.2) | 269.0446[M-H-Glc]-,225.0545[M-H-Glc-CO2]-, 182.0360[M-H-Glc-CO2-CH3-CO]- | 大黄素-8-O-葡萄糖苷(Emodin-8-O-glucoside)[20] |
| 18 | 9.709 | C21H20O9 | 415.1024(-1.2) | 253.0493[M-H-Glc]- | 大黄酚葡萄糖苷(Chrysophanol glucoside)[20] |
| 19 | 11.636 | C16H12O4 | 267.0654(-1.1) | 芒柄花黄素(Formononetin) | |
| 20 | 13.03 | C15H8O6 | 283.0240(-1.1) | 239.0341[M-H-CO2]- | 大黄酸(Rhem)[21] |
| 21 | 13.279 | C42H62O16 | 821.3963(0.4) | 759.3951[M-H-H2O-CO2]-,645.3547[M-H-GlcA]-, 469.3253[M-H-2GlcA]-,351.2169[2GlcA-H]- | 甘草酸(Glycyrrhizic acid)[22] |
| 22 | 16.046 | C15H10O5 | 269.0445(-1.9) | 241.1798[M-H-CO]-,225.0539[M-H-CO2]-,197.0654 [M-H-CO-CO2]-, 182.0883[M-H-CO2-CH3-CO]- | 大黄素(Emodin)[23] |
| 注:a Api=apiose, Ca=caffeoyl, Glc=glucose, GlcA=glucuronic acid, Rha=rhamnose, RL=resorcinol, Rut=rutinose, VP=4-vinylphenol. | |||||
在血液采集的过程中,凝血时激活或释放的酶可能会降解以及吸附中药的有效成分,研究指出血浆比血清更接近体内的实际情况,多个入血成分鉴定的实验结果也证实了这一结论[24],所以本实验鉴定入血成分时采用血浆。
本实验采用各采血时间点混合后测样,而非单一采血时间点分别测样。本实验的目的是研究连花清瘟胶囊入血的总成分,由于不同物质在体内代谢过程不同,各种化合物的达峰时间和半衰期不同,单时间点采血测样,连花清瘟胶囊中化合物浓度小,数量少,时间点不易选取,将各采血时间点的样品混合后测样,有利于测到尽可能多的入血成分。
4.2 入血成分鉴定结果血浆成分分析存在着含量低、组分多、分离难,生物个体差异大的特点,质谱法测定入血成分快速、微量、精确。本实验结果显示连花清瘟22个主要化学成分均能被吸收进入血液,16个成分质谱峰峰型较好,其中没食子酸(1)、新绿原酸(2)、绿原酸(6)、隐绿原酸(7)、芦丁(11)、金丝桃苷(12)等6个化合物峰较小,分子离子峰相对较低。原因可能是连花清瘟胶囊中6种成分含量较低,并且该保留时间范围内干扰峰较多。本实验血浆样品中,均检测到22种原型入血成分,但由于血浆中化合物浓度较低,混合时间点取样以及对代谢产物的研究有限,未确定是否有新的代谢产物出现。
5 小结连花清瘟胶囊为治疗病毒性感冒常用中成药,本研究采用UPLC-Q-TOF-MS方法鉴定了连花清瘟胶囊的22种入血的原型成分,推测其可能为连花清瘟发挥药效的物质基础。为进一步探究其作用机制,拟进一步对22种入血成分进行抗炎、抗病毒的体外活性测试,期望筛选出具有抗炎、抗病毒的活性单体。
| [1] | 刘金平, 贾伟娜, 李东, 等. 连花清瘟胶囊原料药的化学成分研究[J]. 天然产物研究与开发, 2015, 27 (11) : 1887–1891. |
| [2] | 贾伟娜, 王春华, 王宏涛, 等. HS-SPME-GC/MS法分析连花清瘟胶囊制剂原料中的挥发性成分[J]. 天津中医药, 2015, 27 (2) : 110–112. |
| [3] | Jia WN, Wang CH, Wang YF, et al. Qualitative and quantitative analysis of the major constituents in Chinese medical preparation Lianhua-Qingwen capsule by UPLC-DAD-QTOF-MS[J]. The Scientific World Journal, 2015 (2015) : Aticle ID 731765. |
| [4] | Wang CH, Zhong Y, Zhang Y, et al. A network analysis of the Chinese medicine Lianhua-Qingwen formula to identify its main effective components[J]. Molecular BioSystems, 2016, 12 (2) : 606–613. DOI:10.1039/C5MB00448A |
| [5] | Lan W, Bian L, Zhao X, et al. Liquid chromatography/quadrupole time-of-flight mass spectrometry for identification of in vitro and in vivo metabolites of bornyl gallate in rats[J]. Journal of Analysis Methods in Chemistry, 2013 (2013) : Article ID 473649. |
| [6] | Zhang L, Zhu L, Wang Y, et al. Characterization and quantification of major constituents of Xue Fu Zhu Yu by UPLC-DAD-MS/MS[J]. Journal of Pharmaceutical and Biomedical Analysis, 2012, 62 : 203–209. DOI:10.1016/j.jpba.2011.12.026 |
| [7] | Guo N, Hu Z, Fan X, et al. Simultaneous determination of salidroside and its aglycone metabolite p-tyrosol in rat plasma by liquid chromatography-tandem mass spectrometry[J]. Molecules, 2012, 17 (4) : 4733–4754. |
| [8] | 简龙海, 胡青, 钟吉强, 等. LC-MS/MS法测定痰热清注射液中连翘酯苷E的含量[J]. 药物分析杂志, 2013, 33 (3) : 435–438. |
| [9] | Deng S, West BJ, Jensen CJ. UPLC-TOF-MS characterization and identification of bioactive iridoids in cornus mas fruit[J]. Journal of Analytical Methods in Chemistry, 2013 (2013) : Article ID 710972. |
| [10] | 王放, 张加余, 王青, 等. HPLC-HR-MSn法鉴定苦碟子注射液中酚酸类成分[J]. 中南药学, 2013, 11 (8) : 561–565. |
| [11] | 郑重飞.金银花和鸡桑的化学成分与生物活性研究[D].北京:北京协和医学院, 2010. http://www.tiprpress.com/zcy/html/2014/24/20142427.htm |
| [12] | Yao X, Zhou G, Tang Y, et al. A UPLC-MS/MS method for qualification of quercetin-3-O-β-D-glucopyranoside-(4→1)-α-L-rhamnosidein ratplasma and application to pharmacokinetic studies[J]. Molecules, 2013, 18 (3) : 3050–3059. DOI:10.3390/molecules18033050 |
| [13] | 彭志兵, 吴正平. 高效液相色谱-质谱法分析金花葵花中金丝桃苷[J]. 安徽农业科学, 2008, 36 (23) : 10028–10029. |
| [14] | 谭光国.中药四逆汤化学物质组和代谢组学研究[D].上海:第二军医大学, 2012. |
| [15] | 张艺竹, 顾青青, 安叡, 等. 高效液相色谱-质谱联用快速测定参甘冠心合剂中毛蕊花糖苷、党参炔苷等11种有效成分[J]. 中国药学杂志, 2013, 48 (17) : 1288–1291. |
| [16] | 蒋海强, 容蓉, 吕青涛. 大黄化学成分的液相色谱-质谱联用鉴别[J]. 时珍国医国药, 2011, 22 (7) : 1705–1706. |
| [17] | 董静, 王弘, 万乐人, 等. 高效液相色谱/电喷雾-离子阱-飞行时间质谱分析鉴定中药虎杖中的主要化学成分[J]. 色谱, 2009, 27 (4) : 425–430. |
| [18] | Tsuruda S, Sakamoto T, Akaki K. Simultaneous determination of twelve sweeteners and nine preservatives in foods by solid-phase extraction and LC-MS/MS[J]. Shokuhin Eiseigaku Zasshi, 2013, 54 (3) : 204–212. DOI:10.3358/shokueishi.54.204 |
| [19] | Zhang J, Gao W, Liu Z, et al. Identification and Simultaneous Determination of Twelve Active Components in the Methanol Extract of Traditional Medicine Weichang'an Pill by HPLC-DAD-ESI-MS/MS[J]. Iranian Journal of Pharmaceutical Research, 2013, 12 (1) : 15–24. DOI:10.18579/jpcrkc/2013/12/1/79120 |
| [20] | 金慧, 王彦, 阎超. 葛根芩连汤入血成分的归属[J]. 中国中药杂志, 2008, 33 (22) : 2687–2691. |
2. Research and Development Center of Traditional Chinese Medicine, Tianjin International Joint Academy of Biotechnology and Medicine, Tianjin 300457, China
 2016, Vol. 33
2016, Vol. 33