文章信息
- 赵强, 王一洲
- ZHAO Qiang, WANG Yi-zhou
- 伸筋易骨矫形手法对兔膝关节软骨细胞代谢及Sox9表达的影响
- Effects of Shenjin Yigu orthopaedic manipulation on chondrocytes metabolismand the expression of Sox9 in rabbits
- 天津中医药, 2016, 33(2): 96-99
- Tianjin Journal of Traditional Chinese Medicine, 2016, 33(2): 96-99
- DOI: 10.11656/j.issn.1672-1519.2016.02.09
-
文章历史
- 收稿日期: 2015-10-08
膝骨关节炎(KOA)是一种常见的以关节软骨损害为特征的退行性骨关节病,虽然KOA发病机制的许多细节仍不明确,但大量研究显示KOA的病情发展与软骨细胞分解和合成代谢的失调相关。Sox9 基因是一种转录激活因子,可以介导并参与多条信号通路促进软骨细胞的增殖和分化[1],Sox9 基因的作用贯穿KOA的整个病程,是缓解软骨退变和促进软骨修复的关键基因。
临床研究显示伸筋易骨矫形手法可以调节KOA患者膝关节周围软组织功能、缓解临床症状,因此本实验以伸筋易骨矫形手法治疗KOA模型兔,对比临床常用的关节腔注射玻璃酸钠,研究该手法对Sox9 基因表达的调节作用,验证其促进软骨组织修复的作用机制,为临床提供安全有效的治疗手法提供依据。
1 材料与方法 1.1 试剂DMEM培养液(Gibco公司,美国) 、Ⅱ型胶原酶、胰蛋白酶(Gibco公司,美国)、四甲基偶氮唑盐(MTT,Sigma公司,美国) 、二甲基亚砜(DMSO,阿拉丁公司,中国)、Sox9抗体(Abcam公司,美国)、BCA蛋白浓度测定试剂盒(碧云天公司,中国)、组织和细胞总蛋白提取试剂盒(江莱公司,中国)、十二烷基硫酸钠聚丙烯酰凝胶电泳(SDS-PAGE)蛋白上样缓冲液(碧云天公司,中国)、辣根过氧化物标记二抗(Jackson公司,美国)。
1.2 仪器酶标分析仪( BioTek公司,美国) 、二氧化碳培养箱(Sanyo公司,日本)、超净台( 苏州净化设备公司)、倒置相差显微镜(Olympus公司,日本)、电泳系统(Bio-Rad公司,美国)、化学发光成像系统(Uvitec公司,英国)。
1.3 模型采用改良Hulth模型构建30只KOA兔模型[北京维通利华SCXK(京)05076685],健康6~8月龄,体质量3~3.5 kg,雌雄各半,将30只兔编号后按随机数字表法随机分成3组,治疗组采用伸筋易骨矫形手法治疗,对照组采用关节腔注射玻璃酸钠注射液治疗,模型组造模后同条件、同期饲养。
Hulth模型制作方法[2]:右侧后腿上方靠近尾部备皮,3%戊巴比妥钠(1 mL/kg)耳缘静脉注射麻醉,仰卧位固定下肢,从膝关节内侧切开2 cm显露膝关节,将髌骨推向外侧,牵开关节暴露前交叉韧带并切断,同时切断内侧副韧带和内侧半月板,缝合皮肤和皮下组织,冲洗关节腔,术后给予口服止痛药及抗生素,1周后开始驱赶每日0.5 h,连续30 d。
1.4 治疗方法治疗组[3]:1)将造模后的兔仰卧位固定,指揉股四头肌,髌骨周围,约5 min,按揉鹤顶、血海、梁丘、伏兔等穴,每穴1 min。2)弹拨髌韧带、髂胫束、股四头肌肌腱附着处,并提拿髌骨。3)膝关节摇法1 min,配合被动屈伸。4)擦法1 min,结束手法。以上手法治疗每日1次,7 d为1个疗程,共治疗3个疗程。对照组:1)仰卧位固定下肢,常规消毒。2)髌骨外侧缘下方凹陷处进针注入玻璃酸钠(每只5 mg,相当于成人用量)。3)纱布蒙盖注射区每周1次,共治疗3周。空白组:造模后同条件、同期饲养。
1.5 KOA软骨细胞的分离、培养静脉空气栓处死动物。截取胫骨面软骨组织,洗去血污杂质,磷酸盐缓冲溶液(PBS)冲洗2次后,剪切至1 mm3大小的碎块,移入超净台。加入2.5 g/L的胰蛋白酶5 mL,磁力棒摇荡消化40 min,吹打弃上清,加入5 mL的0.025%Ⅱ型胶原酶,恒温震荡箱放置4~6 h。收集分离细胞,1 000 r/min离心5 min,弃上清液,将液溶解的细胞放入DMEM液中使细胞悬液均匀分布,反复吹打,将软骨细胞接种在25 cm2的培养皿中,置于37 ℃、5%二氧化碳(CO2)培养箱中。逐日观察,2~3 d换1次液,原代细胞长满后传代,取2代细胞作实验用[4]。
1.6 MTT测骨关节炎软骨细胞增殖3组细胞接种在 96 孔板中,接种密度2×104个细胞/cm2,隔日换液。培养16 d后取出一块96孔板进行检测,每孔加入20 μL MTT溶液,继续孵育4 h,加入100 μL DMSO溶解结晶,置酶标仪570 nm波长测定吸光度值。
1.7 蛋白免疫印迹法检测将3组软骨组织按照总蛋白提取试剂盒说明书要求提取总蛋白,并用BCA蛋白浓度测定试剂盒和光吸收酶标仪测定蛋白浓度。100 ℃水浴3 min,加入蛋白上样缓冲液,充分混合并离心至管底,将蛋白样本进行SDS-PAGE 凝胶电泳,设定管家基因β-actin为内参。置入电泳槽,加转膜缓冲液,电泳槽置冰盆中,350 mA,60 min转膜,洗膜液(1 000 mL,PBS+1 mL,吐温-20)漂洗3次,每次10 min。聚偏二氟乙烯膜(PVDF)置一抗中孵育,摇床上4 ℃,过夜,辣根过氧化物酶标记二抗(1:5 000)室温孵育1 h,洗膜液漂洗3次,每次10 min。ECL发光试剂盒中A液和B液按照1:1混合摇匀,条带在化学发光成像系统中显影,通过灰度分析比较Sox9蛋白产物在3组软骨细胞中的表达情况[5, 6]。
1.8 观察指标1)3组软骨细胞的增殖情况。2)3组软骨细胞Sox9基因的表达水平。
1.9 统计学方法
采用SPSS18.0统计软件包对数据进行统计学分析,计量资料使用均数±标准差(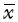 ±s)表示,组间比较采用单因素方差分析,组间两两比较采用LSD法,P<0.05为差异有统计学意义。
±s)表示,组间比较采用单因素方差分析,组间两两比较采用LSD法,P<0.05为差异有统计学意义。
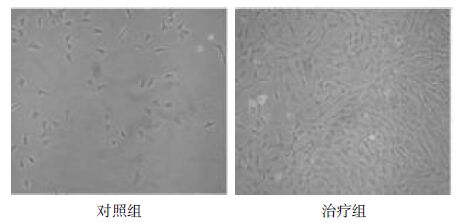
3组细胞48 h后完全贴壁,对照组原代细胞贴壁较治疗组晚,且对照组原代细胞繁殖速度较治疗组慢,治疗组原代细胞6 d后基本长满瓶壁,多为单层生长,见图1。
|
| 图1 原代关节软骨细胞培养6 d(×100) Fig.1 Primary articular cartilage cells 6 days after cultured (×100) |
MMT对比3组软骨细胞组的增殖变化,见表1。3组软骨细胞吸光值对比,结果表明治疗组与对照组软骨细胞增殖的水平均高于空白组软骨细胞(P<0.05),治疗组软骨细胞增殖的水平高于对照组软骨细胞(P<0.05)。提示伸筋易骨矫形手法能提高软骨的增值能力,更好的帮助损伤的软骨组织修复。
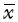 ±s)
Tab. 1 Comparison of the proliferation changes of chondrocytes detected by the MTT assay between two group(
±s)
Tab. 1 Comparison of the proliferation changes of chondrocytes detected by the MTT assay between two group(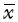 ±s)
±s)
| 组别 | OD570值 |
| 治疗组 | 0.237±0.013# |
| 对照组 | 0.192±0.014* |
| 空白组 | 0.072±0.012 |
| 注:与空白照相比,*P<0.05;与对照组相比,#P<0.05。 |
蛋白免疫印迹法实验结果显示,治疗组细胞均有Sox9蛋白表达。通过灰度分析后结果显示,治疗组软骨细胞Sox9蛋白表达水平明显高于对照组(P<0.05)。见图2。
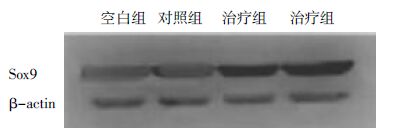
|
| 图2 3组软骨组织Sox9蛋白表达的免疫印迹检测对比 Fig.2 Expression of Sox9 protein compared of cartilages organize by Western blot among 3 groups |
关节畸形是KOA病程后期患者的主要症状,患者下肢力线偏移、关节活动能力下降、关节周围软组织退变,最终导致全膝关节功能丧失,关节畸形是KOA致残的主要病理因素[7, 8]。目前对纠正KOA关节畸形的主要手段是全膝关节置换术和膝关节矫形支架,这两种术式通过矫正下肢力线,调节膝关节周围软组织的相应关系达到正畸作用,但此类手术治疗费用昂贵、手术禁忌症和并发症较多[9, 10]。推拿作为一种以体表软组织为主要施术部位的保守治疗手段,可以增强股四头肌肌力[11],调节股四头肌和腘绳肌肌张力[12],缓解关节疼痛及水肿,从而矫正下肢力线达到正畸疗效[13]。
伸筋易骨矫形手法治疗膝关节骨性关节炎已在临床应用了近十年,临床研究显示,伸筋易骨矫形手法可以明显提升KOA患者膝关节周围软组织功能,改善软骨组织的生长环境,调节软骨细胞合成代谢,从根本上防治KOA。本实验研究该手法防治KOA的作用机制,结果可显示手法和针剂对促进软骨细胞修复均有一定作用,筋易骨矫形手法能够更好的上调Sox9的表达,促进细胞合成代谢,加快组织修复。
Sox是一组与胚胎软骨早期发育的相关基因家族,在软骨的发育成熟过程中发挥非常关键的调控作用[14, 15],与软骨形成分化关系较为密切的主要有3种Sox蛋白亚型,Sox9 是促进软骨分化的关键转录因子。细胞生长因子和理化刺激通过各种信号通路,激活 Sox9 的转录和翻译,进而激活下游Sox5、Sox6,Sox9 与 Sox5、Sox6等蛋白的表达,诱导成软骨分化特异性基因的转录和表达,从而形成软骨,因此 Sox9 被称为成软骨分化的“分子开关"[17]。其中Sox9是软骨间质细胞和软骨前体细胞募集过程中重要的调控因子[17],Sox9主要是在静止层和增殖层软骨细胞中表达,维持软骨细胞表型并协同抑制细胞的终末分化,通过与基因表达调控的增强子元件相结合而增强Ⅱ型胶原基因表达,促进软骨细胞外基质的合成[18]。手法治疗上调Sox9的表达,可能是修复软骨组织、治疗KOA的一个原因。
《医宗金鉴》对推拿手法的总结有“摸、接、端、提、推、拿、按、摩"8法,伸筋易骨矫形手法对膝痹的“气血郁滞,为肿为痛",施以“按其经络,以通郁闭之气,摩其壅聚,以散郁结之肿"。通过手法缓解膝周肌肉紧张度,松解髌周软组织粘连,改善胫骨上段、股骨下段及髌骨周围的血液循环,调整关节周围软组织张力,进而改善软骨细胞生长环境,修复受损软骨组织。 综上,本实验证实,伸筋易骨矫形手法可提高软骨细胞增殖速度,上调Sox9表达,调节软骨组织合成代谢,从而改善KOA症状。
| [1] | 赵强,王一洲. 膝骨性关节炎的模型建立及软骨细胞培养的研究进展[J]. 天津中医药大学学报,2013,32(1):58-60. |
| [2] | Hulth A, Lindberg L, Telhag H. Experimental osteoar-thritis in rabbits[J]. Acta Orthop Scand, 1970,41:522-530. |
| [3] | 赵强,王一洲.伸筋易骨法治疗膝关节骨性关节炎临床观察[J]. 天津中医药,2014,31(5):275-277. |
| [4] | 赵强,王一洲.兔膝关节骨性关节炎模型的建立及软骨细胞的分离、培养[J].天津中医药,2013,30(3):168-170. |
| [5] | 金荣忠,谈国明,胡辉东. COX-2在膝关节骨性关节炎软骨中表达及临床意义[J]. 生物骨科材料与临床研究,2010,7(6):18-20. |
| [6] | 高晟,周静,姚民强.中西医结合治疗对冠心病心绞痛气虚血瘀证患者心功能及内皮功能的影响[J].天津中医药,2012,29(4):332-335. |
| [7] | 黄茂,刘杰,于林,等.电针推拿配合中药外敷对篮球运动员膝关节损伤等速肌力测试的观察[J]. 中华中医药杂志,2009, 24(10):1291-1292. |
| [8] | 李毅,姚建锋,武亮,等.膝骨性关节炎关节周围肌肉功能改善的治疗评价[J]. 中国组织工程研究,2013,17(46):8128-8132. |
| [9] | 柴瑞宝,张辉,刘洋,等. TKA术后胫骨近端截骨块参数测量及其临床意义[J]. 中国矫形外科杂志, 2013,21(5):495-498. |
| [10] | 林昊,张余,李国安. 人工全膝关节研究新进展[J]. 医用生物力学,2012,27(2):115-121. |
| [11] | 樊远志,房敏,严隽陶,等. 推拿手法对膝骨关节炎患者股四头肌肌力影响的临床研究[J]. 中医学报,2010,25(5):1107-1110. |
| [12] | 李建华,龚利,房敏,等.推拿对膝骨关节炎患者膝屈伸肌肌张力的影响[J].中国骨伤,2011,24(7):575-577. |
| [13] | 张永泉,赵强.伸筋易骨矫形手法治疗KOA轻度内翻畸形的临床研究[J].天津中医药,2015,32(10):598-602. |
| [14] | Akiyama H.Control of chondrogenesis by the transcription factor Sox9[J]. Mod Rheumatol,2008,18(3):213-215. |
| [15] | 陈金武,吴军正,李焰,等. Sox9基因过表达诱导人骨髓基质干细胞向软骨细胞分化[J]. 临床口腔医学杂志, 2004,19(12):712-714. |
| [16] | Quintana L, zur Nieden NI, Semino CE. Morphogenetic and regulatory mechanisms during developmental chondrogenesis:new paradigms for cartilage tissue engineering[J]. Tissue Engineering Part B:Reviews, 2008, 15(1):29-41. |
| [17] | 刘军,王洪伟,陈语,等. Sox6和Sox9基因转染对人原发性骨关节炎关节软骨间充质祖细胞增殖和成软骨分化的调控作用[J]. 局解手术学杂志, 2014,23(5):477-481. |
| [18] | 贺明,陈洪亮,王大鹏,等. Sox-9和转化生长因子-β1共同诱导大鼠脂肪干细胞向软骨细胞分化[J]. 解剖科学进展, 2009,15(2):221-226. |
 2016, Vol. 33
2016, Vol. 33