文章信息
- 蔡智慧, 尹丽, 常全忠
- CAI Zhi-hui, YIN Li, CHANG Quan-zhong
- 栀子苷预处理对H9C2心肌细胞缺氧/复氧损伤的影响及机制研究
- Effects and mechanismof geniposide pretreatment on H9C2 cardiomyocytes during hypoxia/reoxygenation injury
- 天津中医药, 2016, 33(2): 111-113
- Tianjin Journal of Traditional Chinese Medicine, 2016, 33(2): 111-113
- DOI: 10.11656/j.issn.1672-1519.2016.02.13
-
文章历史
- 收稿日期: 2015-10-21
栀子苷(GE)是从茜草科植物栀子的干燥成熟果实中提取出来的一种环烯醚萜苷类化合物[1],具有多种药理作用。近年来,众多动物及临床实验证实栀子苷具有抗氧化、抗炎、抗肿瘤、清热消毒等药效,是治疗心脑血管、肝胆以及神经疾病等的原料药物[2]。但是,关于栀子苷对缺氧/复氧心肌细胞的作用目前研究的不多,因此本实验通过体外培养H9C2心肌细胞,建立缺氧/复氧损伤模型,观察栀子苷预处理对心肌细胞肌酸激酶(CK)、乳酸脱氢酶(LDH)、丙二醛(MDA)含量和超氧化物歧化酶(SOD)活力的影响,以及对心肌细胞存活率和凋亡的影响,为中药在临床上的进一步应用提供实验依据。
1 材料和方法 1.1 细胞株H9C2心肌细胞株购于北京中医科学院细胞中心。
1.2 主要仪器和试剂二氧化碳(CO2)培养箱(Thermo公司),倒置荧光显微镜(Olympus公司),分光光度计(上海精密科学仪器有限公司),Multiskan FC酶标仪(Thermo公司),流式细胞仪(美国BD公司),栀子苷(中国药品生物制品检定所),胎牛血清(杭州四季青公司),DMEM培养基(Solarbio公司),LDH、CK、SOD和MDA试剂盒(南京建成生物工程研究所),四甲基偶氮唑蓝(MTT,Sigma公司),Annexin V-FITC细胞凋亡检测试剂盒(Sigma公司),其余试剂均为分析纯。
1.3 缺氧/复氧模型制备参考文献方法并进行改进。取对数生长期的心肌细胞接种至24孔培养板内,待细胞长至80%融合状态时,弃去原培养液,加入不含FBS的无糖培养基。将培养板放入通有95%氮气(N2)和5% CO2混合气体的缺氧盒内,37 ℃培养4 h,然后换成正常培养基在常氧条件下继续培养12 h。
1.4 实验分组将生长状态良好的心肌细胞随机分为3组:1)正常对照组:加入含10%胎牛血清的DMEM培养基,正常培养。2)缺氧/复氧模型组:缺氧4 h,复氧12 h,具体造模方法同上。3)栀子苷预处理组:造模前2 h加入用正常培养液配制的栀子苷,其余处理同缺氧/复氧模型组。
1.5 细胞培养液中LDH、CK、SOD、MDA的测定缺氧/复氧模型建立成功后,按照试剂盒提供的方法取心肌细胞培养上清液,利用分光光度法测定上清液中LDH、CK、SOD、MDA的含量。
1.6 MTT法检测心肌细胞存活率造模结束后弃上清,每孔加入MTT10 μL,DMEM培养基90 μL,共孵育4 h后弃去培养液,加150 μL二甲基亚砜(DMSO),充分震荡,用酶标仪检测490 nm处的吸光度。以不含细胞,只含培养基和MTT的孔为本底对照组,每组设5个复孔,实验重复3次。细胞存活率=(OD实验组-OD本底对照组)/(OD正常对照组-OD本底对照组)×100%
1.7 采用流式细胞方法检测细胞凋亡率造模结束后将心肌细胞用不含乙二胺四乙酸(EDTA)的胰酶进行消化,再用预冷的磷酸盐缓冲溶液(PBS)冲洗,4 ℃ 1 000 r/min离心10 min,弃上清,加入200 μL Binding Buffer重悬细胞,加入AnnexinV-FITC 10 μL和PI 5 μL混匀,避光室温反应15 min,1 h内上机检测。
1.8 统计学分析
使用SPSS18.0统计软件,所有实验数据用均数±标准差(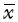 ±s)表示,组间比较用单因素方差分析(One-way ANOVA),两两比较用LSD-t检验,P<0.05为差异有统计学意义。
±s)表示,组间比较用单因素方差分析(One-way ANOVA),两两比较用LSD-t检验,P<0.05为差异有统计学意义。
如表1所示,模型组心肌细胞生成LDH、CK、MDA较正常对照组明显升高(P<0.01),SOD活性则较正常对照组明显降低(P<0.01)。与模型组相比,栀子苷可使LDH、CK、MDA减少(P<0.01),SOD活性升高(P<0.05)。结果说明栀子苷可以提高心肌细胞的抗氧化以及清除氧自由基的能力,减轻脂质过氧化反应,稳定心肌细胞膜,减少心肌酶的漏出。
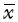 ±s)
Tab. 1 Effects of geniposide to the contents of LDH, CK, SOD and MDA(
±s)
Tab. 1 Effects of geniposide to the contents of LDH, CK, SOD and MDA(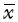 ±s)
±s)
| 分组 | n | LDH | CK | SOD | MDA |
| (U/L) | (U/L) | (KN U/L) | (μmol/L) | ||
| 正常对照组 | 8 | 24.26±5.37 | 15.23±4.52 | 46.55±7.84 | 1.57±0.52 |
| 模型组 | 8 | 42.96±6.82** | 29.35±6.54** | 29.23±5.48** | 5.69±0.86** |
| 栀子苷预处理组 | 8 | 32.53±6.19## | 23.21±4.97## | 35.63±5.78# | 2.97±0.65## |
| 注:与正常对照组比较,** P<0.01;与模型组比较,# P<0.05,##P<0.01。 | |||||
如表2所示,模型组心肌细胞存活率明显低于正常对照组(P<0.01),与模型组相比,栀子苷预处理组心肌细胞存活率则明显提高(P<0.01)。结果说明,栀子苷可以提高缺氧/复氧心肌细胞的存活率,起到保护作用。
 ±s)
Tab. 2 Effects of geniposide to cell viability of
myocardial cells(
±s)
Tab. 2 Effects of geniposide to cell viability of
myocardial cells( ±s)
±s)
| 分组 | n | OD490 nm | 存活率(%) |
| 正常对照组 | 8 | 0.356±0.136 | 100.0±0 |
| 模型组 | 8 | 0.178±0.045** | 48.5±3.3** |
| 栀子苷预处理组 | 8 | 0.289±0.047## | 80.2±5.9## |
| 注:与正常对照组比较,**P<0.01;与模型组比较,##P<0.01。 | |||
流式细胞仪检测结果显示,正常对照组、模型组、栀子苷预处理组的细胞凋亡率分别为1.2%,55.8%,15.3%。与正常对照组比较,模型组凋亡率显著增加。与模型组相比,栀子苷预处理组的心肌细胞凋亡率明显降低(P<0.01)。说明栀子苷能显著抑制缺氧/复氧心肌细胞的凋亡。结果见图1。
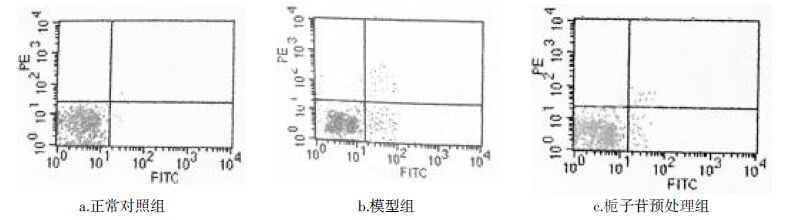
|
| 图1 栀子苷对心肌细胞凋亡的影响 Fig.1 Effects of geniposide to the apoptosis of myocardial cells |
近年来,溶栓、PTCA等技术愈发成熟,然而缺血再灌注损伤的问题一直没有得到有效解决,成为缺血性心脏病治疗过程中的难题[4]。心肌缺血再灌注损伤的机制十分复杂,目前公认的主要有氧化应激、炎症反应、钙超载、细胞凋亡等[5]。
正常情况下,机体内存在着少量的自由基,可以被SOD及时清除,当缺血再灌注损伤发生时,SOD活性受到抑制,导致自由基大量产生,与细胞膜及生物大分子发生过氧化反应[6, 7]。MDA是心肌细胞膜脂质过氧化的产物,大量的MDA破坏了细胞膜的完整性,使细胞内的心肌酶LDH、CK发生外漏。因此检测SOD活性及LDH、CK和MDA的含量可以间接反映细胞膜受损伤的程度[8]。
栀子苷是从传统中药栀子中提取出来的一种环烯醚萜苷类化合物,具有抗氧化、抗炎、抗肿瘤、清热消毒、保肝利胆等多种药理作用[9]。近年来,众多动物及临床实验证实栀子苷具有心血管保护作用[10, 11],但具体机制尚不清楚。本实验中,用缺氧/复氧细胞模型模拟体外心肌缺血/再灌注,结果显示,与模型组相比,栀子苷预处理组SOD活性升高,LDH、CK以及MDA的含量减少。同时,MTT的结果显示,栀子苷组心肌细胞的存活率明显高于模型组,说明栀子苷可以提高机体清除氧自由基以及抗氧化能力,保护缺氧/复氧心肌细胞。
此外,心肌细胞在发生缺血再灌注的过程中,细胞内钙超载、氧自由基的大量增多以及中性粒细胞的浸润等都会诱发心肌细胞凋亡[12]。近年来,众多研究者证实心肌细胞的凋亡是心肌缺血再灌注损伤产生过程中的一个重要事件,有效干预心肌细胞的凋亡对于防治心肌缺血再灌注损伤有着重要的意义[13]。本实验结果显示,模型组的心肌细胞凋亡明显高于对照组,这和其他研究者的结果相一致,而进行栀子苷预处理则可以明显降低心肌细胞的凋亡。
综上所述,栀子苷对缺氧/复氧心肌细胞具有保护作用,其机制可能与栀子苷能增强心肌细胞抗氧化能力,清除氧自由基以及减少心肌细胞的凋亡有关。
| [1] | Wang J, Hou J, Lei H, et al. Synergistic neuroprotective effect of microglial conditioned media treated with geniposide and ginsenoside Rg1 on hypoxia injured neurons[J]. Mol Med Rep, 2015, 12(4):5328-5334. |
| [2] | Chen JY, Wu H, Li H, et al. Anti-inflammatory effects and pharmacokinetics study of geniposide on rats with adjuvant arthritis[J]. Int Immunopharmacol, 2015, 4(1):102-109. |
| [3] | 关欣,李应东. 细胞缺氧复氧模型建立方法的研究进展[J]. 医学综述,2008,14(18):2737-2739. |
| [4] | 蔡智慧, 郑亚萍. 冠心苏合丸对乳鼠心肌细胞缺血再灌注损伤的作用[J]. 广州中医药大学学报,2013,30(5):722-724. |
| [5] | Meng G, Wang J, Xiao Y, et al. GYY4137 protects against myocardial ischemia and reperfusion injury by attenuating oxidative stress and apoptosis in rats[J]. J Biomed Res, 2015, 29(3):203-213. |
| [6] | Kalra J, rasad K. Oxygen free radicals and cardiac depression[J]. Clin Biochem, 1994, 27(3):163-168. |
| [7] | 刘红旭,李爱勇,解欣然,等. 参元丹后处理对心肌缺血/再灌注大鼠血清MDA、SOD水平的影响[J].微循环学杂志,2011,21(1):1-5. |
| [8] | 许大庆,雷婕,彭晓东,等. 大豆苷元对乳鼠心肌细胞缺氧/复氧损伤的保护作用[J].宁夏医学院学报,29(4):344-346. |
| [9] | 游伟良,平其能,孙敏捷. 栀子苷的药理学研究新进展[J]. 药学进展,2012,36(4):158-162. |
| [10] | 王志超,杨小龙,张珂,等. 栀子苷药理作用的研究进展[J]. 河南科技大学学报(医学版),2012,30(2):159-160. |
| [11] | Liu W, Li G, Holscher C, et al. Neuroprotective effects of geniposide on Alzheimer's disease patpathology[J]. RevNeurosci, 2015, 26(4):371-383. |
| [12] | Zhu L, Wei T, Gao J, et al. The cardioprotective effect of salidroside against myocardial ischemia reperfusion injury in rats by inhibiting apoptosis and inflammation[J]. Apoptosis, 2015, 20(11):1433-1443. |
| [13] | 卢新华,韩瑛,王桂霞. 马齿笕总黄酮对缺氧/复氧致心肌细胞损伤的影响及机制研究[J]. 中国实验方剂学杂志,2013,19(22):226-230. |
 2016, Vol. 33
2016, Vol. 33