文章信息
- 李小江, 贾英杰, 张文治, 张莹, 许文婷
- LI Xiao-jiang, JIA Ying-jie, ZHANG Wen-zhi, ZHANG Ying, XU Wen-ting
- 姜黄素对A549细胞亚群SP和NON-SP的NF-κB、VEGF及Notch通路的影响
- Curcumin extract influence on tumor angiogenesis of A549 cell subsets SP and NON-SP cells
- 天津中医药, 2016, 33(3): 164-168
- Tianjin Journal of Traditional Chinese Medicine, 2016, 33(3): 164-168
- DOI: 10.11656/j.issn.1672-1519.2016.03.10
-
文章历史
- 收稿日期: 2015-09-25
2. 天津神经外科研究所, 天津 300060;
3. 天津中医药大学研究生院, 天津 300193
姜黄色素(Curcumin)是从姜科姜黄属植物姜黄根茎中提取的一种酚性色素,是姜黄发挥作用的主要活性成分。研究表明,姜黄素具有抗炎、抗氧化、调节血脂、抗肿瘤、调节机体免疫功能、保护肝肾等多种药理作用。血管生成是实体肿瘤生长、侵袭、扩散和转移的关键,是肿瘤治疗的靶点之一[1]。近年来研究表明姜黄素具有抗肿瘤血管生成的作用,但具体机制仍不明确[2]。本实验旨在研究姜黄素抗肿瘤血管生成作用及机制。
1 材料 1.1 材料BALB/C裸小鼠、人肺腺癌A549瘤株,上海坤肯生物化工有限公司;SP(side population)亚群细胞,天津灏洋生物公司提供;NON-SP(NON-side population)亚群细胞,由天津灏洋生物公司提供;姜黄素,天津化标生物技术有限公司。
1.2 仪器及试剂Notch1逆转录-聚合酶链反应(RT-PCR)试剂盒、生物显微镜,LYMPUS-BX40 日本;电子分析天平,梅特勒-托得多仪器设备有限公司;低温高速离心机,BECKMAN allegraTM64 Centrifuge;MDF-192型超低温冰箱,日本三洋电机株式会社;PCR仪,Alpha unit Block Assembly for PTC DNA Engine Systems;超净工作台,苏州净化设备有限公司。
2 方法 2.1 实验方法取BALB/C裸小鼠40只,按照随机数字表分为4组,每组10只。分为SP亚群细胞和NON-SP亚群细胞两组,每组分别设为姜黄素组及荷瘤空白对照组。具体分组情况如下:A组(SP亚群细胞姜黄素组)、B组(SP亚群细胞荷瘤对照组)、C组(NON-SP亚群细胞姜黄素组)、D组(NON-SP亚群细胞荷瘤对照组)4组。
2.2 动物模型建立取分离后的A549 SP亚群细胞及NON-SP亚群细胞调整细胞数为1×109/L癌细胞悬液,取0.2 mL原液常规方法将SP亚群细胞接种于A、B组小鼠左、右大腿内侧皮下,将NON-SP亚群细胞接种于C、D组小鼠左、右大腿内侧皮下。
2.3 给药及标本制备各组均于接种瘤株16 d后采用腹腔注射给药,隔日1次,共8次。实验组予姜黄素腹腔注射100 mg/kg,0.2 mL;对照组予生理盐水腹腔注射25 mL/kg,隔日1次,共8次。实验动物均于接种瘤株16 d后称质量,处死小鼠,立即将瘤块组织剥离,称重测量大小后用甲醛固定并进行常规石蜡包埋,切片5 μm,免疫组织化学染色。免疫组织化学用SP法,按试剂说明书操作,二氨基联苯胺(DAB)显色,磷酸盐缓冲液(PBS)代替一抗作阴性对照,已知阳性切片作阳性对照。免疫组化染色阳性为棕色或黄褐色。
2.4 免疫组化法检测血管生长因子(VEGF)、核因子-κB(NF-κB)的表达二甲苯脱蜡、梯度乙醇脱水,3%双氧水灭活内源性过氧化酶,PBS 振洗,采用专用微波炉进行抗原微波热修复,正常山羊血清封闭、一抗冰箱过夜,二抗、三抗各37 ℃孵育45 min,DAB 显色2 min,复染核脱水透明,中性树胶封片。
2.5 RT-PCR检测Notch1表达组织总RNA的变性,抽提,沉淀,洗涤,溶解,NOTCH1引物长度:182 bp上游引物:5' TCC GCG GCT CCA TCG TCT ACC 3' 下游引物:5' CTG CAC GGC CTC GAT CTT GTA 3';β-actin扩增长度169 bp上游引物5' GCA CCC AGC ACA ATG AAG ATC 3'下游引物5' CTA GAA GCA TTT GCG GTG GAC 3';RT反应后,目的基因退火,1% Agrose凝胶电泳检测PCR反应产物。
2.6 统计学处理方法采用SPSS 18.5统计软件处理数据,计量资料采用均数±标准差( ±s)表示,组间比较采用单因素方差分析(one-way ANONA),组间两两比较若方差齐采用LSD法,若方差不齐采用Dunnet's T3法,P<0.05为差异有统计学意义。
±s)表示,组间比较采用单因素方差分析(one-way ANONA),组间两两比较若方差齐采用LSD法,若方差不齐采用Dunnet's T3法,P<0.05为差异有统计学意义。
实验后4组小鼠体质量均出现不同程度的下降,与实验前比较,差异具有统计学意义。A组、B组两组小鼠瘤体质量较大,且与C、D两组比较,差异具有统计学意义,其中B组瘤质量大于A组,D组瘤质量大于C组,说明SP细胞肿瘤组织较NON-SP生长速度快,并且姜黄素对肿瘤组织的生长具有一定的抑制作用,A、B两组及C、D两组组间比较差异均具有统计学意义。结果见表1。
 ±s)
Table 1 Comparison of tumor weight of each group of mice (
±s)
Table 1 Comparison of tumor weight of each group of mice ( ±s)
±s)
| 组别 | 动物数 | 瘤质量(g) |
| A组 | 10 | 1.009±0.376* |
| B组 | 10 | 1.289±0.238** |
| C组 | 10 | 0.746±0.301* |
| D组 | 10 | 0.837±0.289* |
| 注:B 组与其他3组比较,*P<0.05;B 组与C 组、D组比较,**P<0.01;A组与B 组、C 组与D组比较,*P<0.05。 | ||
在积分光度中,A、C两组明显低于C、D两组,其中A组最低,与其他各组比较,差异具有统计学意义,A组与C组比较,差异具有统计学意义,B、D两组比较,差异不具有统计学意义。总面积结果与积分光度大体一致。说明姜黄素可以明显抑制VEGF的表达,并且姜黄素对SP亚群细胞荷瘤组的VEGF的表达最低。结果见表2、图1。
 ±s)
Table 2 VEGF image analysis results in tumor tissue of each group(
±s)
Table 2 VEGF image analysis results in tumor tissue of each group( ±s)
±s)
| 组别 | 动物数 | 积分光度 | 总面积(μm2) |
| A组 | 10 | 198.21±5.89 | 143.23±2.84 |
| B组 | 10 | 365.54±7.26△△ | 175.65±3.89△△ |
| C组 | 10 | 223.76±4.53△# | 163.86±1.08△# |
| D组 | 10 | 342.22±3.42△△* | 188.64±3.86△△* |
| 注:在积分光度中,A 组与B、D 两组比较,△△P<0.01;A 组与C组比较,△P<0.05;B、D 两组比较,*P>0.05;C 组与B、D两组比较,#P<0.01。在总面积中,A 组与B、D 两组比较,△△P<0.01;A 组与C 组比较,△P<0.05;B、D两组比较,*P>0.05;C组与B、D两组比较,#P<0.01。 | |||
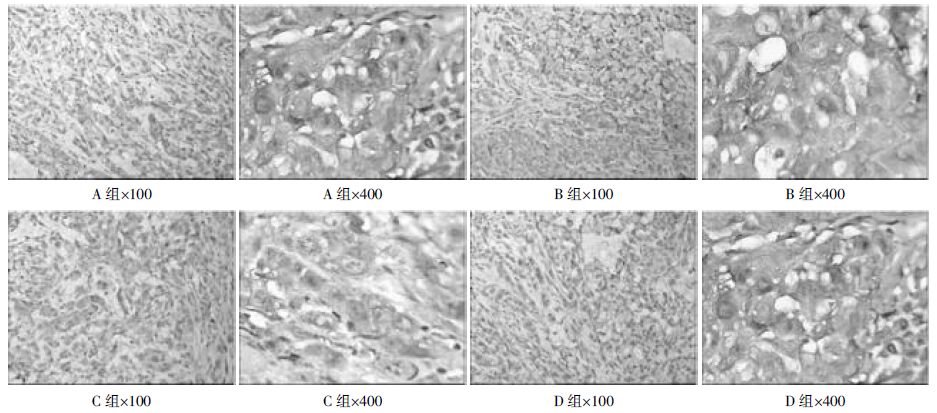
|
| 图1 各组肿瘤组织VEGF 染色结果 Fig.1 VEGF dye results in tumor tissue of each group |
NF-κB在A组中表达最低,其次为C组,两组比较,差异不具有统计学意义,A组与B、D两组比较,差异具有统计学意义。B、D两组NF-κB在小鼠肿瘤组织中表达较高,但两组比较差异不具有统计学意义。说明NF-κB在肿瘤组织中表达,但是姜黄素组(A组和C组)可显著抑制NF-κB的表达,姜黄素对SP亚群细胞荷瘤组的抑制作用最明显,与NON-SP亚群细胞荷瘤组比较差异具有统计学意义。结果见表3、图2。
 ±s)
Table 3 NF-κB image analysis results in tumor tissue of each group(
±s)
Table 3 NF-κB image analysis results in tumor tissue of each group( ±s)
±s)
| 组别 | 动物数 | NF-κB的表达 |
| A组 | 10 | 94.1±4.21 |
| B组 | 10 | 145.2±3.87** |
| C组 | 10 | 113.6±4.32* |
| D组 | 10 | 136.4±5.17** |
| 注:A组与B、D两组比较,**P<0.01;A组与C组比较,*P<0.05;B、D两组比较,△P>0.05。 | ||
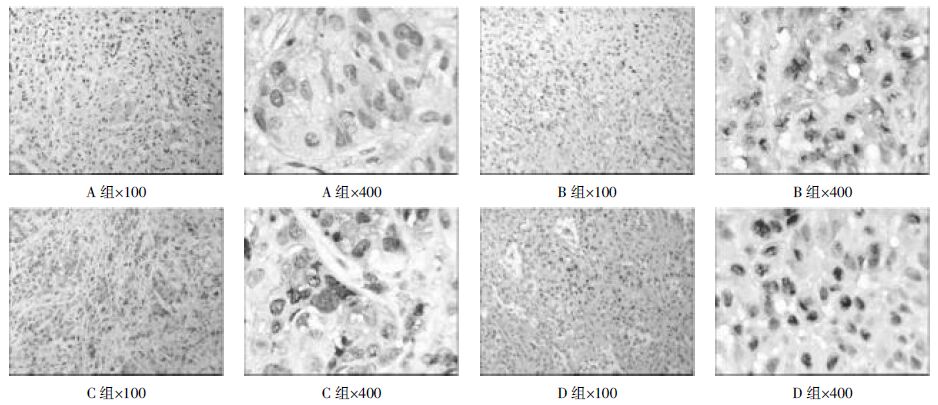
|
| 图2 各组肿瘤组织NF-资B 染色结果 Fig.2 NF-资B dye results in tumor tissue of each group |
经PCR分析后显示,结果处理如下:ΔCt=Ct(Survivin)-Ct(β-actin);ΔΔCt=空白对照组ΔCt-各观察组ΔCt;Ratio值=2ΔΔCt。结果显示,A组Notch-1 mRNA的表达低于其他各组,且与C组比较,差异具有统计学意义,B、D两组高于A、C两组,差异具有显著性。同样证明,姜黄素可抑制Notch-1 mRNA的表达,并且姜黄素对SP细胞荷瘤裸小鼠肿瘤组织Notch-1 mRNA的抑制作用优于NON-SP细胞荷瘤裸小鼠。结果见表4。
 ±s)
Table 4 Notch-1 mRNA expression in tumor tissue of each group(
±s)
Table 4 Notch-1 mRNA expression in tumor tissue of each group( ±s)
±s)
| 组别 | 动物数 | Ratio 值 |
| A组 | 10 | 17.46±2.86** |
| B组 | 10 | 39.43±3.21 |
| C组 | 10 | 20.12±4.66* |
| D组 | 10 | 43.22±3.60* |
| 注:A组与B、D两组比较,**P<0.01;A组与C 组比较,*P<0.05;B、D两组比较,*P<0.05。 | ||
肿瘤血管生成及侵袭是肿瘤生长和转移的必要条件。VEGF是一种高效、特异性地作用于血管内皮细胞的生长因子,对血管内皮细胞具有强烈的促分化作用。它是一种高度特异性的有丝分裂原,能直接刺激新生血管的形成;被公认为是最重要和最强的促血管生成因子[3]。VEGF 是诱导和促进血管生成最强有力的关键因子,也是抗血管生成的重要靶点;肿瘤组织往往过量表达VEGF 因子,该因子可以与血管内皮细胞表面VEGF 受体特异性结合,活化其包内酪氨酸激酶,并最终促进血管内皮细胞增殖和游走,构成血管样结构[4] 。
Notch 信号通路是保守的受体配体信号通路,在细胞的增殖、凋亡和分化中起重要作用,影响多个器官的发育和功能。在不同组织起源的肿瘤中,或同种肿瘤的不同阶段,Notch 信号通路发挥抑制或促进肿瘤的作用。对于绝大多数人类肿瘤来说,Notch 信号通路起促癌作用。Notch 信号通路的活性与肿瘤患者生存率密切相关,并且可以作为判断肿瘤患者预后的一个指标。近年来,对肺癌发病机制的研究发现[5, 6, 7],不同类型肺癌有不同Notch 组分表达。在非小细胞肺癌细胞中,Notch1、Notch3、HES-1 表达很常见。有学者证实[8],Notch1 在成人肺腺癌、鳞癌中高表达,在小细胞肺癌中低表达。Sriuranpong 等[9]证实Notch1、Notch2 的过量表达使SCLC 细胞周期阻滞在G1期,抑制细胞生长。由此推断Notch 信号通路与肺癌的发病有密切关系,在不同类型肺癌中表现促癌或抑癌作用。姜昕等[10]检测到在NSCLC中Notch1、HIF-1、VEGF 及Notch1 mRNA表达均上调,提示其在肺癌的发生、发展中可能起重要作用,并认为检测Notch1 蛋白及mRNA 可作为肿瘤侵袭及转移的转移指标。此外,Notch 信号通路可以影响其他细胞信号通路的活性,如NF-κB、Akt、mTOR、Ras、Wnt、EGFR、PDGF 等[11, 12, 13, 14, 15],在肿瘤的进展中发挥重要作用,是一个非常复杂的信号通路[16, 17]。Donnem 等[18]认为在NSCLC中Notch1与VEGFA共表达提示预后差。实验发现,肺腺癌A549 SP细胞亚群荷瘤模型组小鼠瘤体与NON-SP细胞亚群荷瘤模型组小鼠相比体积较大;姜黄素可以抑制肿瘤生长[19],并可以降低VEGF的表达,抑制NF-kB的表达,通过RT-PCR检测出其可下调Notch1 mRNA含量,对肿瘤血管的生成有一定的抑制作用。同时研究发现,SP亚群细胞姜黄素组抑瘤作用及抗肿瘤血管生成优于NON-SP亚群细胞姜黄素组,说明姜黄素能够通过某种途径阻断Notch信号转导通路,下调该通路的关键表达因子Notch-1和调节因子NF-κB的表达,抑制了肿瘤细胞的生成长。
| [1] | NSCLC Meta-Analyses Collaborative Group.Chemotherapy in addition to supportive care improves survival in advanced non-smallcell lung cancer: a systematic review and meta-analysis of individual patient data from 16 randomized controlled trials[J].J Clin Oncol,2008,26(28) : 4617-4625. |
| [2] | Pfister DG,Johnson DH,Azzoli CG,et al.American Society of Clinical Oncology Treatment Of Unresectable Non-small-cell Lung Cancer Guideline: Update 2003[J].J Clin Oncol,2004,22(2): 330-353. |
| [3] | 吴军召,郭晓霞,王承正,等.姜黄素对人乳腺癌MCF-7 细胞增殖及血管生成相关基因表达的影响[J].医药论坛杂志,2011, 32(2):95-97. |
| [4] | 丰俊东,徐晓玉,胡益勇,等.川芎嗪对VEGF受体与其放射性配体结合的抑制[J].中国药理学通报,2005,21(8):939-942. |
| [5] | Dang TP, Gazdar AF, Virmani AK, et al. Chromosome 19 translocation, overexpression of Notch3, and human lung cancer[J]. J Natl Cancer Inst, 2000, 92(16): 1355-1357. |
| [6] | Collins BJ, Kleeberger W, Ball DW. Notch in lung development and lung cancer[J]. Semin Cancer Biol, 2004,14(5): 357-364. |
| [7] | 张 莹,贾英杰,杨 洁,等. 消岩汤药物血清对A549/DDP多药耐药逆转作用的研究[J]. 天津中医药,2010,27(4):334-336. |
| [8] | 周 敏,马佳韵,郭雪君. Notch1 受体蛋白在成人肺癌中的表达[J]. 临床医学研究,2010,27(3):398-401. |
| [9] | Sriuranpong V, Borges MW, Ravi RK, et al. Notch signaling induces cell cycle arrest in small cell lung cancer cells[J]. Cancer Res, 2001, 61(7): 3200-3205. |
| [10] | 范志文,周 敏. Notch信号通路与肺癌关系的研究进展[J]. 内科理论与实践[J]. Theory and Practice of Medicine, 2011,6(3):249-252. |
| [11] | Kang JH,Lee EH,Park SW,et al. MUC5AC expression through bidirectional communication of Notch and epidermal growth factor receptor pathways[J]. J Immunol,2011,187(1):22-229. |
| [12] | 刘兆国,朱智杰,周 梁,等. Notch信号通路与肿瘤研究[J]. 中国药理学通报,2012,28(8):1045-1048. |
| [13] | 裘铠杰,胡彦华,吴德全. Notch信号通路与肿瘤侵袭、转移的研究进展[J]. 胃肠病学和肝病学杂志,2014,23(11):1362-1364. |
| [14] | 王利祥,华子春. Notch信号通路研究进展[J]. 中国医药生物技术,2009,3(3):224-226. |
| [15] | 叶元滋. Notch3蛋白在非小细胞肺癌中的表达及其临床意义[D].合肥:安徽医科大学,2014. |
| [16] | 张 奇,宋 鑫. Notch信号通路在肿瘤干细胞中的研究进展[J]. 中国肿瘤,2014,29(7):585-590. |
| [17] | 李钰泉,周天骏,潘越江,等. Notch信号通路在肿瘤中的研究进展[J]. 岭南现代临床外科,2013,13(5):455-458. |
| [18] | Donnem T, Andersen S, Al-Shibli K, et al. Prognostic impact of Notch ligands and receptors in nonsmall cell lung cancer: coexpression of Notch-1 and vascular endothelial growth factor-A predicts poor survival[J]. Cancer, 2010, 116(24): 5676-5685. |
| [19] | 贾英杰,史福敏,贾彦焘,等.消岩汤剂治疗晚期非小细胞肺癌临床研究[J].天津中医药,2004,21(2):108-110. |
2. Tianjin Neurosurgery Institute, Tianjin 300060, China;
3. Graduate School, Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
 2016, Vol. 33
2016, Vol. 33