文章信息
- 张波泳, 柴欣, 王跃飞, 江振作
- ZHANG Bo-yong, CHAI Xin, WANG Yue-fei, JIANG Zhen-zuo
- 一种制备补骨脂酚的简单、高效的方法
- A simple and efficient method for preparation of bakuchiol
- 天津中医药, 2016, 33(4): 245-247
- Tianjin Journal of Traditional Chinese Medicine, 2016, 33(4): 245-247
- http://dx.doi.org/10.11656/j.issn.1672-1519.2016.04.15
-
文章历史
- 收稿日期: 2016-03-26
2. 天津国际生物医药联合研究院中药新药研发中心, 天津 300457
补骨脂为豆科植物补骨脂Psoralea corylifolia L.的干燥成熟果实,具有治疗肾阳不足、阳痿遗精、遗尿尿频、腰膝冷痛、肾虚作喘、五更泄泻,外用治白癜风、斑秃的功效[1]。补骨脂酚是补骨脂中主要的有效成分[2],具有抗癌[3]、降糖降血脂[4, 5]、抗炎[6, 7, 8]、抗衰老[9]、抗菌[10, 11, 12, 13, 14, 15]、抗抑郁[16]、抗氧化和肝脏保护[17, 18]等多种药理活性。
如何快速制备大量的补骨脂酚是工业生产中密切关注的问题,本研究建立了一种补骨脂酚的制备方法:补骨脂药材粉碎,经石油醚冷浸提取,回收溶剂,得到补骨脂酚粗提物;经硅胶柱色谱分离,石油醚洗脱得到补骨脂酚粗品;再进一步经石油醚-乙酸乙酯(12∶1)洗脱得到补骨脂酚纯品。该方法具有高效率、低成本、所用溶剂毒性低等优点。
1 材料与方法 1.1 材料与仪器补骨脂药材购自河南,经天津中医药大学李天祥副教授鉴定为豆科植物补骨脂(Psoralea corylifolia L.)的干燥成熟果实,样品储存于天津国际生物医药联合研究院中药新药研发中心;薄层层析硅胶GF-254、柱层析硅胶(青岛海洋化工厂);石油醚(沸程60~90 ℃);乙酸乙酯(天津市风船化学试剂科技有限公司);甲醇(美国Sigma-Aldrich公司)。
ACQUITY超高效液相色谱仪(美国Waters公司,包括Waters ACQUITY二元泵、DAD检测器、自动进样器、在线脱气机、柱温箱、Empower色谱工作站);MILLI-Q超纯水仪(美国Millipore公司);Bruker AV Ⅲ 400 MHz核磁共振波谱仪(瑞士Bruker公司);SHZ-D(Ⅲ) 循环水式多用真空泵;DLSB-5/20型低温冷却液循环泵(天津科诺仪器设备有限公司);RE-52A旋转蒸发仪(巩义市英峪予华仪器厂);ZF-20D暗箱式紫外分析仪(上海顾村电光仪器厂);AL 204万分之一天平(瑞士METTLER TOLEDO公司);ACS-30型电子计价秤(上海花潮电器有限公司)。
1.2 补骨脂酚的制备方法本研究中,为了提高补骨脂酚的得率,简化制备工艺,提高制备效率,系统考察了不同体积石油醚、提取时间、提取次数等影响因素。提取补骨脂酚的影响因素考察见表1。
| 组别 | 补骨脂药材(kg) | 石油醚(L) | 提取时间(h) | 提取次数(次) |
| 1 | 1.003 | 5 | 36 | 3 |
| 2 | 1.002 | 10 | 24 | 2 |
| 3 | 1.004 | 15 | 12 | 1 |
经不同提取工艺制备的补骨脂酚粗提物,分别加石油醚溶解,硅胶(200~300目)拌样,补骨脂酚粗提物、石油醚体积、硅胶质量比为100∶50∶120(g/mL/g)。
石油醚和硅胶(100~200目)按体积质量比5∶1(mL/g)装柱,将补骨脂酚粗提物样品进行硅胶柱层析分离,石油醚洗脱,每2.5 L为1个流份,共收集4个流份,经TLC跟踪,合并流份1~3,减压浓缩,得补骨脂酚粗品。
为进一步纯化补骨脂酚粗品,加石油醚溶解,硅胶(200~300目)拌样,其中,补骨脂酚粗品、石油醚体积、硅胶质量比为100∶50∶120(g/mL/g);石油醚和硅胶(100~200目)按体积质量比5∶1(mL/g)装柱,将补骨脂酚粗品进行硅胶柱层析分离,石油醚-乙酸乙酯(12∶1)洗脱,1 L为1个流份,经TLC跟踪,10%硫酸乙醇显色,合并含有补骨脂酚的流份,减压浓缩,得补骨脂酚纯品。
1.3 供试品溶液制备及UPLC分析 1.3.1 液相色谱条件色谱柱:Agilent ZORBAX SB-C18 Rapid Resolution HT (4.6×100 mm,1.8 μm);甲醇-水(85∶15)等度洗脱;柱温:30 ℃;流速:0.3 mL/min;进样量:2 μL;检测波长:246 nm。
1.3.2 供试品溶液的制备取补骨脂酚3.60 mg,精密称定,置2 mL量瓶中,用甲醇溶解并定容至刻度,摇匀,取适量配成浓度为0.09 mg/mL的供试品溶液,14 000 r/min离心10 min,取上清液,即得。
2 结果与讨论系统研究了不同体积石油醚、提取时间、提取次数对补骨脂酚得率的影响,结果表明:补骨脂经5倍量石油醚、提取36 h、提取3次得补骨脂提取物140 g,经硅胶柱纯化得到补骨脂酚粗品78 g(经UPLC分析其纯度约30%),得率为7.8%;经10倍量石油醚、提取24 h、提取2次得补骨脂提取物134 g,经硅胶柱纯化得到补骨脂酚粗品77 g(经UPLC分析其纯度约30%),得率为7.7%;经15倍量石油醚、提取12 h、提取1次得补骨脂提取物118 g,经硅胶柱纯化得到补骨脂酚粗品60 g(经UPLC分析其纯度约30%),得率为6.0%。因此,选择5倍量石油醚、提取36 h、提取3次作为补骨脂酚的最佳提取工艺。
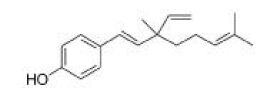
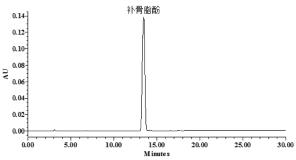
合并上述补骨脂酚粗品215 g,进行硅胶柱层析分离,得补骨脂酚纯品30 g,得率为1.0%。通过核磁(1H NMR和13C NMR)数据与文献资料进行比较[19],化合物被确证为补骨脂酚,化学结构见图1,经UPLC检测,纯度> 98%,见图2,数据如下。
补骨脂酚:淡黄色油状物。
|
| 图1 补骨脂酚的化学结构 Fig.1 The chemical structure of Bakuchiol |
|
| 图2 补骨脂酚的UPLC色谱图 Fig.2 UPLC chromatograms of Bakuchiol |
1H NMR (400 MHz,CDCl3): 7.24 (2H,d,J=8.4 Hz,H-2,6),6.76 (2H,d,J=8.4 Hz,H-3,5),6.25 (1H,d,J=16.4 Hz,H-7),6.05 (1H,d,J=16.4 Hz,H-8),5.89 (1H,dd,J=17.2,10.8 Hz,H-17),5.12 (1H,bt,J=6.8 Hz,H-12),5.04 (1H,dd,J=6.0,1.2 Hz,H-18a),5.00 (1H,dd,J=12.8,1.2 Hz,H-18b),1.95 (2H,dd,J= 17.2,7.6 Hz,H-10),1.67 (3H,s,H-14),1.58 (3H,s,H-15),1.49 (2H,m,H-11),1.19 (3H,s,H-16)。 13C NMR (100 MHz,CDCl3): 154.7 (C-4),146.1 (C-17),136.0 (C-7),131.4 (C-1),131.1 (C-13),127.5 (C-2,6),126.6 (C-8),124.9 (C-12),115.5 (C-3,5),112.0 (C-18),42.7 (C-9),41.4 (C-10),25.8 (C-15),23.5 (C-16),23.4 (C-11),17.8 (C-14)。
3 结论本研究建立了一种制备补骨脂酚的方法,该方法具有操作简便,成本低廉,收率稳定等优点,能够大量制备补骨脂酚,适合规模化生产的需要,为补骨脂资源的综合开发利用和产业化奠定了基础。
| [1] | 国家药典委员会. 中国药典[S]. 一部. 北京: 中国医药科技出版社, 2010: 174. |
| [2] | 曹金一. 补骨脂本草文献与质量研究[D]. 北京: 北京中医药大学, 2009: 93. |
| [3] | 林汉钦, 丁秀玉, 张温良, 等. 包含补骨脂酚的用于治疗妇女骨质疏松症的医药组合[P]. 中国专利: CN1827090A , 2005-03-04. |
| [4] | Kim Y C, Oh H, Kim B S, et al. In vitro protein tyrosine phosphatase 1B inhibitory from seeds of Psoralea corylifolia[J]. Planta Med, 2005, 71(1): 87-89. |
| [5] | Krenisky J M, Luo J, Reed M J, et al. Isolation and anti-hperglycemic activity of bakuchiol from Otholobium pubescens (Fabaceae), a peruvian medicinal plant used for the treatment of Diabetes[J]. Biol Pharm Bull, 1999, 22(10): 1137-1140. |
| [6] | Pae HO, Cho H, Oh G S, et al. Bakuchiol from Psoralea corylifolia inhibits the expression of inducible nitric oxide synthase gene via the inactivation of nuclear transcription factor-kappa B in RAW 264.7 macrophages[J]. Int Immunopharmacol, 2001, 1(9-10): 1849-1855. |
| [7] | Choi S Y, Lee S, Choi W H, et al. Isolation and anti-inflammatory activity of bakuchiol from Ulmus davidiana var. Japonica[J]. J Med Food, 2010, 13(4): 1019-1023. |
| [8] | Ferrandiz M L, Gil B, Sanz M J, et al. Effect of bakuchiol on leukocyte functions and some inflammatory responses in mice[J]. J Pharm Pharmacol, 1996, 48(9): 975-980. |
| [9] | 于 茜, 邹海曼, 王 帅, 等. 补骨脂酚对ESF-1细胞抗衰老基因调控机制研究[J].中药材, 2014, 37(4): 632-635. |
| [10] | 贾 琦, 洪梅芬. 补骨脂酚的组合物及其制备方法[P]. 中国专利: CN101217968A, 2008-07-09. |
| [11] | Kaul R. Kinetics of the anti-staphylococcal activity of bakuchiol in vitro (author’s transl)[J]. Arzneimittelforschung, 1976, 26(4): 486-489. |
| [12] | Hsu PJ, Miller JS, Berger JM. Bakuchiol, an antibacterial component of Psoralidium tenuiflorum[J]. Nat Prod Res, 2009, 23(8): 781-788. |
| [13] | Lau KM, Fu LH, Cheng L, et al. Two antifungal components isolated from Fructus Psoraleae and Folium Eucalypti Globuli by bioassay-guided purification[J]. Am J Chin Med, 2010, 38(5): 1005-1014. |
| [14] | Newton SM, Lau C, Gurcha SS, et al. The evaluation of forty-three plant species for in vitro antimycobacterial activities: isolation of active constituents from Psoralea corylifolia and Sanguinaria Cannadensis[J]. J Ethnopharmacol, 2002, 79(1): 57-67. |
| [15] | Katsura H, Tsukiyama RI, Suzuki A, et al. In vitro antimicrobial activities of bakuchiol against oral microorganisms[J]. Antimicrob Agents Chemother, 2001, 5(11): 3009-3013. |
| [16] | 郭礼和, 赵 刚, 王雪松. 补骨脂酚类化合物的应用[P]. 中国专利: CN101088498B, 2011-09-07. |
| [17] | Haraguchi H, Inoue J, Tamura Y, et al. Inhibition of mitochondrial lipid peroxidation by Bakuchiol, a meroterpene from Psoralea corylifolia[J]. Planta Med, 2000, 66(6): 569-571. |
| [18] | Haraguchi H, Inoue J, Tamura Y, et al. Antioxidative components of Psoralea corylifolia[J]. Phytogether Res, 2002, 16(6): 539-544. |
| [19] | Cecilia Labbe, Francesca Faini, Joseph Coll, et al. Bakuchiol derivatives from the leaves of psoralea glandulosa[J]. .Phytochemistry, 1996, 42(5): 1299-1303 |
2. Research and Development Center of Traditional Chinese Medicine, Tianjin International Joint Academy of Biotechnology and Medicine, Tianjin 300457, China
 2016, Vol. 33
2016, Vol. 33