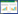文章信息
- 张毅宏 , 杨国莉 , 付莹 , 张钊 , 曹泽伟 , 张俊 , 王天锡 , 郭娜 , 高俊琴
- ZHANG Yi-hong , YANG Guo-li , FU Ying , ZHANG Zhao , CAO Ze-wei , ZHANG Jun , WANG Tian-xi , GUO Na , GAO Jun-qin
- 西药联合理气中药对糖尿病大鼠胃排空延迟的影响及其机制研究
- Study on the mechanism and the effects of prokinetic agents combined with Chinese herbs on the delayed gastric emptying in diabetic rats
- 天津中医药, 2016, 33(6): 363-367
- Tianjin Journal of traditional Chinese Medicine, 2016, 33(6): 363-367
- http://dx.doi.org/10.11656/j.issn.1672-1519.2016.06.12
-
文章历史
- 收稿日期: 2016-03-28
2. 天津市南开医院消化内科, 天津 300100
化疗在恶性肿瘤综合治疗中有举足轻重的地位,据美国癌症协会估计,90%以上肿瘤患者死亡在不同程度上受到耐药的影响。在恶性肿瘤的治疗过程中,肿瘤患者对化疗药物的耐药性成为肿瘤治疗的最大瓶颈之一。有些肿瘤,在治疗开始时就会出现对药物的高度耐受,另一些肿瘤,化疗开始时有效,久用则产生抗药,如小细胞肺癌等,出现获得性抗药性(粤糟择怎蚤则藻凿则藻泽蚤泽贼葬灶糟藻)称为继发性耐药[1]。化疗过程中产生耐药性是肿瘤化疗失败的主要原因,因此克服多药耐药性是治疗肿瘤不可回避的问题[2]。肿瘤细胞对化疗药物的耐药性与肿瘤的发生一样,是一个多因素、多步骤的过程。目前研究耐药机制较为广泛的是P-糖蛋白(P-gp)外排,大多数研究认为化疗药物在体内作用减少主要是因为药物在细胞内流减少,或者由于外排增多,其中P-gp、肺抗药性相关蛋白(蕴砸孕)是细胞膜的转运蛋白,肿瘤药物可以通过细胞膜的转运蛋白使外排增多,从而减少更有效,并在神经肌肉水平阐明其机制,从而为临床使用提供基础理论支持。
1 材料与方法 1.1 材料 1.1.1 实验动物7周龄雄性SD大鼠70 只,体质量(250±10)g。
1.1.2 主要试剂四氧嘧啶(ALX):瑞士ALEXIS公司;理气中药(陈皮、玫瑰花、木香、枳实、香附各10 g,按传统工艺制备水煎剂,浓缩至1 g/mL):广东一方制药有限公司;盐酸×托必利胶囊:哈药集团制药总厂,规格:50 mg×20 粒;精蛋白锌胰岛素注射液:江苏万邦生化医药股份有限公司,400 U/瓶;兔抗鼠神经元型一氧化氮合酶(灶晕韵杂)抗体:SantaCruz公司。
1.2 方法 1.2.1 糖尿病大鼠模型制备雄性SD大鼠70 只,适应性饲养1周后,按照随机数字表法随机分为2组:正常组(A 组,10 只)和模型组(60 只)。所有大鼠禁食12 h,测血糖、称质量,血糖值偏高的大鼠予以剔除。模型组大鼠禁食水24 h后,以新配制的5%ALX溶液按120 mg/kg 剂量,经腹腔30 s内快速注入,正常组大鼠腹腔注射等容积生理盐水,2 h后将50%葡萄糖20 mL放入饮水槽中,并恢复常规饲料喂养。72 h后,58 只模型组大鼠血糖值在13.5耀30.5 mmol/L范围,平均(22.80±3.34)mmol/L,模型大鼠出现进食、饮水量增加,体质量下降,即制模成功。2只大鼠未成模,予以剔除。成模率为96.67%。
糖尿病组大鼠造模成功后,对照组(B 组)、理气中药治疗组(C 组)经随机数字法各分为15 只,×托必利治疗组(D 组)、×托必利联合理气中药治疗组(E组)各14 只。
1.2.2 给药糖尿病大鼠模型制备成功后,各组均选用普通饲料喂养。在此基础上,A、B组大鼠每日灌服生理盐水10 mL/kg,C 组大鼠每日灌服中药20 mL/kg,D 组大鼠每日灌服×托必利125 mg/kg,E 组大鼠每日灌服×托必利125 mg/kg 联合中药20 mL/kg。在实验过程中,定期用断尾法测量各组大鼠血糖,并称体质量、记录摄食摄水量。在饲养给药过程中因高渗昏迷、低血糖导致B 组2 只、C组1 只大鼠死亡,至24 周饲养结束时,实际各组大鼠数量为:A组10 只,B 组13 只,C 组14 只,D 组14 只,E组14 只。
1.2.3 13C胃排空呼气实验检测准备直径大小不等的桶状塑料瓶若干,剪成两段,在瓶盖上剪一直径与软胶管一致的小口,穿一段长约2 cm的软胶管连接,供大鼠呼吸。在瓶底剪一直径与硬胶管一致的小口,穿一段长约5 cm 的硬胶管连接,留约4 cm在瓶外,用胶带将连接处密封。所有动物禁食24 h,收集零时气100 mL 后。预先用13C-辛酸和蛋黄煎制好的实验餐(13C-辛酸18 mg 加入1/5 个蛋黄中),每只动物喂食等量实验餐,立即将大鼠根据体型大小放入适宜的瓶内,头朝瓶盖呼气处,尾对瓶底,连接处用胶带进行密封固定。用一长约5 cm 的软胶管将硬胶管与红外线能谱分析仪连接,在仪器负压的吸引下,将瓶内的空气吸入仪器内,收集15、30、45、60、75、90、105、120、150、180、210、240 min 气各100 mL检测,计算胃固体半排空时间并记录。
1.2.4 组织病理学检测所有大鼠胃组织迅速用10%的福尔马林固定液中固定,石蜡包埋、切片。标本采用苏木-×红(HE)染色,并进行nNOS 免疫组化染色。用显微镜观察胃壁切片组织,重点观测肌间神经丛,高倍镜(40 倍)下观察nNOS 阳性的细胞数量及强度,于低倍镜(10 倍)视野下,测量单位长度内胃壁神经元细胞数量。
1.2.5 统计学方法采用SPSS18.0 软件进行统计学分析,计量数据采用均数±标准差(x±s)表示,组间比较采用单因素方差分析,重复测量计量资料比较采用重复测量方差分析,P<0.05 为差异有统计学意义。
2 结果 2.1 建立DM动物模型造模前各组大鼠血糖波动均在正常范围,且两两之间比较无统计学差异(P>0.05)。造模后,第1 天、第2 天和第24 周A 组血糖无明显变化,为正常波动,与造模前比较差异无(P>0.05)。B 组,C 组、D 组和E 组血糖水平在造模后第1 天、第2 天、第24 周呈现升高趋势,与造模前比较均显著升高(均P<0.01)。且造模1 周后模型组(B 组,C 组、D 组和E 组)大鼠体质量较造模前有(20±5)g 下降,综合上述表现,可认定造模成功。见表 1。此后每周定期测量大鼠体质量,造模1周后,可发现模型组大鼠与对照组大鼠体质量相比较明显降低,差异有统计学意义(P<0.05)。见表 2。
| g | ||||
| 组别 | 动物数 | 造模前 | 造模后1周 | 造模后24周 |
| A组 | 10 | 220.5±4.6 | 227.4±5.3 | 319.1±14.8 |
| B组 | 13 | 214.5±4.9 | 212.3±24.8* | 210.1±26.7* |
| C组 | 14 | 221.1±3.3 | 214.7±16.6*#△ | 214.1±28.5*#△ |
| D组 | 14 | 220.4±4.3 | 221.9±23.4*#△ | 208.5±23.8*#△ |
| E组 | 14 | 221.6±3.0 | 211.3±12.8*# | 232.6±18.3*# |
| 注:与A 组比较,*P<0.05;与B 组比较,#P<0.05;与E 组比较,△P<0.05。 | ||||
| mmol/L | ||||
| 组别 | 动物数 | 造模前 | 造模后1d | 造模后24周 |
| A组 | 10 | 4.73±0.56 | 4.51±0.69 | 5.12±0.55 |
| B组 | 13 | 4.55±0.51 | 23.8±0.29* | 24.1±0.33* |
| C组 | 14 | 4.31±0.56 | 25.2±0.25* | 23.7±0.23* |
| D组 | 14 | 5.02±0.76 | 23.9±0.41* | 22.7±0.61* |
| E组 | 14 | 4.60±0.73 | 24.2±1.68* | 23.2±0.25* |
| 注:与A组比较,*P<0.01。 | ||||
B组大鼠胃固体半排空时间较A 组大鼠明显延长,差异有统计学意义(P<0.01),C 组及D 组大鼠胃固体半排空时间较B 组大鼠显著缩短(P<0.05),而E 组大鼠胃固体半排空时间较C 组及D 组时间明显缩短,差异有显著性﹙P<0.01﹚。见表 3。
| 组别 | 动物数13C | 胃固体半排空时间(皂蚤灶) |
| A组 | 10 | 111.07±7.62 |
| B组 | 13 | 200.98±5.74* |
| C组 | 14 | 130.41±3.48# |
| D组 | 14 | 146.29±7.86# |
| E组 | 14 | 116.43±3.77△▲ |
| 注:与A 组比较,*P<0.01;与B 组比较,#P<0.05;与C 组比较, △P<0.05;与D组比较,▲P<0.05。 | ||
如图 1 所示,在HE 染色下,正常大鼠胃壁结构、肌层均完整,可见肌间神经丛,糖尿病大鼠(B、C、D、E 组)可见胃平滑肌细胞形态改变,胞浆染色淡,透亮,有空泡样变性坏死,胃环肌及纵肌变薄(见表 4),胃肌间神经丛数量较正常大鼠明显减少(见表 5,P<0.05)。给药后,D 组大鼠胃环形肌厚度较B 组及C 组大鼠明显增加(P<0.05),E 组大鼠胃环形肌及纵形肌厚度均较B 组大鼠增加,差异有统计学意义(P<0.05),但与C 组和D 组大鼠相比无统计学差异(P>0.05)。

|
| 图 1 大鼠胃组织HE染色结果(10×10) Fig. 1 HE staining results of stomach tissue in rats(10×10) A:正常大鼠HE 染色可见胃壁结构完整,肌层完整,肌间可见神经丛;B:糖尿病大鼠HE染色可见肌层变薄,肌间神经丛数量减少,非神经元细胞增多;C:×托必利联合理气中药治疗后大鼠HE染色肌间神经丛数量增加,平滑肌增厚;D:D组大鼠HE 染色肌间神经丛数量增加,平滑肌增厚;E:E 组大鼠HE染色肌间神经丛数量增多,呈疏网状。 |
| mm | |||
| 组别 | 动物数 | 环形肌厚度 | 纵行肌厚度 |
| A组 | 10 | 0.40±0.09 | 0.06±0.03 |
| B组 | 13 | 0.25±0.07* | 0.03±0.03* |
| C组 | 14 | 0.31±0.08* | 0.06±0.01 |
| D组 | 14 | 0.39±0.08△# | 0.04±0.05 |
| E组 | 14 | 0.40±0.04*# | 0.06±0.04*# |
| 注:与A 组比较,*P<0.01;与B 组比较,#P<0.05;与C 组比较,△P<0.05。 | |||
| 个/mm | |||
| 组别 | 动物数 | 胃壁肌间神经丛数目 | nNOS阳性神经丛数 |
| A组 | 10 | 6.83±2.81 | 4.14±1.70 |
| B组 | 13 | 3.12±2.50* | 2.13±1.94* |
| C组 | 14 | 4.45±1.65*△ | 3.12±1.74* |
| D组 | 14 | 4.27±1.63*# | 3.14±1.50* |
| E组 | 14 | 4.95±2.10*△ | 3.45±1.65*△ |
| 注:与A 组比较,*P<0.01;与B 组比较,#P<0.05;与D 组比较,△P<0.05。 | |||
肌间神经丛数目方面D 组较B 组明显增加,C 组及E 组大鼠肌间神经丛数目较D 组明显增加(P<0.05),E 组与C 组相比,差异无统计学意义(P>0.05)。
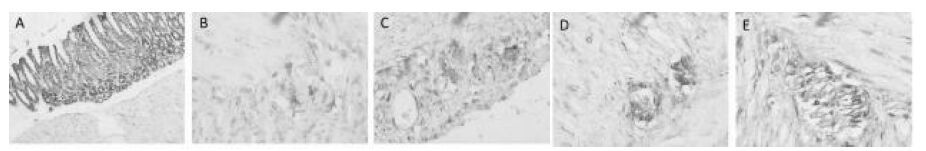
2.4 nNOS免疫组化染色结果如图 2 所示,A 组大鼠nNOS 免疫组化染色表达明显,而B 组大鼠nNOS 阳性神经数目显著减少,C、D、E 组大鼠染色结果可见nNOS 细胞阳性表达。统计结果显示(见表 5),糖尿病组大鼠nNOS 阳性神经丛数量均明显少于A 组(P<0.05),但给药的各组大鼠nNOS 阳性神经丛表达高于B 组,E 组大鼠nNOS 阳性神经丛数明显高于D组。
|
| 图 2 大鼠胃组织免疫组化结果(40×10) Fig. 2 Results of the immunohistochemical staining of stomach tissue in rats(40×10) A:A组大鼠nNOS神经丛呈阳性表达;B:B组大鼠nNOS 神经丛及神经元细胞均减少;C:C组大鼠nNOS 神经丛及神经元细胞均呈阳性表达; D:D组大鼠nNOS神经丛及神经元细胞均呈阳性表达;E:E 组大鼠nNOS 神经丛及神经元细胞均呈阳性表达 |
近年来,全球糖尿病患病率呈逐年增高趋势。据统计,美国目前有糖尿病的患者超过2 900万人,预计到2050年,每3 个人中就会有一个糖尿病患者[3]。糖尿病是一种慢性代谢紊乱性疾病,发病机制复杂,目前的治疗多为对症治疗,无法根治[4]。
110 多年前,Minkowshi等最早用切除狗胰腺的方法建立糖尿病动物模型,随着相关研究的不断发展,目前已有多种建立糖尿病动物模型的方法。选取适当的方法建立糖尿病相关动物模型,对于糖尿病及其并发症的研究具有至关重要的作用[5],目前通常采用大鼠建立糖尿病动物模型。ALX为常用化学药物[6-7]。四氧嘧啶是一种茁细胞毒剂,大鼠等多种动物注射四氧嘧啶后,可对其胰岛茁细胞造成不可逆的损害,甚至坏死,影响胰岛素的分泌功能,注射24 h后即可出现持续性高血糖状态,最终导致糖尿病的发生,因此多年来一直用于复制糖尿病动物模型。四氧嘧啶大鼠糖尿病模型是评价抗糖尿病药物疗效及安全性的常用模型[8]。本研究通过腹腔注射ALX的方法建立糖尿病大鼠模型,24 h后血糖明显升高,并一直持续到24 周,且模型大鼠多饮、多尿,体质量下降,符合糖尿病的表现,与既往文献报道一致。
本研究中糖尿病模型大鼠胃固体半排空时间较正常大鼠也明显增加。既往研究认为可能与自主神经病变有关[9]。中医学多将胃轻瘫归于恶心、反胃、痞满、积滞等病范畴,有人根据其病机命名为胃缓、胃痹[10-11]。从中医角度来说,本病是消渴病日久阴伤气耗,致中气虚损、脾升胃降失和、气机失调为主,脾气虚弱、运化无力为本,气滞、血瘀、湿阻、痰浊、食积、湿热等引起胃失和降为标,为虚实夹杂之证[2]。而关于糖尿病性胃轻瘫的治疗,中医多应用陈皮、枳实、木香、香附、玫瑰花等理气类中药,本方各位药配伍应用共奏运脾和气之效。本实验中的陈皮性温,味辛、苦,入脾、胃、肺经,具行气、疏肝、健脾、止痛等功效。临床常用于脾胃气滞之脘腹胀满或疼痛、消化不良;枳实性寒,味苦、辛,除痞消积,对大鼠胃动力有显著的促进作用,其机制可能与促进胃动素(MLT)释放及减少促胃液素分泌有关[12]。此外枳实还能兴奋大鼠胃肠道移行复合运动波(MM悦),其作用与P 物质(SP)有关[13]。木香性温,味辛、苦,归脾、胃经,有行气止痛的功效,并善理脾胃之气滞,具有明显的促进胃排空作用。香附性平,味辛、微苦、甘,可行气疏肝,解郁,以治气滞,其对肠动力传输有明显促进作用;玫瑰花性温,味甘,微苦,入肝、脾二经,具有理气解郁、活血散瘀的功效。现在药理研究证实玫瑰花有改善内脏微循环,在组织水平和细胞水平上有显著的抗氧化作用。诸药合用,集辛散、苦降、甘调于一方,虽治在调理脾胃之气,又旁顾肝肺。既理气调中,又培补中焦,兼顾肝肺,而使三焦通达,脾胃调和,枢机畅利,从而使脾胃功能恢复如常[14],共奏健脾运化、调和气机之功效。西医多给予促胃动力药促进胃排空,本研究旨在观察理气中药、促动力西药×托必利及两者联合在治疗糖尿病胃轻瘫方面的作用,初步探讨其作用机制。
本实验结果证实,上述五味理气中药组方及促胃肠动力西药×托必利均具有显著促进糖尿病大鼠胃排空的作用,改善胃轻瘫,并且理气中药较×托必利促进胃液体排空效果更加明显。理气中药和促胃肠动力西药相联合可明显减少糖尿病大鼠胃固体排空和液体排空时间,疗效优于两者单独应用。为研究其机制,进一步进行病理组织学研究,发现与正常大鼠相比,糖尿病模型大鼠胃组织平滑肌细胞形态改变,肌层变薄,神经丛数量减少。免疫组化发现nNOS 表达减少。既往研究也有类似发现,即糖尿病大鼠模型nNOS 阳性神经元密度减少[15-16]。应用理气中药或×托必利24 周后,大鼠胃组织肌层变厚,胃壁肌间神经丛增多,nNOS 阳性神经元增多,且两者联用在改善胃壁肌间神经丛数目、nNOS 阳性神经丛数、平滑肌厚度方面效果优于单独应用。因此,理气中药联合促胃肠动力西药改善糖尿病胃排空时间可能与其对平滑肌和肌间神经丛的保护作用有关。可见,在治疗糖尿病性胃轻瘫时,在给予西药促动力药的同时,适当给予理气中药辅助治疗是合理有效的治疗方法。
| [1] | 罗丹, 刘诗. 糖尿病胃轻瘫胃动力异常机制[J]. 胃肠病学杂志,2007,12 (6) : 372–375 |
| [2] | 季建隆, 赵云燕. 糖尿病胃轻瘫中西医研究进展[J]. 中华现代中医学杂志,2008,4 (4) : 323–325 |
| [3] | Miller JD, Richman DC. Preoperative Evaluation of Patients with Diabetes Mellitus[J]. Anesthesiol Clin,2016,34 (1) : 155–169 |
| [4] | Eng C, Kramer CK, Zinman B, et al. Glucagon-like peptide-1receptor agonist and basal insulin combination treatment for the management of type 2 diabetes: a systematic review and meta-analysis[J]. Lancet,2014,384 (9961) : 2228–2234 |
| [5] | Van Diepen JA, Jansen PA, Ballak DB, et al. Genetic and pharmacological inhibition of vanin-1 activity in animal models of type 2 diabetes[J]. Sci Rep,2016, (6) : 21906 |
| [6] | Zheng XK, Zhang L, Wang WW, et al. Anti-diabetic activity and potential mechanism of total flavonoids of Selaginella tamariscina (Beauv[J]. J Ethnopharmacol,2011,137 (1) : 662–668 |
| [7] | Skovsø S. Modeling type 2 diabetes in rats using high fat diet and streptozotocin[J]. J Diabetes Investig,2014,5 (4) : 349–358 |
| [8] | Bhata V, Nayak BS. Renoprotective Effects, Protein Thiols and Liver Glycogen Content of Alloxan-induced Diabetic Rats Treated with Different Fractions of Heartwood of Pterocarpus marsupium[J]. Nat Prod Commun,2015,10 (11) : 1843–1846 |
| [9] | Lomax AE, Sharkey KA, Furness JB. The participation of the sympathetic innervation of the gastrointestinal tract in disease states[J]. Neurogastroenterol Motil,2010,22 (1) : 7–18 |
| [10] | 白长川, 曹魏. 糖尿病性胃轻瘫的中医药治疗评价[J]. 辽宁中医杂志,2004,31 (7) : 619–620 |
| [11] | 肖万泽, 陈俊, 张红星, 等. 糖胃康对糖尿病胃轻瘫大鼠胃肠推进作用的实验研究[J]. 辽宁中医杂志,2003,30 (9) : 773–776 |
| [12] | 邹燕琴, 赖天松, 李政木, 等. 枳实消痞丸对功能性消化不良患者胃动力学及胃肠激素的影响[J]. 广州中医药大学学报,1999,16 (4) : 305–307 |
| [13] | 王翠芬, 杨泛治, 魏义全, 等. 枳实对大鼠胃肠肌电活动影响的初步研究[J]. 东南大学学报(医学版),2001,20 (3) : 153–156 |
| [14] | 彭超. 中医药治疗糖尿病胃轻瘫的研究进展[J]. 河南中医,2008,28 (5) : 83–86 |
| [15] | Wrzos HF, Cruz A, Polavarapu R, et al. Nitric oxide synthase (NOS) expression in the myenteric plexus of streptozotocin-diabetic rats[J]. Dig Dis Sci,1997,42 (10) : 2106–2110 |
| [16] | Spangeus A, El-Salhy M. Myenteric plexus of obese diabetic mice (an animal model of human type 2 diabetes)[J]. Histol Histopathol,2001,16 (1) : 159–165 |
2. Department of Dastroenterology, Tianjin Nankai Hospital, Tianjin 300100, China
 2016, Vol. 33
2016, Vol. 33