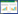文章信息
- 王丽 , 赵颖 , 崔换天 , 李薇 , 宋新波 , 边育红
- WANG Li , ZHAO Ying , CUI Huan-tian , LI Wei , SONG Xin-bo , BIAN Yu-hong
- 基于IL-7的甘草多糖抗肿瘤机制的研究
- Study on the anti-tumor effect mechanism of Gancao polysaccharide on production of IL-7
- 天津中医药, 2016, 33(6): 373-377
- Tianjin Journal of traditional Chinese Medicine, 2016, 33(6): 373-377
- http://dx.doi.org/10.11656/j.issn.1672-1519.2016.06.14
-
文章历史
- 收稿日期: 2015-12-24
2. 天津中医药大学, 天津 300193;
3. 天津市肝病研究所, 天津 300192
肿瘤是威胁人类健康的重大疾病,目前其治疗手段以手术、放化疗等为主。但是由于这些方法在杀死肿瘤细胞的同时也损伤正常细胞,大大降低了其临床治疗效果。目前,寻找有效低毒的抗肿瘤及抗肿瘤辅助药物是国内外肿瘤防治研究的热点。
多糖,又称多聚糖,是由单糖组成的高分子化合物,是所有生命有机体的重要组成部分,自上世纪40 年代人们从黏质塞氏杆菌(Serratia marcescens)分离出具有抗肿瘤活性的细菌多糖以来,多糖的抗肿瘤作用越来越得到人们的关注。中药多糖以其扶正兼祛邪的优势,已广泛应用于抗肿瘤的临床治疗,如人参多糖注射液联合化疗治疗晚期非小细胞肺癌能够有效缓解患者的临床症状和体征,提高患者生活质量,无明显不良反应[1]。中国现已有香菇多糖片、黄芪多糖注射液等多种多糖制剂的上市销售。虽然中药多糖具有明确的抗肿瘤作用,但其分子机制尚不明确,制约了其临床使用。
多糖是具有复杂的空间结构大分子化合物,研究表明,大部分多糖不能被直接分解吸收,且多糖的生物学活性与其空间构象有一定的关系,即使会有部分多糖在消化道被降解成单糖而吸收,也丧失了原本特有的活性。因此,处于机体与外界抗原接触第一线的肠黏膜上皮细胞逐渐被关注,有学者提出小肠黏膜上皮细胞是健脾益气中药的主要药理作用靶点[2]。如口服黄芪多糖和猪苓多糖可以通过刺激肠上皮细胞,发挥其免疫调节作用[3],灵芝多糖可以刺激H22 肝癌小鼠肠道黏膜,调节全身免疫系统发挥抗肿瘤作用[4]。课题组前期研究结果发现,甘草多糖具有明确的抗肿瘤活性,并且可以刺激小肠黏膜上皮细胞分泌白细胞介素-7(IL-7)等细胞因子发挥免疫调节作用。综上本研究将以小肠黏膜上皮细胞分泌IL-7入手,探讨甘草多糖抗肿瘤潜在机制,为甘草多糖的临床应用提供理论依据。
1 材料 1.1 药品与试剂甘草多糖(由天津中医药大学中一制药有限公司提供);香菇多糖(浙江普洛康裕天然药物有限公司批号:120901)IL-7 抗体(北京博奥森,批号131122);RPMI 1640 培养基(美国Hyclone 公司)、特级胎牛血清(FBS,以色列BioInd公司);胰蛋白酶(美国Hyclone 公司);青霉素、链霉素(美国Hyclone 公司)。
1.2 仪器PCR 仪:Bio-RAD iQTM5;CO2 恒温培养箱:Forma 3110,Thermo;倒置相差显微镜:NikonECLIPSE TS100;Milli-Q 超纯水系统:美国Millipore公司。
1.3 实验动物Balb/C 小鼠,购自中国人民解放军军事医学科学院卫生学环境医学研究所实验动物中心,雄性,鼠龄6周,体质量18~22 g。
1.4 细胞株CT-26 肿瘤细胞株购自中科院上海生命科学研究所细胞库。
2 方法 2.1 甘草多糖的提取与精制采用前期报道的实验方案提取甘草粗多糖[5],将甘草粗多糖配制成5%水溶液,80 Hz、30℃超声1 h,室温搅拌4 h以待多糖充分溶解。6 000 r/min离心10 min除去水不溶性物质,上清液浓缩后采用57%~82%乙醇浓度进行醇沉操作,醇沉时均搅拌2 h,4℃过夜,抽滤,沉淀±次用95%乙醇、丙酮洗数次。sevage法脱蛋白、透析除盐,冷冻干燥后,备用。
2.2 动物造模与分组此次实验所用的Balb/C 小鼠饲养于天津中医药大学实验动物中心,保持室温在(22±2)益,湿度40%±10%;自然光照射,小鼠适应环境2 d后进行实验。
造模方法:取CT-26 细胞悬液,经生理盐水稀释计数后调整细胞至5伊105个/mL,每鼠右腋下接种0.2 mL。荷瘤小鼠按照随机数字表法随机分为4 组,每组8 只,做好标记。分别为阳性对照组(香菇多糖组)、模型组、甘草多糖与IL-7抗体联用组(IL-7组)、甘草多糖组,另外8 只正常小鼠作为正常组,称质量,记录数据,标记。给药剂量与方式如表 1 所示。
| 组别 | 给药剂量 |
| 正常组 | 生理盐水0.2 mL/只 |
| 模型组 | 生理盐水0.2 mL/只 |
| 香菇多糖组 | 香菇多糖灌胃195 mg/kg |
| 甘草多糖组 | 甘草多糖灌胃500 mg/kg, |
| IL-7 | 组甘草多糖灌胃500 mg/kg,IL-7 抗体第0、5、10天腹腔注射0.4 mg/kg |
实验过程中每日观察荷瘤小鼠的活动能力、毛发和摄食、饮水量变化等情况。
2.4 甘草多糖对荷瘤小鼠肉瘤的影响第14 天给药2 h后,将小鼠颈椎脱臼处死,分离瘤块,取肿瘤组织,于生理盐水中稍稍漂洗残血,吸水纸轻轻吸干多余水分后,称质量,记录数据,计算抑瘤率,公式如下:
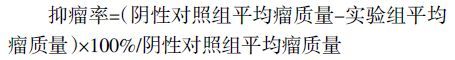 |
第14天给药2 h后,将小鼠颈椎脱臼处死,分离脾脏和胸腺于生理盐水中稍稍漂洗残血,吸水纸轻轻吸干多余水分后,称质量,记录数据,按下式计算胸腺指数、脾脏指数。
 |
第14 天给药2 h后,将小鼠颈椎脱臼处死,剪取约5 cm 的小肠,DEPC 水洗净肠道内污物及杂质,剪开肠道,用洁净玻璃板刮取小肠内壁上皮组织,置于冻存管中,将样品于液氮中速冻,然后放到-80℃冰箱内保存。从-80℃冰箱内取出组织,在液氮中磨碎,每100 mg 组织内加入1 mL裂解液RZ,置于冰上,用匀浆仪处理。按照总RNAIsolation Kit 说明书,首先抽提总RNA,使用UV 法检测每个样品中的总RNA 浓度,OD260/280 在1.8~2.2范围内被认为是提取的总RNA 纯度较高。取2 μg总RNA,按照逆转录试剂盒操作说明进行逆转录,逆转录合成cDNA,反应体系10μL,37益反应60min。然后±照SYBR Green Real Time RT-PCR 说明书,以获得的cDNA 为模版,进行实时灾光定量核酸扩增,分别扩增IL-7、茁-catenin,反应体系20 μL,扩增条件:95℃预变性15 min,94℃变性15 s,退火/延伸55℃,30 s,共40 个循环。所得CT值经转换后以2-驻驻CT相对定量法获得目的基因相对表达量数值。目的基因及内参基因引物由沙船(天津)生物科技发展有限公司合成,引物序列见表 2。
| 引物名称 | 引物序列(5'-3') | |
| β-actin | forward | 5'AGAGGGAAATCGTGCGTGAC3' |
| reverse | 5'CAATAGTGATGACCTGGCCGT3' | |
| IL-7 | forward | 5'GAGTTTCAGACGGCACACAA3' |
| reverse | 5'GAAACTTCTGGGAGGGTTCC3 |
第14 天给药2 h后,眼眶静脉丛取血法收集血液,离心后血清保存于-80℃冰箱。检测时将血清从-80℃冰箱中取出,置于冰上,备用。使用IL-7 抗体试剂盒,按说明书上步骤操作:将试剂盒置于室温中平衡30 min,从铝箔袋中取出板条,设置标准品孔S0、S1、S2、S3、S4、S5,各加50 μL;样品孔中先加待测样品10 μL,再加样品稀释液40 μL;空白孔为纯水;除空白孔外,每孔加入辣根过氧化物酶(HRP)标记的检测抗体100 μL,用封板膜封住反应孔,37℃恒温箱培育60 min;弃去液体,板条于吸水纸上拍干,每孔加200 μL 洗涤液,静置1 min,甩去洗涤液,吸水纸上拍干,重复此操作5 次;洗净后,每孔加入底物A、B 各50 μL,37℃避光培育15 min后,每孔加入终止液50 μL,5 min 后,于450 nm 下检测各孔的OD值。
2.8 统计方法采用SPSS 18.0 统计软件进行分析,计量资料以均数±标准差(x±s)表示,各组间比较采用单因素方差分析统计处理,P<0.05为差异有统计学意义。
3 实验结果 3.1 甘草多糖精制与纯化将甘草粗多糖经过醇沉、脱蛋白和除盐等处理后得到精制的甘草多糖,通过课题组前期报道[5-6]的苯酚-硫酸法测得该多糖含量为65%,高效凝胶色谱法测定其分子量分布如图 1 所示。

|
| 图 1 甘草多糖高效凝胶色谱图 Fig. 1 HPGPC chromatogramof Gancao polysaccharide |
在接种CT-26 肿瘤细胞悬液后的前6 d,各组小鼠一般状况均未发现明显差异,正常进食饮水,反应敏捷,被毛亮泽。自接种第7 天开始,小鼠开始出现腋下膨隆,而后出现小的瘤块,食欲下降,自主活动减少,精神萎靡。其中模型组以上反应最为明显,其他各组反应均有所缓解。
3.3 甘草多糖对CT-26 细胞荷瘤小鼠抑瘤率的影响由表 3可知,甘草多糖组和香菇多糖组的瘤质量均低于模型组(P<0.05),甘草多糖组的抑瘤率最高,为21.56%;IL-7 组瘤质量虽低于模型组,但肿瘤重量与模型组相比无统计学差异(P>0.05)。实验结果提示甘草多糖和香菇多糖均具有一定的抗肿瘤作用,IL-7抗体可以阻断甘草多糖的抗肿瘤作用。
| 组别 | 动物数 | 肿瘤质量(x±s,g) | 抑瘤率(%) |
| 模型组 | 5 | 5.08±0.47 | 0 |
| 香菇多糖组 | 5 | 4.17±0.33* | 17.99 |
| 甘草多糖组 | 5 | 3.98±0.73* | 21.56 |
| 注:与模型组比较,*P<0.05。 | |||
从表 4可知,与正常组相比,模型组小鼠脾脏质量及脾脏指数显著增高,胸腺质量及胸腺指数显著降低;各给药组脾脏质量与脾脏指数和模型组小鼠相比差异无显著性(P>0.05),与模型组小鼠相比,香菇多糖组和甘草多糖组胸腺重量和胸腺指数均显著提高,甘草多糖组提高最多(P<0.05),但甘草多糖组与香菇多糖组间差异无显著性。
| 组别 | 体质量 | 脾脏重量(mg) | 胸腺重量(mg) | 脾脏指数(mg/g) | 胸腺指数(mg/g) |
| 正常组 | 20.50±0.96 | 73.38±8.3** | 25.94±7.24** | 3.58±0.34** | 1.28±0.40** |
| 模型组 | 21.19±1.55 | 276.30±79.04 | 8.99±3.43 | 12.94±3.24 | 0.43±0.13 |
| 香菇多糖组 | 21.65±1.68 | 246.14±60.17 | 14.39±3.01* | 11.30±2.18 | 0.66±0.13* |
| 甘草多糖组 | 23.78±0.94* | 292.80±27.32 | 19.60±6.97* | 12.29±0.77 | 0.83±0.29* |
| IL-7组 | 22.30±1.23 | 275.34±49.19 | 12.72±5.46 | 12.32±1.86 | 0.56±0.22 |
| 注:与模型组比较,*P<0.05,**P<0.01。 | |||||
如图 2 所示,与模型组相比较,香菇多糖、甘草多糖和IL-7 组均可以极显著提高荷瘤小鼠小肠黏膜上皮细胞IL-7 的表达,IL-7 组提高最多推测可能是由于腹腔注射的IL-7 抗体中和了体内产生的IL-7 后引起机体反馈性产生更多IL-7 有关,具体机制还需进一步实验证明。
|
| 图 2 甘草多糖对小肠黏膜上皮细胞IL-7 mRNA表达的影响 Fig. 2 Expression of IL-7 mRNA on intestinal epithelial cells 注:与模型组比较,**P<0.01。 |
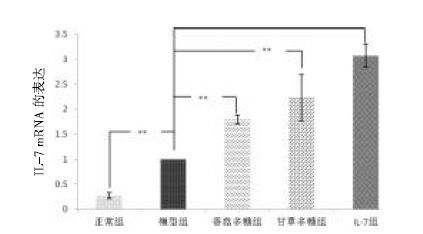
结果表明:标准曲线方程为$\hat{Y}$=0.010 6X+0.0125,r2=0.997 2。按照上述线性回归方程计算各组血清中IL-7 含量,结果显示:正常组、模型组、香菇多糖组和IL-7 抗体组中血清所含IL-7 含量均没有达到试剂盒检测限,甘草多糖组可以测得血清中含量为28.95 pg/mL。实验结果提示,提高IL-7 表达可能是甘草多糖抗肿瘤的重要作用环节。见图 3。
|
| 图 3 IL-7 标准曲线图 Fig. 3 IL-7 standard curve |
甘草为豆科甘草属植物乌拉尔甘草(Glycyrrhizauralensis Fisch.)、胀果甘草(Glycyrrhiza inflate Bat.)或光果甘草(Glycyrrhiza glabra L.)的干燥根及根茎。传统中医理论认为其具有补脾益气、缓急止痛、缓和药性和泻火解毒等功效[7]。甘草多糖是一种α-吡喃多糖,是甘草的主要活性成分之一,现代药理学研究发现甘草多糖可以调节机体免疫功能,并具有一定的抗肿瘤活性,对多种实体瘤均有良好的抑制作用[8]。但目前甘草多糖抗肿瘤作用尚不明确,有学者推测甘草多糖的抗肿瘤作用与激活免疫监视系统有关,也有学者认为可能是通过影响细胞因子的分泌,间接达到杀伤肿瘤的作用[9-11]。因此明确甘草多糖作用机制将为其在肿瘤的临床治疗中的应用提供理论支持。
IL-7 为促红细胞生成素家族玉型短链细胞因子,由152 个氨基酸残基组成,分子量为20耀28 kDa。编码它的基因位于8q12耀13,包含6 个外显子。近年来,大量研究结果表明IL-7 具有良好的抗肿瘤作用,IL-7 能抑制肿瘤生长,有研究将重组人IL-7 注射至荷人纤维肉瘤小鼠的肿瘤基底部,发现一定浓度的IL-7能抑制肿瘤生长,甚至使部分小鼠肿块完全消退。进一步研究发现,重组人IL-7腹腔用药能增加正常或荷瘤小鼠脾、淋巴结中白细胞数量,限制肿瘤转移。Komschlies等[12]将IL-7用于肾癌伴有肺转移的小鼠模型上,随后观察到IL-7产生了明显的抗肿瘤效果,转移灶缩少75%,伴有全身T 细胞、B细胞、NK 细胞、巨噬细胞的增多,提示IL-7 提高了机体抗肿瘤能力。动物实验也揭示IL-7的抗肿瘤作用与T细胞密切相关,IL-7 可以促进T淋巴细胞的成熟、防止其凋亡;提高T 细胞介导的细胞免疫;抑制调节性T细胞增殖;增强抗肿瘤免疫反应[13-15]。IL-7 还可以调节多种细胞因子水平达到抗肿瘤作用。IL-7可以减低免疫抑制因子TGF-茁分泌,提高IFN-γ、CXCL9、CXCL10、IL-1、IL-6、IL-12 和IL-17等细胞因子的表达,以提高宿主抗肿瘤免疫反应效能[16-17]。因此,目前学者认为血清中的IL-7 升高是宿主免疫系统抵抗肿瘤作用的一种表现形式[18]。
本实验结果提示,甘草多糖具有良好的抗肿瘤作用,可以增加荷瘤小鼠小肠粘膜上皮细胞IL-7mRNA的表达,并增加血清中IL-7 的含量,采用抗体中和IL-7 以后,甘草多糖抗肿瘤活性显著降低。因此,笔者推测甘草多糖可能是作用于小肠黏膜上皮细胞,促进其IL-7 的分泌,进而提高免疫系统功能,达到抗肿瘤作用。
| [1] | 刘锐.人参多糖注射液联合化疗治疗晚期非小细胞肺癌的临床研究[D]. 兰州:兰州大学, 2008. |
| [2] | 张雷. 黄芪、猪苓多糖对肠上皮细胞及经肠上皮对巨噬细胞吞噬功能的影响[D]. 广州:广州中医药大学, 2009. |
| [3] | 周桂琴, 赵宏艳, 吕诚, 等. 灵芝多糖对H22肝癌小鼠肠道黏膜免疫功能的影响[J]. 中国中西医结合杂志,2009,29 (4) : 335–339 |
| [4] | 陈蔚文. 健脾益气中药的小肠隐窝细胞药理靶点探讨[J]. 广州中医药大学学报,2004,21 (5) : 356–360 |
| [5] | 李薇, 宋新波, 孙成荣, 等. 三个不同品种甘草多糖的含量测定[J]. 天津中医药,2013,30 (1) : 47–49 |
| [6] | 赵颖, 宋新波, 张丽娟, 等. 高效凝胶色谱法测定甘草多糖分子量及其分子量分布[J]. 天津中医药,2015,32 (1) : 46–48 |
| [7] | 刘三侠, 吴俊伟, 林永乐. 甘草多糖药理作用研究进展[J]. 中国兽药杂志,2013,47 (1) : 64–67 |
| [8] | 谢海龙, 都晓伟, 于丹, 等. 甘草多糖的药理作用研究进展[J]. 价值工程,2011,30 (3) : 285 |
| [9] | 孙向阳, 邓毅. 甘草多糖的主要药理作用概述[J]. 中国社区医师(医学专业),2011,13 (24) : 179–180 |
| [10] | 李晓冰, 何小鹃, 刘彪, 等. 甘草多糖对H22荷瘤小鼠的免疫调节作用[J]. 中西医结合学报,2010,8 (4) : 363–367 |
| [11] | 王岳五, 张海波, 吕杰, 等. 甘草残渣中多糖 GPS 抗肿瘤作用的研究[J]. 南开大学学报(自然科学版),2000, (4) : 46–48 |
| [12] | Komschlies KL, Gregorio TA, Gruys ME, et al. Administration of recombinant human IL-7 to mice alters the composition of B-lineage cells and T cell subsets, enhances T cell function, and induces regression of established metastases[J]. J Immunol,1994 : 5776–5785 |
| [13] | Thomas C, Marc P, et al. Albert Lin. CD4 T cells, lymphopenia, and IL-7 in a multistep pathway to autoimmunity[J]. PNAS,2008,105 (8) : 2999–3004 |
| [14] | Yuan CH, Yang XQ, Zhu CL, et al. Interleukin-7 enhances the in vivo anti-tumor activity of tumor-reactive CD8+ T cells with induction of IFN-gamma in a murine breast cancer model[J]. Asian Pac J Cancer Prev,2014,15 (1) : 265–271 |
| [15] | Simonetta F, Chiali A, Cordier C, et al. Increased CD127 expression on activated FOXP3+CD4+ regulatory T cells[J]. Eur J Immunol,2010,40 (9) : 2528–2538 |
| [16] | Tan JT, Dudl E, LeRoy E, et al. IL-7 is critical for homeostatic proliferation and survival of naive T cells[J]. Proc Natl Acad Sci USA,2001 : 8732–8737 |
| [17] | Asa A, Minu KS, Marni HW, et al. Role of CXCR3 ligands in IL-7/IL-7Rα-Fc-mediated antitumor activity in lung cancer[J]. Clin Cancer Res,2011,17 (11) : 3660–3672 |
| [18] | Sherven S, Raj KB, Seok CY, et al. Interleukin-7 gene-modified dendritic cells reduce pulmonary tumor burden in spontaneous murine bronchoalveolar cell carcinoma[J]. Hum Gene Ther,2003,14 (16) : 1511–1524 |
2. Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China;
3. Tianjin Medical Research Institute of Liver Disease, Tianjin 300192, China
 2016, Vol. 33
2016, Vol. 33