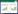文章信息
- 匡海学 , 吴高松 , 刘华 , 吴琼 , 王秋红 , 王知斌
- KUANG Hai-xue , WU Gao-song , LIU Hua , WU Qiong , WANG Qiu-hong , WANG Zhi-bin
- 龙胆苦苷和龙胆碱的生物转化和药理活性研究进展
- Progress in biotransformation and pharmacological activities of gentiopicroside and gentianine
- 天津中医药, 2016, 33(7): 385-389
- Tianjin Journal of traditional Chinese Medicine, 2016, 33(7): 385-389
- http://dx.doi.org/10.11656/j.issn.1672-1519.2016.07.01
-
文章历史
- 收稿日期: 2016-03-01
龙胆科(gentiana) 植物在临床上具有广泛的应用,龙胆苦苷和龙胆碱是其中主要的活性成分,广泛存在于条叶龙胆(Gentiana manshurica Kitag.) 、龙胆(G. scabra Bge.) 、三花龙胆(G. triflora Pall.) 、坚龙胆(G. rigescens Franch.) 、尖叶假龙胆[G. acuta(Michx.) Hulten]、秦艽(G. macrophylla Fisch.) 等植物中。龙胆苦苷属于环烯醚萜苷类,分子式为C10H9NO2(2) ,具有促进胃排空和肠蠕动、保肝、抗氧化、抗炎等药理活性作用。龙胆碱又称秦艽碱甲,属于吡啶类生物碱,分子式为C10H9NO2(2),具有抗炎、解热、镇痛等作用。龙胆苦苷和獐牙菜苦苷(3) 在植物内生真菌和人体肠内菌作用下可以转化成龙胆碱。目前对龙胆苦苷等环烯醚萜类成分及龙胆碱在药理活性及生物转化方面的研究引起了广泛的关注,为此对其最新研究作一总结归纳。
1 龙胆苦苷的药理作用 1.1 对胃肠道系统的作用龙胆苦苷可以显著减少生长抑素(SST) 和增加促胃液素(GAS) 在血浆中的含量,促进血浆胃动素受体(MTLR) 在胃窦、十二指肠、空肠和回肠中的表达,抑制血管活性肠肽受体(VIPR2) 在十二指肠中的表达,从而促进胃排空和肠蠕动[1]。SST是一种由胃肠道黏膜上皮细胞产生的多肽类物质,对胃排空,胆囊收缩,大小肠的推进活动及消化道的内外分泌有强烈的抑制作用[2]。GAS由胃窦产生,能够刺激胃酸分泌,加强小肠和结肠运动[3]。胃动素(MTL) 促进胃肠蠕动的机制是酝栽蕴砸的激活,酝栽蕴砸是一种典型的郧蛋白耦联受体可以与Gαq/11 转导通路结合,任何影响MTLR 表达的都会引起胃肠蠕动的变化[4]。血管活性肠肽(VIP) 是消化道中主要的非肾上腺和非胆碱能激素,刺激它的特定受体VIPR2,可以使其在胃肠道组织中大量表达,导致平滑肌舒张,抑制胃肠蠕动[5-6]。此外,龙胆苦苷能够改善便秘,消化不良,腹胀和反流性食管炎[7],也可以加速胃排空,促进胃肠蠕动。还能增加胃酸分泌,改善阿托品抑制的大鼠和小鼠胃肠蠕动[8]。
1.2 抗炎作用龙胆苦苷可以通过抑制白细胞介素-1β(1L-1β) 信号传导途径(P38、ERK和JNK等) 来抑制IL-1β诱导的大鼠关节软骨细胞的炎症反应。此外,龙胆苦苷也可以抑制IL-1β诱导的基质金属蛋白酶(1L-1β) 的释放和促进域型胶原蛋白的表达[9]。给大鼠灌胃龙胆苦苷可明显减轻胰腺炎,增加血清淀粉酶和脂肪酶的含量,抑制肿瘤坏死因子原α(TNF-α) 和1L-1β聚集,减弱组织病理学变化及NF-kBp65蛋白在胰腺组织中的表达[10]。
1.3 镇痛作用龙胆苦苷的镇痛作用机制与抑制GluN2B在小鼠前扣带皮层的表达有关。龙胆苦苷可显著逆转小鼠杏仁核中生物胺、半胱氨酸蛋白酶和GluN2B 中的N-甲基-D-天冬氨酸(NMDA) 受体水平。如果同时用郧造怎晕圆月的受体拮抗剂Ro25-6981,龙胆苦苷对氧化应激的抑制作用就会消失,说明龙胆苦苷对利血平诱导的疼痛-抑郁综合征的作用是通过抑制杏仁核中的GluN2B 受体的应激反应而实现的[11]。在小鼠醋酸扭体法和热板法实验中,龙胆苦苷经皮下注射给药后,可减少小鼠扭体次数,提高小鼠的痛阈值,表明龙胆苦苷对热和化学刺激引起的疼痛反应有明显的镇痛作用[12]。
1.4 保肝作用对小鼠灌胃龙胆苦苷,能明显降低四氯化碳(CCl4) 急性肝损伤小鼠血清中谷丙转氨酶(ALT) 、谷草转氨酶(AST) 水平,增加肝组织中谷胱甘肽过氧化物酶活力,并使小鼠胆汁流量明显增加,胆汁中胆红素浓度提高。并且口服龙胆苦苷能明显对抗CCl4 对肝的损伤,但对D-氨基半乳糖(D-GlaN) 肝损伤的保护作用不明显[13]。
1.5 其他作用龙胆苦苷对人的肝癌细胞具有杀伤作用,可以抑制人肝癌细胞的增殖。此外龙胆苦苷还具有松弛平滑肌、利胆、健胃、抗氧化等作用[14]。
2 龙胆碱的药理作用 2.1 解热抗炎作用龙胆碱具有显著的解热作用,且解热作用强于龙胆苦苷。龙胆苦苷在肠内菌的作用下可以迅速降解为龙胆碱,推测龙胆苦苷的解热作用可能是通过代谢转变为龙胆碱而发挥作用的[15]。此外,龙胆碱具有一定的抗炎作用,雄性大鼠灌胃龙胆碱,可以抑制栽晕云原α及大鼠血清中抵抗细菌内毒素的白细胞介素-6(1L-1β) 的增加[16]。
2.2 镇静催眠作用给小鼠腹腔注射不同剂量的龙胆碱溶液,并采用酶联免疫吸附(ELASA) 法测定脑匀浆中γ-氨基丁酸(GABA) 、5-羟色胺(5-HT) 含量。结果显示龙胆碱高低剂量组都可以减少小鼠自主活动次数,增加阈下剂量戊巴比妥钠致小鼠入睡的只数并延长小鼠睡眠时间,龙胆碱能够增加脑内GABA含量,但对5-HT含量无影响,推测龙胆碱镇静催眠作用与增加脑内GABA含量有关[17]。
2.3 抗惊厥作用龙胆碱具有显著的抗惊厥作用。在每次惊厥前给治疗组大鼠腹腔注射龙胆碱,惊厥组和对照组分别注射等量的生理盐水,治疗组白细胞介素-8(IL-8) ,TNF-α的含量明显下降,改变有明显性差异[18]。推测龙胆碱的抗惊厥作用与体内细胞因子IL-8,TNF-α水平下调有关,这两种细胞因子共同参与了导致脑组织神经功能异常与热性惊厥发生的活动。龙胆碱对发育期大鼠反复惊厥后的海马神经元具有一定的抗凋亡作用,这一作用可能是龙胆碱发挥抗惊厥性脑损伤作用的机制之一[19],其抗惊厥所致的脑损伤作用的机制与脑内神经递质GABA、谷氨酸(Glu) 改变有关[20]。
2.4 其他作用龙胆碱对革兰氏阴性菌及阳性菌均有一定的抑制作用[21]。此外,龙胆碱还具有降压,升血糖及拮抗组织胺和乙酰胆碱引起的肠管收缩等作用[22]。
3 龙胆苦苷与龙胆碱的转化及龙胆苦苷代谢物 3.1 龙胆苦苷与龙胆碱的体外转化龙胆苦苷可以和氢氧化铵反应产生龙胆碱,若在提取过程中不加氨水,则不可能得到龙胆碱,说明龙胆碱是龙胆苦苷与氨作用而产生的[23]。
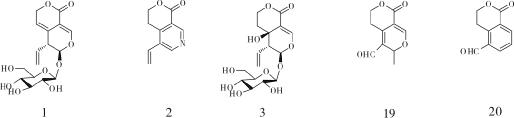
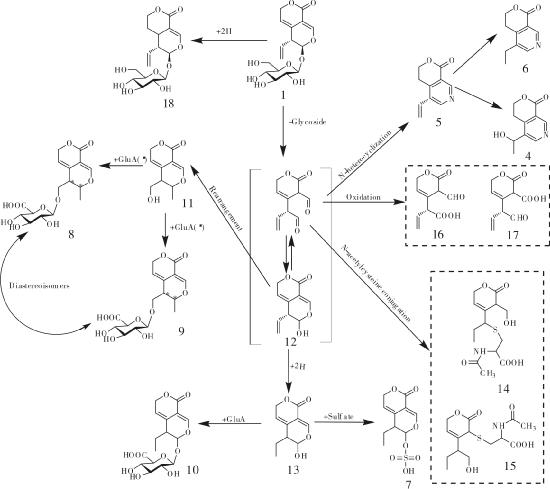
3.2 龙胆苦苷的生物转化龙胆苦苷经人体代谢可以产生多种代谢产物,龙胆苦苷在人肠内菌的影响下,可以迅速代谢转化生成龙胆碱和龙胆醛[24]。采用改良的UPLC/Q-TOF-MS 测定法从口服龙胆苦苷的健康男性体内获取的尿液样品中成功分离15 种龙胆苦苷的代谢物(4-18) 。在龙胆苦苷整个代谢循环中,龙胆苦苷先去糖基化,之后发生氧化、N-杂环化、糖酯化等反应形成具有保肝作用的活性成分,发挥龙胆苦苷的保肝作用,其中形成的一对非对映异构体(化合物8和9) 与龙胆苦苷相关活动有紧密的联系[25]。在对龙胆苦苷在大鼠体内的代谢进行研究时,通过2,4-二硝基苯肼衍生化作用和LC/MS 法成功地在大鼠血浆中发现龙胆苦苷两种代谢产物erythrocentaurin(19) 和gentiopicral(20) 。Penicillium crustosum存在于食品、饲料和植物中[27-29],是很好的专一性和选择性的多酶系统,具有广泛的生物学功能[30-31]。内生真菌壳青霉菌(P.crustosum) 2T01Y01可引起龙胆苦苷的生物转化,以龙胆苦苷为底物,用壳青霉菌(P.crustosum) 2T01Y01 培养,龙胆苦苷先在真菌的作用下水解形成一个不稳定的半缩醛糖苷配基Ia,由于Ia不稳定的结构很容易转换成活性中间产物醛醇Ic和二醛Ib,它们经过还原、氧化、加氢、异构化等一系列反应形成了一些代谢产物,通过UPLC/Q-TOF-MS 测定了其中7 个去糖基的代谢产物(21-27) ,并且在这些代谢产物中,有一对顺反异构体(化合物22和23) [32]。见图 1-3。
|
| 图 1 化合物1,2,3,19,20 结构式 Fig. 1 The structures of compounds 1,2,3,19,20 |
|
| 图 2 龙胆苦苷在人体内的代谢途径 Fig. 2 Metabolic pathways of gentiopicroside in humans |
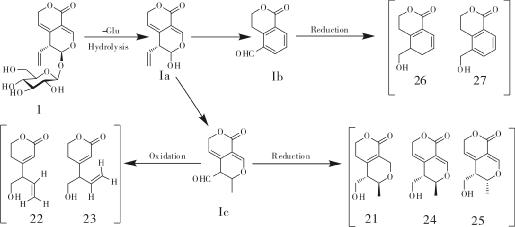
|
| 图 3 龙胆苦苷在P. crustosum 2T01Y01 内的代谢途径 Fig. 3 Gentiopicroside metabolic pathway of P. crustosum 2T01Y01 |
糖尿病患者最主要的一种病理缺陷是具有胰岛素抗性,它会引起胰岛素受体反应迟钝,在肌细胞和脂肪细胞中的胰岛素抗性状态是由于缺乏胰岛素γ刺激葡萄糖转运蛋白-4(GLUT-4) 表达和转移到细胞膜的能力[33],减弱了胰岛素刺激血糖进入脂肪细胞和肌肉中转变为脂肪和肌糖原的能力[34]。其次,上调过氧化物酶体增殖物激活受体-γ(PPAR-γ) 和脂联素基因的表达可以提高胰岛素对血糖刺激感受的灵敏度[35-36]。研究表明獐牙菜苦苷的抗糖尿病作用是由于其代谢产物龙胆碱的作用,龙胆碱对增加脂肪细胞分化和诱导PPAR-γ,GLUT-4 和脂联素的表达具有一个潜在的作用,龙胆碱通过上调PPAR-γ,GLUT-4 和脂联素基因表达诱导脂肪细胞因子形成,发挥龙胆碱的抗糖尿病作用[37]。
4 讨论随着研究的不断深入,对龙胆苦苷和龙胆碱药理作用和生物转化机制的了解也不断深入,纯度metabolic pathway of P. crustosum 2T01Y0198%以上的龙胆苦苷(秦龙苦素) 已经申请国家一类新药(临床批件号200303L260) ,该药主要用于对肝炎的治疗。近年又发现龙胆苦苷对关节炎具有很好的治疗作用[38],有望将龙胆苦苷开发成新药用于关节炎的治疗。在生物转化方面,龙胆苦苷通过口服只有相对较低的生物利用度,把龙胆苦苷作为前体药物而通过他们的苷元形式吸收或许是一条可行的解决途径。獐牙菜苦苷的抗糖尿病作用是由于其活性代谢产物龙胆碱的作用,龙胆苦苷在肠内菌的作用下也可以转化成龙胆碱,猜想龙胆苦苷发挥药效作用可能与獐牙菜苦苷类似,与其转化成龙胆碱的作用有关。目前对于龙胆苦苷和龙胆碱之间的生物转化化作用机制不是很清楚,这方面还需要进一步研究。
| [1] | Ruan M, Yu B, Xu L, et al. Attenuation of stress-induced gastrointestinal motility disorder by gentiopicroside from Gentiana macrophylla Pall[J]. Fitoterapia,2015 : 265–276 |
| [2] | Van Op den Bosch J, Adriaensen D, Van Nassauw L, et al. The role(s) of somatostatin, structurally related peptides and somatostatin receptors in the gastrointestinal tract:a review[J]. Regul Pept,2009,156 (1-3) : 1–8 |
| [3] | Thomas A. Gut motility, sphincters and reflex control[J]. Anaesth Intensive Care Med,2006,7 (2) : 57–58 |
| [4] | Cruz CR, Smith RG. The growth hormone secretagogue receptor[J]. Vitam Horm,2008 : 47–88 |
| [5] | Fujimiya M, Inui A. Peptidergic regulation of gastrointestinal motility in rodents[J]. Peptides,2000,21 (10) : 1565–1582 |
| [6] | Murthy KS, Zhang KM, Jin JG, et al. VIP-mediated G protein-coupled Ca2+ influx activates a constitutive NOS in dispersed gastric muscle cells[J]. Am J Physiol,1993,265 (4 Pt 1) : G660–671 |
| [7] | Shao XH, Zhou QW. Clinic research of jiaolong capsule, combining with omeprazole, on 45 cases of reflux esophagitis[J]. Contemp Med,2011 : 83–84 |
| [8] | Hou JW, Yao S, Huang LM, et al. The effect of overground part of Gentiana macrophylla pall on gastrointestinal activity[J]. Pharm Clin Chin Mater Med,2007 : 105–107 |
| [9] | Zhao L, Ye J, Wu GT, et al. Gentiopicroside prevents interleukin-1 beta induced inflammation response in rat articular chondrocyte[J]. J Ethnopharmacol,2015 : 100–107 |
| [10] | Lv J, Gu WL, Chen CX. Effect of gentiopicroside on experimental acute pancreatitis induced by retrograde injection of sodium taurocholate into the biliopancreatic duct in rats[J]. Fitoterapia,2015 : 127–133 |
| [11] | Liu SB, Zhao R, Li XS, et al. Attenuation of reserpine-induced pain/depression dyad by gentiopicroside through downregulation of GluN2B receptors in the amygdala of mice[J]. Neuromolecular Med,2014,16 (2) : 350–359 |
| [12] | 陈雷, 王海波, 孙晓丽, 等. 龙胆苦苷镇痛抗炎药理作用研究[J]. 天然产物研究与开发,2008,20 (10) : 903–906 |
| [13] | 刘占文, 陈长勋, 金若敏, 等. 龙胆苦苷的保肝作用研究[J]. 中草药,2002,33 (1) : 47–50 |
| [14] | 曾文雪, 宋小玲, 张尧, 等. 龙胆苦苷药理学活性及药动学研究进展[J]. 江西中医药,2014,45 (5) : 69–71 |
| [15] | 刘学伟, 曹敏, 刘树民. 龙胆碱的解热作用及机制研究[J]. 中国实验方剂学杂志,2011,17 (24) : 128–131 |
| [16] | Kwak WJ, Kim JH, Ryu KH, et al. Effects of gentianine on the production of pro-inflammatory cytokines in male Sprague-Dawley rats treated with lipopolysaccharide (LPS)[J]. Biol Pharm Bull,2005,28 (4) : 750–753 |
| [17] | 刘学伟, 刘树民, 柳长凤. 龙胆碱镇静催眠作用及对小鼠脑内5-HT、GABA含量的影响[J]. 时珍国医国药,2012,23 (2) : 394–396 |
| [18] | 刘学伟, 姚素媛, 刘树民, 等. 龙胆碱对反复高热惊厥大鼠血清IL-8、TNF-α和IFN-α水平的影响[J]. 中医药信息,2009,26 (5) : 52–53 |
| [19] | 刘学伟, 汪娜, 姚素媛, 等. 龙胆碱对高热惊厥大鼠海马神经细胞凋亡的影响[J]. 哈尔滨医药,2014,34 (4) : 256–257 |
| [20] | 姚素媛, 刘学伟, 刘树民. 龙胆碱对高热惊厥模型大鼠脑内氨基酸类神经递质含量及海马区GABAB、Glu受体的影响[J]. 时珍国医国药,2010,21 (7) : 1633–1635 |
| [21] | 李薇, 王琳琳, 余河水, 等. 龙胆碱的抑菌活性研究[J]. 长春中医药大学学报,2015,31 (4) : 690–692 |
| [22] | 刘天宇.龙胆碱的镇静作用及其体内药物动力学初步研究[D].吉林:黑龙江中医药大学,2010. |
| [23] | 郭亚健, 陆蕴如. 龙胆苦苷转化为秦艽丙素等生物碱的研究[J]. 药物分析杂志,1983,3 (5) : 268–271 |
| [24] | 宋纯清, 杨肖锋, 胡之璧. 龙胆苦甙的人肠内菌代谢实验观察[J]. 时珍国医国药,2001,12 (1) : 1–2 |
| [25] | Han H, Xiong AZ, He CY, et al. Combination of UHPLC/Q-TOF-MS, NMR spectroscopy, and ECD calculation for screening and identification of reactive metabolites of gentiopicroside in humans[J]. Anal Bioanal Chem,2014,406 (6) : 1781–1793 |
| [26] | Wang Z, Tang S, Jin Y, et al. Two main metabolites of gentiopicroside detected in rat plasma by LC-TOF-MS following 2,4-dinitrophenylhydrazine derivatization[J]. J Pharm Biomed Anal,2015 : 1–6 |
| [27] | Rodriguez R, Redman R. More than 400 million years of evolution and some plants still can't make it on their own:plant stress tolerance via fungal symbiosis[J]. J Exp Bot,2008,59 (5) : 1109–1114 |
| [28] | Gonda S, Kiss A, Emri T, et al. Filamentous fungi from Plantago lanceolata L. leaves:contribution to the pattern and stability of bioactive metabolites[J]. Phytochemistry,2013 : 127–136 |
| [29] | Sonjak S, Frisvad JC, Gunde-Cimerman N, et al. Comparison of secondary metabolite production by Penicillium crustosum strains, isolated from arctic and other various ecological niches[J]. FEMS Microbiol Ecol,2005,53 (1) : 51–60 |
| [30] | Flores E, Cabeza M, Quiroz A, et al. Effect of a novel steroid (PM-9) on the inhibition of 5alpha-reductase present in Penicillium crustosum broths[J]. Steroids,2003,68 (3) : 271–275 |
| [31] | Baffi MA, Romo-Sánchez S, Ubeda-Iranzo J, et al. Fungi isolated from olive ecosystems and screening of their potential biotechnological use[J]. N Biotechnol,2012,29 (3) : 451–456 |
| [32] | Zeng WL, Li WK, Han H, et al. Microbial biotransformation of gentiopicroside by the endophytic fungus Penicillium crustosum 2T01Y01[J]. Appl Environ Microbiol,2014,80 (1) : 184–192 |
| [33] | Shepherd PR, Gnudi L, Tozzo E, et al. Adipose cell hyperplasia and enhanced glucose disposal in transgenic mice overexpressing GLUT4 selectively in adipose tissue[J]. J Biol Chem,1993,268 (30) : 22243–22246 |
| [34] | Zinman B. PPAR gamma agonists in type 2 diabetes:how far have we come in ‘preventing the inevitable'? A review of the metabolic effects of rosiglitazone[J]. Diabetes Obes Metab,2001,3 (Suppl 1) : S34–43 |
| [35] | Trujillo ME, Scherer PE. Adipose tissue-derived factors:impact on health and disease[J]. Endocr Rev,2006,27 (7) : 762–778 |
| [36] | Ionescu C. A critical consideration of Romanian popular stomatology[J]. Viata Med Rev Inf Prof Stiint Cadrelor MediiSanit,1985,33 (10) : 235–240 |
| [37] | Vaidya H, Goyal RK, Cheema SK. Anti-diabetic activity of swertiamarin is due to an active metabolite, gentianine, that upregulates PPAR-gamma gene expression in 3T3-L1 cells[J]. Phytother Res,2013,27 (4) : 624–627 |
| [38] | Zhao L, Ye J, Wu GT, et al. Gentiopicroside prevents interleukin-1 beta induced inflammation response in rat articular chondrocyte[J]. J Ethnopharmacol,2015 : 100–107 |
 2016, Vol. 33
2016, Vol. 33