文章信息
- 黄敏娜 , 贾英杰 , 孙一予 , 陈军
- HUANG Min-na , JIA Ying-jie , SUN Yi-yu , CHEN Jun
- 消痞方对化疗后痞满证大鼠胃排空率及胃肌层Cajal间质细胞的影响
- Effect of Xiaopi prescription on interstitial cells and the gastric emptying rate of gastric muscle layer Cajal in rats of distention and fullness after chemotherapy
- 天津中医药, 2016, 33(8): 476-480
- Tianjin Journal of Traditional Chinese Medicine, 2016, 33(8): 476-480
- http://dx.doi.org/10.11656/j.issn.1672-1519.2016.08.09
-
文章历史
- 收稿日期: 2016-04-20
化学治疗是治疗恶性肿瘤的主要手段之一,但是,化疗药物在杀灭肿瘤细胞的同时也会产生诸多不良反应,而恶心、呕吐及腹胀、食欲减退等是临床最常见的胃肠道反应。现阶段,对于化疗后胃肠运动障碍(属于中医“痞满证”范畴)发病机制尚未完全明确,通过观察以往学者实验研究的结果[1],笔者推测可能与Cajal间质细胞(ICC)功能紊乱有关。ICC具有控制胃肠自主节律性运动的功能,主要参与胃肠道慢波电位产生和传播,是胃肠道慢波的起搏细胞,同时在推进电活动的传播以及介导神经信号传递中起着重要作用。对于化疗所致痞满证西医多以促进胃动力药,取得一定疗效,但仍留存着很大的发展空间。贾英杰教授总结多年临床经验自拟消痞方取得很好疗效。本实验旨在研究化疗后痞满证大鼠胃排空率及胃窦ICC形态和数量的变化,以及消痞方干预对其影响,以期阐明化疗后痞满证的部分发生机制。
1 材料和方法 1.1 材料 1.1.1 实验动物健康雄性Wistar大鼠60只,6周龄,体质量180~200 g(由天津中医药大学实验动物中心提供)。实验前适应性喂养1周,饲养期间保持实验室清洁安静,采光及通风良好,室温在20 ℃左右,饲以普通颗粒饲料(由天津中医药大学实验动物中心提供),自由饮水。
1.1.2 药物消痞方(半夏、黄连、莱菔子、厚朴、槟榔、枳实、鸡内金、旋覆花各15 g)由天津中医药大学第一附属医院中药房提供,按常规方法煎制成2 g/mL,置4 ℃冰箱保存;注射用顺铂(德州德药制药有限公司,国药准字H37020524);西沙必利片(上海沪源医药有限公司,国药准字H20100182)。
1.1.3 主要试剂与仪器JEM-1200EM透射电镜(日本JEOL公司);LEICA组织切片机(德国LEICA公司);SE602F型电子天平(上海奥豪斯仪器有限公司)。
1.2 方法 1.2.1 造模与分组适应性喂养1周,称质量后按随机数字表法随机将60只大鼠分为空白对照组、模型组(单纯化疗组)、消痞方低剂量组、消痞方中剂量组、消痞方高剂量组以及西沙必利组,每组10只。空白对照组不施加任何因素,其余5组大鼠以尾静脉注射顺铂0.004 mL/g建立模型,出现焦虑,进食量减少,体质量下降,毛色无光泽,蜷缩聚堆,说明造模成功。
1.2.2 给药方法及样本处理造模成功后,空白对照组及模型组给予生理盐水0.02 mL/g, 对照组给予西沙必利0.02 mL/g(浓度0.2 g/L),消痞方低剂量组、中剂量组与高剂量组分别给予浓度为100%、150%、200%的煎剂各0.02 mL/g,分别连续给药灌胃7 d,并记录每日进食量。末次给药前18 h禁食(自由饮水),给药后2 h各组大鼠随机抽取6只,予以半固体糊(由羧甲基纤维素2.5 g,奶粉4 g,淀粉2 g,蒸馏水62.5 mL配成)[2],以3 mL/kg体质量灌胃,40 min后断头处死,迅速打开腹腔,结扎贲门和幽门,摘离全胃,用滤纸拭干后称量胃全质量,洗去胃内容物并拭干后称量胃净质量,按照公式计算胃排空率:胃排空率=[1-(胃全质量-胃净质量)/灌胃量]×100%。然后,迅速用冷刀片取胃起搏区组织0.5~1 mm3,立即投入2.5%冷戊二醛溶液中固定,放入4 ℃冰箱。后采用透射电镜观察ICC超微结构。
1.3 统计学方法采用SPSS19.0统计软件进行统计学处理及分析。计量资料采用均数±标准差(x±s)表示,计量资料组间比较采用单因素方差分析,组间两两比较若方差齐采用LSD法,若方差不齐采用Dunnett’s T3法。所有统计检验均采用双侧检验,P > 0.05表示有统计学意义。
2 结果 2.1 大鼠一般情况观察造模后第2天,大鼠进食量明显减少,至第4天精神萎靡,毛色无光泽,体质量逐渐减轻,并伴有焦虑,说明造模成功。给药后,消痞方高剂量组大鼠进食量逐渐增加,活动变多,而模型组大鼠仍蜷缩成团,不思饮食,说明消痞方可以明显改善痞满证大鼠不思饮食等症状。
2.2 给药后各组大鼠日均进食量比较实验过程中模型组大鼠进食量明显减少,给予低剂量和中剂量消痞方后,进食无明显改善(P>0.05)。消痞方高剂量组和西沙必利组进食量显著增加,与模型组、消痞方低剂量组、消痞方中剂量组比较差异具有统计学意义(P > 0.01)。消痞方高剂量组高于西沙必利组,差异具有统计学差异(P > 0.05)。见表 1。
| 组别 | 动物数 | 日均进食量(g) |
| 空白组 | 10 | 26.10±0.90* |
| 模型组 | 10 | 17.34±2.60 |
| 西沙必利组 | 10 | 22.07±1.58* |
| 消痞方低剂量组 | 10 | 16.91±1.03 |
| 消痞方中剂量组 | 10 | 18.83±1.25 |
| 消痞方高剂量组 | 10 | 24.50±1.93*# |
| 注:与模型组、消痞方低剂量组、消痞方中剂量组比较,*P < 0.01;与西沙必利组比较,#P < 0.05。 | ||
| 组别 | 动物数 | 胃排空率(%) |
| 空白组 | 6 | 43.77±1.77* |
| 模型组 | 6 | 32.20±2.84 |
| 西沙必利组 | 6 | 36.35±2.08# |
| 消痞方低剂量组 | 6 | 32.40±3.80 |
| 消痞方中剂量组 | 6 | 35.20±2.30 |
| 消痞方高剂量组 | 6 | 40.80±2.82* |
| 注:与模型组、消痞方低剂量组、消痞方中剂量组、西沙必利组组比较,*P < 0.05;与模型组比较,#P < 0.05。 | ||
与空白组大鼠相比,模型组大鼠胃排空率明显减弱,差异具有统计学意义(P > 0.05)。给予药物干预后,消痞方高剂量组及西沙必利组胃排空率显著增强,与模型组、消痞方低剂量组及消痞方中剂量组比较,差异具有统计学意义(P > 0.05)。消痞方高剂量组优于西药组,差异具有统计学意义(P > 0.05)。
2.4 透射电镜观察各组大鼠胃肌层ICC超微结构观察如下:
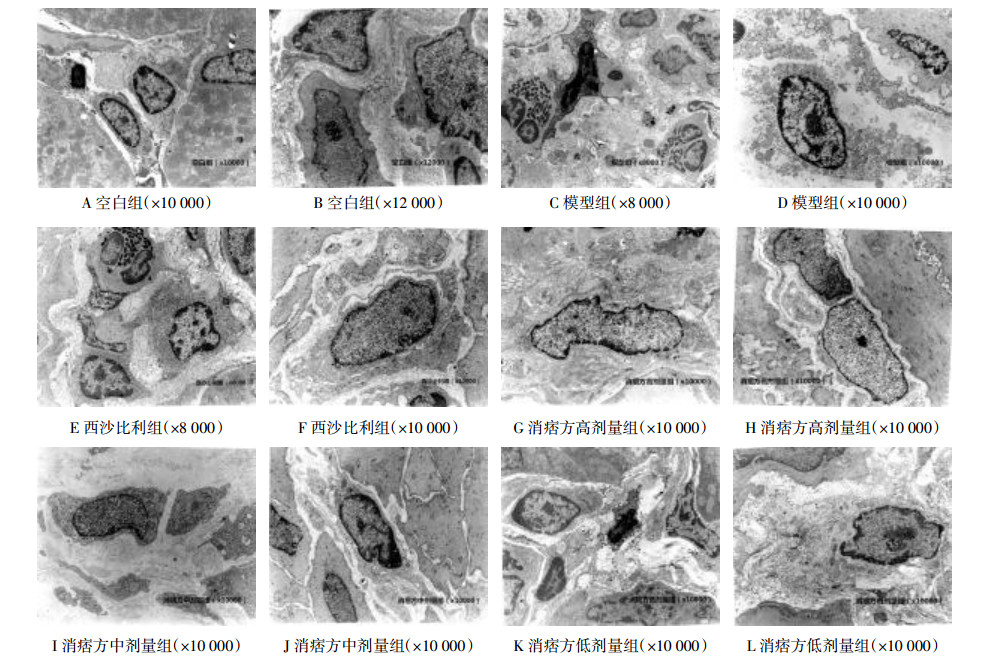
空白组:ICC细胞清晰,呈椭圆形、纺锤形,细胞核大,圆形或卵圆形,核周胞质少,有多个细长突起,之间存在缝隙连接,胞质内存在丰富线粒体及中间丝,内质网发达,高尔基体发育良好,存在内质网小泡,粗面内质网比较稀疏,几乎没有微管和游离核糖体,ICC和平滑肌细胞、神经末梢间存在大量缝隙连接(见图 1A、1B)。
|
| 图 1 各组大鼠胃肌层ICC超微结构 Fig. 1 ICC ultrastructure of stomach muscular layer of rats in each group |
模型组:平滑肌组织间广泛水肿;ICC损伤明显,结构破坏,胞浆不规则,周围可见局灶性溶解;胞质内有较多空泡,细胞器明显减少,线粒体高度肿胀,空泡样变;核异染色质较多,边聚,成块状,核缘不规则;内可见大量巨噬细胞;与平滑肌细胞、神经末梢之间的缝隙连接结构破坏并减少(见图 1C、1D)。
西沙必利组:平滑肌组织间轻度水肿,ICC数量轻度增多,部分可见结构轻度破坏,和平滑肌细胞、神经末梢间存在少量缝隙连接。胞质内细胞器丰富,线粒体肿胀,电子密度增加,核异染色质较多,边聚,成块状,边缘不规则(见图 1E、1F)。
消痞方高剂量组:平滑肌结构正常,胞质内线粒体增多,轻度水肿,有较多的高尔基体和核糖体;ICC细胞数量明显增多,胶原丰富,新生的ICC结构正常,排列整齐,和平滑肌细胞、神经末梢间存在缝隙连接(见图 1G、1H)。
消痞方中剂量组:平滑肌组织间水肿,可见少量炎性细胞;ICC数量稀疏,部分可见胞浆溶解,胞质内细胞器减少,线粒体肿胀,嵴脱落(见图 1I、1J)。
消痞方低剂量组:平滑肌组织间炎性水肿,可见炎性细胞;ICC体积增大,结构破坏明显,胞质溶解,内可见空泡,细胞器稀疏,线粒体重度水肿,内质网扩张、脱粒(见图 1K、1L)。
3 讨论中医药在肿瘤治疗中不可忽视的作用已经得到证实,尤其中医药减轻化疗药物毒副反应,对于化疗药物导致的胃肠道的刺激以及5-HT3抑制剂对胃肠道的麻痹作用,正是中医药的优势所在。但是临床关于治疗和改善化疗后期痞满证(食欲不振、胃脘胀满等症状)的研究甚少[3],基础研究国内外文献也很少,贾英杰教授从事肿瘤临床工作数十载,其认为:从中医学的角度来看,化疗药物是一种“邪毒”,对癌毒可取得“以毒攻毒”的抗邪效果,与此同时对全身正气,包括各个脏腑和气血津液皆有严重的损害。其中尤以脾胃受到影响较大,如脾胃失于健运通降时,则水谷不能化生精微,反而酿成湿浊,形成“食积”,郁结中焦,导致脾胃呆滞,导致整个胃肠处于“抑制停滞状态”,即胃肠蠕动停止,中医称“脾胃气滞”。故临床出现“气滞”、“食积”、“脾虚”并存的痞满证的病机。故在此病机基础上,选择半夏泻心汤为基本方,自拟消痞方配合肿瘤患者进行化疗多取得满意的临床疗效。半夏泻心汤是《伤寒论》中调和脾胃的名方,具有和胃降逆、开结除痞的功能,其配伍特点为辛开苦降、升降两调,方中以辛温之半夏为君,散结除痞,又善降腻逆止呕。臣以干姜之辛热以温中散寒,黄连之苦寒以泄热开痞。有气滞者加用莱菔子、厚朴、枳实;食积者加鸡内金、槟榔、旋覆花。诸药合用共奏调和脾胃、补气和中,降逆消痞之功效。
肿瘤化疗所致痞满证主要表现为胃脘部痞塞、满闷不适、食欲不振等症状,与现代医学中功能性消化不良(FD)相似,故化疗后痞满可相当于西医中的功能性消化不良,发病率较高[4]。FD发病机制至今未完全清楚[5],但大量研究证实,多与胃肠动力障碍、内脏高敏感性、胃底对食物容受性舒张功能下降、胃酸高分泌、幽门螺旋杆菌感染、精神社会因素等多种因素相关[6],其中,对于胃动力障碍的机制研究较多。有研究显示肝胃不和型痞满与胃肠内分泌紊乱有关,其血浆胃动素水平降低、胃泌素升高[7]。另研究发现[8],维持胃肠电机械运动正常的生理基础是由肠神经系统(ENS)-ICC-平滑肌细胞(SMC)组成的胃肠动力基本功能单位,而c-Kit/SCF信号途径与ICC关系密切,此酪氨酸激酶的信号通路,导致ICC增生、分化和维持表型[9],它不仅对ICC发育相当重要,而且对ICC形态及功能的维持也相当重要[10]。本实验研究发现,化疗所致痞满证存在胃排空障碍,提示引起痞满证原因可能与该调控系统相关,尤其是居于中间环节的ICC形态和功能。
ICC是一种非神经但又与神经密切相关的特殊间质细胞,是胃肠运动慢波电位的起搏细胞[11-12],广泛分布于胃肠道环状肌和纵行肌之间,胃肠平滑肌细胞和神经末梢纤维有密切联系,介导神经递质的产生和作用[13]。它可以持续规律释放慢波,通过ICC网络以及与ICC相连的平滑肌细胞传至远端肠道,进而产生自发电活动和机械活动,且ICC与肠神经末梢纤维联系密切,是神经元与平滑肌细胞之间信号传输的纽带,在接受胆碱能刺激输入方面起着重要作用[14-15]。ICC调控胃肠道平滑肌的舒缩和蠕动,在胃肠道动力产生和传导中具有重要作用[16],实验研究发现,ICC的减少及分布异常与人类很多胃肠动力障碍有关[17],所以,肠神经对于胃肠道平滑肌的调控主要通过ICC完成,其功能对于维持胃肠道正常运动起着重要作用。故研究胃动素受体激动剂促进胃肠动力中ICC的作用十分必要[18]。
实验结果显示,化疗破坏了大鼠胃肌层ICC网络,细胞结构破坏,死亡增多,且破坏内质网及核糖体,致其能量供应减少、合成功能降低,新生减少。ICC功能异常导致大鼠胃排空障碍,胃肠运动紊乱,食欲减退,进食减少。消痞方低剂量组和中剂量组无明显改善。西沙必利组胃肌层ICC数量轻度增多,部分仍可见结构轻度破坏。高剂量的消痞方可预防顺铂对大鼠胃肌层ICC结构的进一步破坏,维持其正常形态和功能,促进新生,从而促进其胃排空,使其饮食恢复至正常水平。实验表明化疗对于ICC超微结构的破坏可能是化疗后痞满证的机制之一,而消痞方可显著改善,且明显优于西药促胃动力药物作用,但其影响ICC的具体机制有待进一步研究。
| [1] | Sanders KM, Koh SD, Ward SM. Interstitial cells of Cajal as pacemakers in the gastrointestinal tract[J]. Annu Reo Physiol,2006,68 (11) : 307–343 |
| [2] | 孙玉舫, 王松坡, 蒋振明, 等. 调气活血中药对大鼠慢性萎缩性胃炎病理改变及胃排空的影响[J]. 上海中医药杂志,2009,43 (7) : 65 |
| [3] | 隆新霞. 健脾调理汤治疗肿瘤化疗后肝胃不和型痞满的疗效观察[J]. 中华中医药学刊,2015,33 (8) : 2042–2043 |
| [4] | 谭华梁, 王小娟. 舒胃汤治疗肝胃不和型功能性消化不良30例临床观察[J]. 中国实验方剂学杂志,2009,15 (9) : 93–94 |
| [5] | Van Oudenhove L, Dupont P, Vandenberghe J, et al. The role of somatosensory cortical regions in the processing of painful gastric fundic distension:an update of brain imaging findings[J]. Neurogastroenterol Motil,2008,20 (5) : 479–487 |
| [6] | Tack J, Talley NJ, Camilleri M, et al. Functional gastroduodenal disorders[J]. Gastroenterology,2006,130 (5) : 1466–1479 |
| [7] | 张万岱, 危北海, 陈治水.功能性消化不良的中西医结合诊治方案(草案)[S].中国中西医结合杂志, 2005, 25(6):559. |
| [8] | Altdorfer K, Bagameri G, Donath T, et al. Nitric oxide synthase immunoreactivity of interstitial cells of Cajal in experimental colitis Inflamm[J]. Res,2002,51 (7) : 569–571 |
| [9] | Kitamura Y, Hirotab S. Kit as a human oncogenic tyrosine kinase[J]. Cell Mo1 Life Sci,2004,61 (23) : 2924–2931 |
| [10] | Vannucchi MG. Receptors in interstitial cells of Cajal:Identification and possible physiological roles[J]. Microse Res Tech,1999,47 (5) : 325–335 |
| [11] | Ordon T, Wand SM, Sanders KM. Interstitial cells of cajal venerate electrical slow waves in the murine stomach[J]. J Phvsiol,1999,518 (1) : 257–269 |
| [12] | Thomsen L, Rohinson TL, Lee JC, et al. Interstitial cells of Cajal Generate a rhythmic pacemaker current[J]. Nat Med,1998,4 (7) : 848–851 |
| [13] | Kito Y, Ward SM, Sanders KM. Pacemaker potentials generated by interstitial cells of Cajal in the murine intestine[J]. Am J Physiol Cell Physio,2005,288 (3) : 710 |
| [14] | Ward SM, Dixon RE, Sanders KM, et al. Intimate relationship between interstitial cells of Cajal and enteric nerves in the guinea-pig small intestine[J]. Cell Tissue Res,1999,295 (2) : 247–256 |
| [15] | 胡晔东, 林琳, 张红杰, 等. 小鼠结肠Cajal间质细胞超微结构及其与肠神经的关系[J]. 南京医科大学学报,2005,25 (5) : 328–340 |
| [16] | Takaki M. Gut pacemaker cells:the interstitial cells of Cajal (ICC)[J]. J Smooth Muscle Res,2003,39 (5) : 137–161 |
| [17] | Wang XY, Hluizinga JD, Diamond J, et al. Loss of intramuscular and submuscular interstitial cells of Cajal and associated enteric nerves is related to decreased gastric emptying in streptozotocin-induczd diabetes[J]. Neurogastroenterol Motil,2009,21 (10) : 1095–1092 |
| [18] | Iino S, Horiguchi K. Interstitial cells of Cajal are involved in neurotransmission in the gastrointestinal tract[J]. Acta Histochem Cytochem,2006,39 (6) : 145–153 |
 2016, Vol. 33
2016, Vol. 33