文章信息
- 李兵
- LI Bing
- 丹参多酚酸盐对过氧化氢所致乳鼠心肌细胞凋亡的影响
- Effects of Salvianolate on neonatal rat cadiocytes apoptosis induced by H2O2
- 天津中医药, 2016, 33(8): 491-495
- Tianjin Journal of Traditional Chinese Medicine, 2016, 33(8): 491-495
- http://dx.doi.org/10.11656/j.issn.1672-1519.2016.08.12
-
文章历史
- 收稿日期: 2016-04-28
近年来,冠心病及其所引发的急性心肌梗死已经逐渐发展成为严重危害人类生命健康的主要疾病,目前临床上主要采取溶栓、介入手术等方法及时恢复血流供应,极大降低了心肌梗死患者的死亡率,但“再灌注损伤”并发症的存在严重影响着该类患者的愈后,史婷婷等[1]和刘艳霞等[2]均研究发现继发性心肌细胞凋亡是其重要的病理基础,丹参多酚酸是中药丹参的主要活性成分之一,能够通过改善抗氧化酶活性、降低氧化应激损伤以及抑制神经细胞凋亡而对脑缺血再灌注损伤大鼠起到保护作用[3];但丹参多酚酸是否对心肌缺血再灌注损伤后细胞凋亡具有抑制作用尚未见文献报道。本实验通过过氧化氢(H2O2)诱导制备乳鼠心肌细胞损伤模型,研究丹参多酚酸盐对H2O2所致乳鼠心肌细胞凋亡的影响及其作用机制。
1 材料和方法 1.1 药物与试剂丹参多酚酸盐(上海绿谷制药有限公司,规格:每瓶50 mg,批号:150307);DMEM培养基、胎牛血清购自美国Gibco公司;甲基四唑蓝(MTT)购自美国Sigma公司;谷草转氨酶(AST)、磷酸肌酸激酶(CPK)、乳酸脱氢酶(LDH)试剂盒购自深圳迈瑞生物医疗电子股份有限公司;AnnexinV-FITC细胞凋亡检测试剂盒购自上海时代生物科技有限公司;AKT、bcl-2、Bax上下游引物购自上海博亚生物公司;半胱氨酸天冬氨酸蛋白酶-3(caspase-3)、核转录因子-κB(NF-κB)单克隆抗体购自碧云天生物技术有限公司;超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)试剂盒购自北京博奥森生物技术有限公司。
1.2 动物清洁级雄性SD大鼠1~3 d乳鼠[4],购自河北省实验动物中心,许可证号:SCXK(冀)2013-1-003。
1.3 主要仪器VD-650-U型超净工作台(上海楚度仪器设备有限公司);MCO-175型CO2培养箱(日本三洋集团);UV-1800 PC型紫外-可见分光光度计(广州科晓科学仪器有限公司);BS-300型全自动生化分析仪(深圳迈瑞生物医疗电子股份有限公司);Model-680型酶标仪(美国BIO-RAD公司);FACS Aria型流式细胞仪(美国BD公司);DYY-11型多用电泳仪、JY-SCZ2电泳槽(北京六一仪器厂);RT-PCR仪(武汉新未来仪器技术有限公司)。
1.4 细胞的分离与培养参照李澎等[4]报道的实验方法分离和培养乳鼠心肌细胞,培养72 h后,将状态良好的原代乳鼠心肌细胞随机分为:空白对照组、H2O2组、丹参多酚酸盐(50、100和200 mg/L)+H2O2组,每组设8个复孔。经药物干预24 h后,检测细胞及其培养液中各指标。
1.5 培养液中AST、CPK、LDH含量的测定经药物干预24 h后,分别取各组细胞培养液并按照各试剂盒操作方法进行处理,然后通过全自动生化分析仪平行测定各组细胞培养液中AST、CPK、LDH含量。
1.6 细胞存活率的检测将细胞接种于96孔培养板(n=6),每孔加入20 μL MTT溶液(5 mg/mL),37 ℃孵育4 h后弃上清清,每孔加入150 μL二甲基亚砜(DMSO)振荡15 min后,通过酶标仪检测490 nm处OD值,计算细胞存活率:
细胞存活率(%)=(实验组OD值/空白对照组OD值)×100%
1.7 细胞凋亡状况检测及凋亡率计算经0.25%的胰酶消化后离心弃上清液,应用PBS溶液将冲洗2次后,按照细胞凋亡检测试剂盒操作方法步骤依次进行处理后通过Flow Cytometry检测,观察各组细胞凋亡状况并在流式二维图中计算凋亡率。
1.8 细胞中AKT mRNA、bcl-2mRNA、Bax mRNA表达的检测及bcl-2/Bax比值的计算1)查阅大鼠AKT、bcl-2、Bax、β-actin基因cDNA序列并通过Oligo软件设计上、下游引物,见表 1。2)常规消化后收集各组细胞,加入适量Trizol试剂提取总RNA并测定总RNA浓度,取1μg RNA反转录为cDNA,然后进行PCR反应,扩增完毕后,取PCR产物于琼脂糖凝胶电泳,通过凝胶成像仪观察并照相。3)以β-actin为内参,由灰度值进行半定量分析AKT mRNA、bcl-2mRNA、Bax mRNA表达,并计算bcl-2/Bax表达比值。
| 基因 | 引物 | 扩增片段长度(bp) | |
| AKT | 上游 | 5'-TTTATTGGCAGGGAACG-3' | 213 |
| 下游 | 5'-AGTCTGAATGGCGGTGGT-3' | ||
| bcl-2 | 上游 | 5'-GGGATGCCTTTGTGGAACTA-3' | 317 |
| 下游 | 5'-TGATTT GACCATTTGCCTGA-3' | ||
| Bax | 上游 | 5'-ATCCAGGATCGAGC | 282 |
| 下游 | 5'-AGATGGTCACTGTCTGCCATGTGGG-3' | ||
| β-actin | 上游 | 5'-CCTGTATGCCTCTGGTCGTA-3' | 432 |
| 下游 | 5'-CCATCTCTT GCTCGAAGTCT-3' | ||
取细胞并通过超声波细胞破碎仪冰浴中破碎后,经12 000 r/min低温离心10 min后取沉淀,经BCA法蛋白定量后,行变性、上样,经电泳、转膜、春红溶液染色后,室温下5%脱脂奶粉封闭2 h,一抗(caspase-3,NF-κB,β-actin)4 ℃过夜。洗膜,二抗室温摇床上孵育1 h后经ECL显色,实验结果应用Quantity One软件进行分析。
1.10 细胞中SOD、CAT活性和MDA含量的测定取1.9所制备的细胞裂解液,经低温离心取上清液,通过紫外-可见分光光度计平行测定各组细胞裂解液中SOD、CAT活性和MDA含量。
1.11 统计学方法运用软件SPSS 18.0进行统计分析,计量资料以均数±标准差(x±s)表示,组间均数比较采用单因素方差进行分析,组间两两比较若方差齐采用LSD法,若方差不齐采用Dunnett’t T3法,P < 0.05表示差异具有统计学意义。
2 结果 2.1 丹参多酚酸盐对H2O2损伤乳鼠心肌细胞培养液中AST、CPK、LDH含量的影响H2O2组细胞培养液中AST、CPK、LDH含量较空白对照组显著升高(P < 0.01)。与H2O2组比较,丹参多酚酸盐(100、200 mg/L)+H2O2组AST、CPK、LDH含量显著降低(P < 0.05或P < 0.01),结果见表 2。
| 组别 | 孔数 | AST(U/mL) | CPK(U/mL) | LDH(U/L) |
| 空白对照组 | 8 | 20.9±4.1 | 1.38±0.35 | 530.8±61.7 |
| H2O2组 | 8 | 34.2±6.5 | 2.64±0.55* | 914.5±102.4* |
| 丹参多酚酸盐(50mg/L)+H2O2组 | 8 | 30.9±7.0 | 2.41±0.63 | 868.7±110.5 |
| 丹参多酚酸盐(100 mg/L)+H2O2组 | 8 | 26.4±5.3# | 1.97±0.48## | 776.1±85.4# |
| 丹参多酚酸盐(200 ng/L)+H2O2组 | 8 | 23.1±5.6# | 1.62±0.39# | 652.7±70.9# |
| 注:与空白对照组比较,*P < 0.01;与H2O2组比较,#P < 0.05,##P < 0.01。 | ||||
H2O2组乳鼠心肌细胞存活率较空白对照组显著降低(P < 0.01)。与H2O2组比较,丹参多酚酸盐(100、200 mg/L)+H2O2组细胞存活率显著升高(P < 0.05或P < 0.01),结果见表 3。
| 组别 | 孔数 | 存活率(豫) | 凋亡率(%) |
| 空白对照组 | 8 | 97.1±4.2 | 4.5±1.8 |
| H2O2组 | 8 | 46.8±5.6* | 53.6±6.2* |
| 丹参多酚酸盐(50mg/L)+H2O2组 | 8 | 49.3±6.8 | 46.2±6.9 |
| 丹参多酚酸盐(100 mg/L)+H2O2组 | 8 | 67.5±9.4# | 37.0±5.4# |
| 丹参多酚酸盐(200 ng/L)+H2O2组 | 8 | 80.7±12.3# | 18.2±3.6# |
| 注:与空白对照组比较,*P < 0.01;与H2O2组比较,#P < 0.01。 | |||
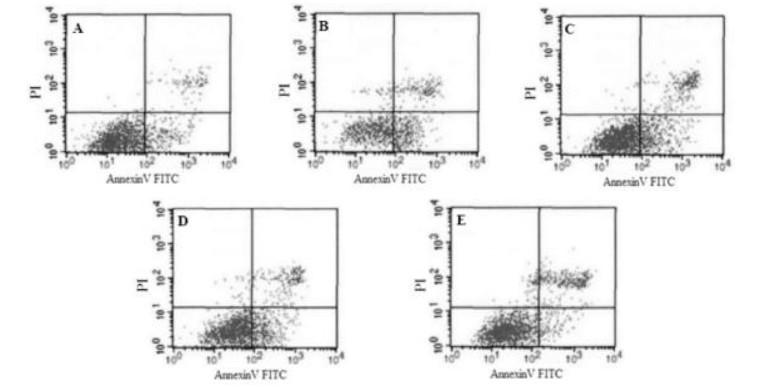
H2O2组细胞凋亡数量较空白对照组明显增多;而经丹参多酚酸盐干预24 h后,能够显著改善H2O2损伤乳鼠心肌细胞凋亡状况,以丹参多酚酸盐(200 mg/L)+H2O2组效果最为显著,见图 1。H2O2组细胞凋亡率较空白对照组显著增高(P < 0.01);与H2O2组比较,丹参多酚酸盐(100、200 mg/L)+H2O2组凋亡率显著降低(P < 0.01),结果见表 3。
|
| 图 1 各组细胞凋亡状况 Fig. 1 The cardiomyocytes apoptosis of cells in each group A-空白对照组;B-H2O2组;C-丹参多酚酸盐(50 mg/L)+H2O2组;D-丹参多酚酸盐(100 mg/L)+H2O2组;E-丹参多酚酸盐(200 mg/L)+H2O2组 |
H2O2组细胞AKT mRNA、bcl-2 mRNA、Bax mRNA表达较空白对照组均显著升高(P < 0.05,P < 0.01),bcl-2/Bax比值显著降低(P < 0.01);与H2O2组比较,丹参多酚酸盐(100、200 mg/L)+H2O2组AKT mRNA、bcl-2 mRNA表达显著升高而Bax mRNA表达显著降低(P < 0.05或P < 0.01),bcl-2/Bax比值显著升高(P < 0.01),结果见表 4。
| 组别 | 孔数 | AKT(×10-3) | bcl-2(×10-3) | Bax(×10-3) | bcl-2/Bax |
| 空白对照组 | 8 | 1.58±0.37 | 32.9±5.8 | 63.2±15.0 | 0.52±0.20 |
| H2O2组 | 8 | 1.99±0.52* | 44.2±7.6* | 109.7±24.3** | 0.39±0.18** |
| 丹参多酚酸盐(50mg/L)+H2O2组 | 8 | 2.17±0.68 | 48.1±9.3 | 100.5±26.8 | 0.48±0.25 |
| 丹参多酚酸盐(100mg/L)+H2O2组 | 8 | 2.60±0.81# | 56.0±10.4# | 91.7±23.4# | 0.61±0.24# |
| 丹参多酚酸盐(200mg/L)+H2O2组 | 8 | 2.93±0.85## | 64.7±11.2## | 76.9±18.2## | 0.85±0.37## |
| 注:与空白对照组比较,*P < 0.05,**P < 0.01;与H2O2组比较,#P < 0.05,##P < 0.01。 | |||||
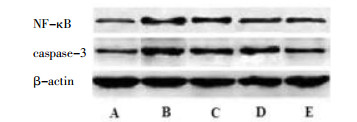
H2O2组乳鼠心肌细胞中NF-κB、caspase-3蛋白表达量显著增高(P < 0.01)。与H2O2组比较,丹参多酚酸盐(100、200 mg/L)+H2O2组NF-κB、caspase-3蛋白表达量均显著降低(P < 0.05或P < 0.01),结果见图 2和表 5。
|
| 图 2 各组细胞NF-κB、caspase-3蛋白表达 Fig. 2 The expression of NF-κB, caspase-3 protein of cells in each group A-空白对照组;B-H2O2组;C-丹参多酚酸盐(50mg/L)+H2O2组;D-丹参多酚酸盐(100 mg/L)+H2O2组;E-丹参多酚酸盐(200 mg/L)+H2O2组 |
| 组别 | 孔数 | NF-kB/β-actin | caspase-3/β-actin |
| 空白对照组 | 8 | 0.17±0.06 | 0.18±0.05 |
| H2o2组 | 8 | 0.45±0.12* | 0.63±0.12* |
| 丹参多酚酸盐(50mg/L)+H2O2组 | 8 | 0.37±0.11 | 0.52±0.16 |
| 丹参多酚酸盐(100g/L)+H2O2组 | 8 | 0.32±0.07# | 0.37±0.10## |
| 丹参多酚酸盐(200 mg/L)+H2O2组 | 8 | 0.25±0.07## | 0.29±0.11## |
| 注:与空白对照组比较:*P < 0.01;与H2O2组比较:#P < 0.05,##P < 0.01。 | |||
H2O2组乳鼠心肌细胞SOD、CAT活性较空白对照组显著降低且MDA含量显著升高(P < 0.01)。与H2O2组比较,丹参多酚酸盐(100、200 mg/L)+H2O2组SOD、CAT活性显著升高,MDA含量显著降低,差异均具有统计学意义(P < 0.05或P < 0.01),结果见表 6。
| 组别 | 孔数 | SOD(U/mg prot) | CAT(U/mg prot) | MDA(nmol/mg prot) |
| 空白对照组 | 8 | 114.5±13.7 | 32.3±7.0 | 7.1±1.6 |
| HA组 | 8 | 62.2±10.8* | 17.6±4.5* | 12.9±1.9* |
| 丹参多酚酸盐(50mg/L)+H2O2组 | 8 | 71.3±12.5 | 22.1±5.7 | 11.3±2.4 |
| 丹参多酚酸盐(100mg/L)+H2O2组 | 8 | 84.9±14.0# | 25.9±6.3## | 7.5±1.6# |
| 丹参多酚酸盐(200mg/L)+H2O2组 | 8 | 95.7±18.1## | 29.0±7.1## | 6.8±1.8## |
| 注:与空白对照组比较,*P < 0.01;与H2O2组比较,#P < 0.05,##P < 0.01。 | ||||
缺血再灌注损伤的病理机制非常复杂,其中细胞凋亡在其发生发展过程中发挥着重要作用。细胞凋亡是一种由多种基因参与调控的程序化死亡过程,其中AKT为抗凋亡基因,在细胞凋亡过程中发挥着重要的调控作用[5]。bcl-2为抑凋亡基因、Bax为促凋亡基因,它们都属于bcl-2基因家族,两者间相互作用、共同调控细胞凋亡过程[6]。并且Jayanthi S等[7]进一步研究发现,bcl-2和Bax对细胞凋亡的调控更依赖于bcl-2/Bax表达比值,bcl-2/Bax比值越低,往往凋亡状况越严重。Caspases蛋白家族参与细胞凋亡启动以及整个过程的调节,其中caspase-3被认为是各种凋亡刺激因子激活的关键蛋白酶[8]。
细胞凋亡是一种继发行为,氧化应激损伤是其最重要的诱发因素之一[9-10]。正常生理状态下,体内生成的氧自由基在SOD和CAT的依次催化作用下最终还原生成对人无害的H2O和O2[11-12],因此SOD、CAT的活性能够直接反应机体抗氧化能力;而血清中脂质过氧化终产物MDA的含量也能够间接反映细胞损伤程度。正常生理状态下,血清中心肌酶含量非常低,而当细胞膜受氧自由基攻击而受损后将导致细胞中心肌酶迅速释放入血,导致血清中AST、CPK、LDH活性陡然增高,因此血清中3者的活性水平能够敏感地反映心肌细胞受损程度,它们也是临床上监测心功能的常用指标。NF-κB为多效能核转录因子,被称为连接氧化应激损伤和细胞凋亡的“桥梁”[13]。生理状态下,NF-κB以无活性形式存在于胞质中,而当细胞受到ROS攻击时,NF-κB将被活化并暴露出核定位信号而进入胞核内,Angkeow P等[10]和Deshpande SS等[14]研究发现,氧化应激或氧自由基可直接或间接激活NF-κB;Zhang Q等[15]研究发现,活化NF-κB能够促进巨噬细胞活化和浸润,诱导促凋亡信号释放而导致细胞凋亡,证实NF-κB激活与氧化应激诱导的心肌细胞凋亡密切相关。
本实验通过过氧化氢诱导损伤乳鼠心肌细胞进行体外研究发现:与H2O2组比较,经丹参多酚酸盐干预24 h能够有效提高H2O2诱导损伤乳鼠心肌细胞存活率、降低细胞凋亡率、改善抗氧化酶活性、降低氧化应激损伤、上调抗凋亡基因AKT和bcl-2表达、下调促凋亡基因Bax基因表达、提高bcl-2/Bax表达比值、降低caspase-3和NF-κB蛋白表达;提示丹参多酚酸盐对H2O2所致乳鼠心肌细胞凋亡具有抑制作用,作用机制可能与其能够有效抑制氧化应激损伤、下调NF-κB蛋白表达以及调节凋亡相关基因和蛋白表达有关。
| [1] | 史婷婷, 白建平, 梁月琴, 等. 芹菜素对大鼠缺血/再灌注心肌细胞凋亡及相关蛋白Bcl-2、Bax、Caspase-3表达的影响[J]. 中国药理学通报,2011,27 (5) : 666–671 |
| [2] | 刘艳霞, 顾云, 辛毅, 等. 大鼠急性心肌缺血再灌注损伤诱导细胞凋亡的实验研究[J]. 心肺血管病杂志,2009,28 (3) : 191–194 |
| [3] | 王强, 张一, 李璐, 等. 丹参多酚酸盐对大鼠脑缺血再灌注过氧化损伤的保护作用[J]. 右江医学,2010,38 (6) : 665–667 |
| [4] | 李澎, 王建农, 卢树杰, 等. 山楂叶原花青素对乳鼠心肌细胞缺血再灌注损伤的保护作用[J]. 中国中药杂志,2009,34 (1) : 96–99 |
| [5] | 叶强, 陈良海, 刘应才, 等. 辛伐他汀通过Akt/GSK3β通路抑制心肌梗死后心肌细胞凋亡[J]. 中国药理学通报,2011,27 (12) : 1656–1660 |
| [6] | 张彦清, 刘保江, 田首元. 丙泊酚对大鼠离体缺血/再灌注心肌细胞凋亡和Bcl-2/Bax蛋白表达的影响[J]. 中西医结合心脑血管病杂志,2011,9 (1) : 55–57 |
| [7] | Jayanthi S, Deng X, Bordelon M, et al. Methamphetamine causes differential regulation of pro-death and anti-death Bcl-2 genes in the mouse neocortex[J]. FASEB J,2001,15 (10) : 1745–1752 |
| [8] | 毛德文, 陈月桥, 王丽, 等. Caspase-8及Caspase-3与细胞凋亡[J]. 辽宁中医药大学学报,2008,10 (10) : 148–150 |
| [9] | Angkeow P, Deshpande SS, Qi B, et al. Redoxfactor-1:an extra-nuclear role in the regulation of endothelial oxidative stress and apoptosis[J]. Cell Death Differ,2002,9 (7) : 717–725 |
| [10] | 陈良金, 石孟琼, 贺海波, 等. 珠子参总皂苷对H2O2诱导新生大鼠心肌细胞凋亡的抑制作用[J]. 中国临床药理学与治疗学,2012,17 (8) : 860–867 |
| [11] | Lartigue A, Burlat B, Coutard B, et al. The megavirus chilensis Cu, Zn-superoxide dismutase:the first viral structure of a typical CCS-independent hyperstable dimeric enzyme[J]. J Virol,2014,2588 (14) : 254–261 |
| [12] | Jin Y, Liu K, Peng J, et al. Rhizoma dioscoreae nipponicae polysaccharides protect HUVECs from H2O2-induced injury by regulating PPARγ factor and the NADPH oxidase/ROS-NF-κB signal pathway[J]. Toxicol Lett,2014,232 (1) : 149–158 |
| [13] | 杨帆, 王永青, 彭余江, 等. NF-κB在颅脑损伤后继发氧化应激及细胞凋亡之间的关系研究[J]. 浙江创伤外科,2014,19 (6) : 899–902 |
| [14] | Deshpande SS, Angkeow P, Huang J, et al. Rac1 inhibits TNF-alpha-induced endothelial cell apoptosis:dual regulation by reactive oxygen species[J]. FASB J,2000,14 (12) : 1705–1714 |
| [15] | Zhang Q, Huang WD, Lv XY, et al. Ghrelin protects H9c2 cells from hydrogen peroxide-induced apoptosis through NF-κB and mitochondria-mediated signaling[J]. Eur J Pharmacol,2011,654 (2) : 142–149 |
 2016, Vol. 33
2016, Vol. 33