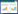文章信息
- 刘旭, 岳兴华, 郑燕萍
- LIU Xu, YUE Xin-hua, ZHENG Ya-ping
- 生理及病理状态下大鼠海马θ节律振荡与空间学习记忆的相关性研究
- The correlatation study between hippocampal cholinergic θ rhythm and spatial memory in rats under physiological and pathological conditions
- 天津中医药, 2016, 33(9): 549-554
- Tianjin Journal of traditional Chinese Medicine, 2016, 33(9): 549-554
- http://dx.doi.org/10.11656/j.issn.1672-1519.2016.09.11
-
文章历史
- 收稿日期: 2016-03-20
近年来,随着人口老龄化的进程加速,老年痴呆的发病率逐年升高,已成为继心脏病、肿瘤、中风后的第四大死亡病因。从历史研究看中医对该病认识及治疗的发展脉络清晰,中医虽没有关于老年痴呆病名的直接记载,但是综合其临床表现,属于中医痴呆、呆病、善忘等范畴。中医认为老年痴呆病位在脑,与肾、心、脾、肝等功能密切相关,其关键在于肾。多属本虚标实证,本虚主因在于肾精不足,髓海亏虚;标实在于肝气瘀滞所致痰浊与瘀血相互作用蒙蔽脑窍,令清空失灵神识迷蒙。因此在辨证施治中,主要以补益肾虚为主,辅以活血化瘀、同时重视疏肝解郁和化痰逐痰等。而中医药手段包括:针灸、电针等对阿尔茨海默病(AD)诊疗的实验研究就是中医治疗发展的前提,而实验研究的学习认知记忆动物模型的设立是之前一系列工作的基础。位于颞叶的大鼠海马体作为“空间认知地图”与空间记忆、情景记忆密切相关,诸如AD等具有海马损伤的神经病变常表现有空间学习记忆功能障碍。依据“淀粉样β蛋白级联假说”,AD患者海马的损伤极可能是由具有神经毒性的淀粉样β蛋白(Aβ)在海马中异常沉积所致[1]。大量相关实验也证实,在淀粉样β蛋白前体蛋白(APP)转基因小鼠模型[2]及Aβ注射的啮齿动物模型[3]中,均存在与AD相关表现,包括老年斑沉积、神经炎性反应、神经网络同步化活动异常、突触可塑性减低及学习记忆功能减退等[4]。
海马对空间记忆的编码主要依赖一种频率在3~12 Hz的神经网络同步化振荡活动,即“θ节律振荡”。研究发现大鼠在不同的行为状态下可表现出两种不同频率的θ节律振荡—胆碱能θ节律振荡(cholinergic theta rhythm)与非胆碱能θ节律振荡(noncholinergic theta rhythm)。当大鼠处于警觉性静止状态、乌拉坦麻醉状态或被动全身旋转状态时,可记录到频率在3~7 Hz的θ节律振荡,这种θ节律振荡可被阿托品所压抑,为胆碱能θ节律振荡;当实验动物处于跑动、行走、攀爬等主观运动状态时,可记录到频率在7~12 Hz的θ节律振荡,这种θ节律振荡不受阿托品影响,为非胆碱能θ节律振荡[5]。另具研究表明,海马非胆碱能θ节律振荡通过与gamma节律振荡(30~100 Hz)嵌套生成更为复杂的神经网络同步化电活动直接参与了空间学习记忆的编码及突触可塑性的调节[6]。除此之外,笔者之前的一项相关实验研究也表明海马损伤可导致胆碱能θ节律振荡的压抑及空间学习记忆能力的损伤,初步提示胆碱能θ节律振荡与空间学习记忆也可能存在一定的相关性[7]。故本研究旨在通过自身相关比较实验进一步探讨证明生理及病理两种不同状态下,大鼠海马胆碱能θ节律振荡活动与空间学习记忆能力的相关性,为胆碱能θ节律振荡活动作为评估实验动物空间学习记忆能力的电生理指标提供实验依据。
1 材料与方法 1.1 材料实验动物随机选择运动能力及视觉正常的成年健康雄性SD大鼠(体质量180~200 g,由山西医科大学实验动物中心提供)。全长淀粉样β蛋白(Aβ1-42)购自美国Abcam公司,使用微量二甲基亚砜(DMSO)将其充分溶解并加生理盐水稀释至最终浓度2.5 g/L,37 ℃孵育36 h,孵育期间保持间断性振荡,使其最终老化成寡聚体。溶剂中DMSO终浓度低于0.1%,经证实为生理无效浓度[8],对学习记忆及神经网络活动均无影响。
1.2 方法 1.2.1 手术依据随机数表将20只SD大鼠分成两组:正常对照组(双侧海马注射溶剂)与Aβ海马注射组(双侧海马注射Aβ1-42)。大鼠注射水合氯醛(0.3 g/kg,i.p)进行麻醉后,使用双臂数显脑立体定位仪(RWD68004,RWD Life Science,China)加以固定,碘伏消毒备皮后切开头部皮肤以暴露头骨,依据大鼠脑立体图谱确定给药点并使用骨钻钻孔,借助微量给药泵(KDS 310 Plus,KDS scientific,USA)将溶剂(2 μL)或药物(Aβ1-42,2 μL)缓慢推注至大鼠双侧海马CA1区(前囟后3.0 mm,旁开2.2 mm,深度3.0 mm,注射速度为0.15 μL/min),注射后留针5 min以保证药物的充分扩散并防止虹吸。使用骨蜡封闭颅骨注射孔并进行手术缝合。术后置于温箱中待其苏醒。术后恢复2周后进行后续的行为学及电生理实验。
1.2.2 Morris水迷宫测试Morris水迷宫测试是评估海马结构相关空间学习记忆能力的经典行为学实验[9]。宫体由一个圆形金属水池(直径150 cm,高50 cm)及一个圆形逃避平台(直径14 cm,高30 cm)构成。宫体内部被漆成黑色并均匀划分为4个象限,通过帘布将宫体与外界环境隔离,并在整个实验过程中保障行为学实验室的安静,以避免外界环境因素对实验结果造成干扰。帘布内侧贴有与4个象限相对应的颜色形状各异的视觉标识。实验过程中宫体水温保持在(23±2) ℃。
1.2.2.1 定位航行实验定位航行实验为测试的1~5 d,用以对大鼠的空间学习能力加以评估。在本实验阶段,黑色逃避平台藏匿于水面以下1~2 cm处,固定放置于第一象限中心。每天分4次将大鼠从各个象限的中点投入到宫体中,投放象限的顺序由随机数表产生。出于逃生的本能,大鼠会在宫体内做逃避式游泳直至找到平台,大鼠从入水到找到平台的时间为逃避潜伏期。大鼠找到平台后允许在平台上休息15 s。如若大鼠未能在120 s内找到平台,需诱导至平台上并停留15 s。通过行为学记录分析系统(Ethovision 3.0,Noldus Information Technology,Wageningen,the Netherlands)捕捉记录大鼠的游泳轨迹及逃避潜伏期用于分析。
1.2.2.2 空间探索实验定位航行实验结束后(第6天)进行空间探索实验,用于检测实验动物的空间记忆能力。在该实验阶段,需移除逃避平台,大鼠分4次随机从其中一个象限的中点投入宫体中,自由游泳120 s,通过行为学记录分析系统记录大鼠在120 s内的游泳轨迹及在目标象限(第一象限)的游泳时间百分比。
1.2.2.3 可见平台实验空间探索实验4 h后,进行可见平台实验,用以排除大鼠视力及运动能力对实验结果的干扰。在该实验阶段,将白色逃避平台放入第一象限的中心位置,并高出水面1~2 cm以使其可见。大鼠分4次随机从其中一个象限的中点投入宫体中,通过行为学记录分析系统记录大鼠到达可见平台的逃避潜伏期及游泳速度。
1.3 在体海马局部场电位胆碱能θ节律振荡的诱导记录Morris水迷宫测试后,进行海马胆碱能θ节律振荡的诱导及记录。大鼠经乌拉坦(1.3 g/kg,i.p)充分麻醉后固定于双臂数显脑立体定位仪上,体温通过反馈调节温控装置(Temperature controller 69000,RWD,China)控制在(37±0.5) ℃。消毒备皮并切开颅部皮肤暴露颅骨,依据大鼠脑立体定位图谱在颅骨上钻孔(前囟后3.4 mm,中线旁开2.5 mm),利用微推进器 (MO-10,Narishige,Japan)将环氧绝缘固化微电极(A-M systerm,5 MΩ)下至海马CA1区(皮质表面下2.2 mm左右)。局部场电位信号通过前置放大器放大后,经由光缆导入到生物电信号处理放大工作站中(RX7 workstation,TDT,USA),实验中采样频率设置为500 Hz,滤波参数设置为带通0.1~250 Hz,待波形稳定后,记录基础局部场电位2 min,随后给予固定强度的夹尾刺激1 min以诱导θ节律振荡,记录刺激后的局部场电位10 min,选择夹尾后6~8 min的信号进行分析。整个实验结束后,大鼠通过注射过量乌拉坦行安乐死。
1.4 统计学处理Morris水迷宫实验采用定位航行实验5 d内大鼠找到水下平台的逃避潜伏期、空间探索实验中大鼠在目标象限的游泳时间百分比、可见平台实验中大鼠找到可见平台的逃避潜伏期及游泳速度。在体海马局部场电位胆碱能θ节律振荡分析其功率峰值(Ppeak)及其对应的频率值(Fpeak),使用Matlab 7.7进行数据处理。结果以均数±标准差(x±s)表示,采用SPSS 18.0进行分析统计,组间比较用t检验进行分析,其他数据采用正态性检验和两样本Pearson相关性分析,以P<0.05为差异有统计学意义。
2 结果 2.1 双侧海马注射Aβ1-42损伤大鼠空间学习记忆能力如表 1所示,定位航行实验的2~5 d,Aβ海马注射组大鼠找到水下逃避平台的潜伏期明显长于正常对照组(P<0.05,表 1);在第6天的空间探索实验中,Aβ海马注射组大鼠在目标象限游泳时间百分比明显少于正常对照组(P<0.05,表 2);而在可见平台实验中,两组大鼠到达可见平台的逃避潜伏期及平均游泳速度均无显著差异(P>0.05,表 3)。
| 组别 | 动物数 | 定位航行实验逃避潜伏期(s) | ||||
| 第1天 | 第2天 | 第3天 | 第4天 | 第5天 | ||
| 对照组 | 10 | 81.31±8.15 | 44.11±3.96 | 32.68±2.42 | 28.41±2.37 | 27.52±1.42 |
| Aβ注射组 | 10 | 100.5±5.15 | 76.45±7.04a | 47.78±3.71a | 41.52±1.80a | 40.99±2.01a |
| 注:与对照组相比,aP<0.05。 | ||||||
| 组别 | 动物数 | 空间探索实验目标象限游泳时间百分比(%) |
| 对照组 | 10 | 42.42±1.54 |
| Aβ注射组 | 10 | 28.57±2.07a |
| 注:与对照组相比,aP<0.05。 | ||
| 组别 | 动物数 | 可见平台逃避潜伏期(s) | 平均游泳速度(m/s) |
| 对照组 | 10 | 12.58±0.64 | 20.08±0.79 |
| Aβ注射组 | 10 | 12.47±0.58 | 21.56±0.88 |
如表 4所示,对两组大鼠θ频率段的功率峰值(Ppeak) 以及与其对应的频率值(Fpeak)进行了比较。Aβ海马注射组大鼠θ节律振荡Ppeak明显低于正常对照组(P<0.001);而两组大鼠鼠θ节律振荡Fpeak无显著差异(P>0.05)。
| 组别 | 动物数 | θ节律振荡功率峰值 | θ节律振荡频率 |
| 对照组 | 10 | 29.92±1.11 | 3.26±0.04 |
| Aβ注射组 | 10 | 21.97±0.67a | 3.18±0.06 |
| 注:与对照组相比,aP<0.05。 | |||
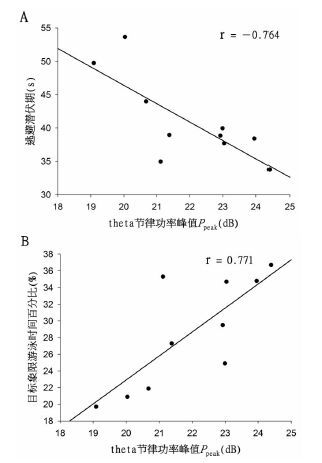
首先,对正常对照组大鼠海马胆碱能θ节律振荡的功率峰值Ppeak与其在定位航行实验中的逃避潜伏期(第5天)进行了相关性分析。如图 1A所示,Ppeak与大鼠逃避潜伏期存在明显的负相关性,Pearson相关系数r=-0.803 (P<0.05)。继而对正常对照组大鼠海马θ节律振荡的功率峰值Ppeak与其在空间探索实验中目标象限游泳实验百分比进行了相关性分析,如图 1B所示,Ppeak与大鼠在目标象限的游泳实验百分比呈明显的正相关性,Pearson相关系数r=0.762(P<0.05)。

|
| 图 1 对照组大鼠逃避潜伏期、目标象限游泳时间百分比与θ节律振荡峰值的相关性 Fig. 1 The correlation between the Ppeak of hippocampal cholinergic θ rhythm and escape latency and swimming time percentage in rats of control group A.对照组大鼠定位航行实验中逃避潜伏期与θ节律振荡峰值的呈负相关;B.对照组大鼠空间探索实验中目标象限游泳时间百分比与θ节律振荡峰值的呈正相关。 |
与对照组相对应,对Aβ海马注射组大鼠海马θ节律振荡的功率峰值Ppeak与其在定位航行实验中的逃避潜伏期(第5天)进行的相关性分析(图 2A)显示,Ppeak与大鼠逃避潜伏期存在明显的负相关性,Pearson相关系数r=-0.764(P<0.05)。对Aβ海马注射组大鼠海马θ节律振荡的功率峰值Ppeak与其在空间探索实验中目标象限游泳实验百分比进行的相关性分析(图 2B)显示,Ppeak与大鼠在目标象限的游泳实验百分比呈明显的正相关性,Pearson相关系数r=0.771 (P<0.01)。
|
| 图 2 Aβ海马注射组大鼠逃避潜伏期、目标象限游泳时间百分比与θ节律振荡峰值的相关性 Fig. 2 The correlation between the Ppeak of hippocampal cholinergic θ rhythm and escape latency and swimming time percentage in rats in the intrahippocampal injection of Aβ group A.Aβ海马注射组大鼠定位航行实验中逃避潜伏期与θ节律振荡峰值的呈负相关;B. Aβ海马注射组大鼠空间探索实验中目标象限游泳时间百分比与θ节律振荡峰值的呈正相关。 |
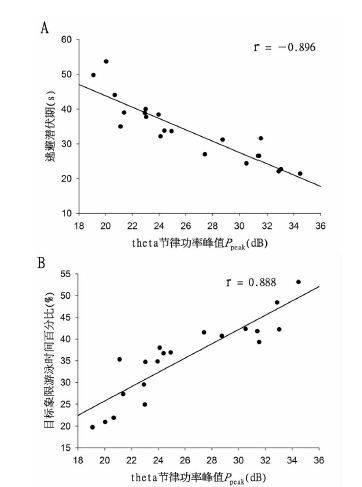
通过对合并后的两组数据进行相关分析发现,在θ节律振荡的功率峰值Ppeak和定位航行实验逃避潜伏期相关分析图(图 3A)中,大鼠的Ppeak幅度与逃避潜伏期、目标象限游泳时间百分比存在更明显的相关性,Pearson相关系数分别为r=-0.896(P<0.01)和r=0.888(P<0.01)。
|
| 图 3 两组大鼠逃避潜伏期、目标象限游泳时间百分比与θ节律振荡峰值相关性的整合分析 Fig. 3 The integrated analysis of correlation between the Ppeak of hippocampal cholinergic θ rhythm and escape latency and swimming time percentage in rats in two groups A.两组大鼠定位航行实验中逃避潜伏期与θ节律振荡峰值的呈负相关;B.两组大鼠空间探索实验中目标象限游泳时间百分比与θ节律振荡峰值的呈正相关。 |
海马θ节律振荡作为海马结构的主导性神经网络同步化活动,在情绪、动机、学习记忆等多种高级认知功能中起着决定性作用[10-11]。大量研究表明,非胆碱能θ节律振荡在海马位置细胞编码空间地图的过程中起着重要作用。位置细胞(place cells)在其位置野内的动作电位发放时刻相对于θ节律振荡的相位具有进动特性—θ相移,θ相移可将大鼠单次经历的一系列位置场按顺序进行压缩后,在每个θ周期中重复一次,这样在这一运动过程中,代表每个位置场的神经元动作电位发放便可多次重复出现,形成间隔约为10 ms(频率约100 Hz)的序列,而10 ms的间隔正处于最适合增加突触强度的时间尺度上,而突触强度的改变正是学习记忆行为的电生理学基础[12]。因此,非胆碱能θ节律振荡能够通过增强突触强度从而促进空间记忆的形成。Vincent Villette等也通过实验证实,海马注射Aβ压抑了非胆碱能θ节律振荡并损伤了自发性视觉空间识别测试中的学习记忆行为[13]。相对于非胆碱能θ节律振荡,海马胆碱能θ节律振荡由于出现在动物警觉不动、异相睡眠[14]或是乌拉坦麻醉状态下,而非存在于主观性的自发性神经活动中,因此,对海马胆碱能θ节律振荡与学习记忆的相关性尚缺乏足够的研究。
本研究通过自身相关比较实验发现海马局部注射Aβ1-42寡聚体造成大鼠Morris水迷宫空间学习记忆行为障碍和海马胆碱能θ节律振荡功率压抑,更重要的是我们还证实了无论是在正常大鼠还是在海马损伤的大鼠中,其空间学习能力及记忆能力均与海马胆碱能θ节律振荡呈良好的相关性。
胆碱能θ节律振荡多出现在实验动物警觉不动及异相睡眠过程中,而异相睡眠对记忆的巩固起着重要的作用,许多AD转基因动物模型的学习记忆功能障碍可能与其异相睡眠减少[15]及θ节律振荡减低有关[2, 16]。在异相睡眠阶段,包括胆碱能θ节律振荡在内的海马θ节律振荡活动可能对新近记忆的再加工及巩固(off-line reprocessing of recently acquired memories)起着一定的作用[17-18]。本研究提示:胆碱能θ节律振荡功率较高的大鼠其对记忆的加工巩固较好,故在空间学习记忆能力测试中有更为突出的表现;相反,海马注射Aβ1-42导致海马胆碱能θ节律振荡的压抑,故在异相睡眠阶段不能有效的巩固行为测试中形成的空间记忆,而在后续的学习记忆能力测试中表现较差。
另外,本研究还为海马胆碱能θ节律振荡活动作为评估大鼠空间学习记忆能力的电生理指标提供实验依据。使用同一批实验动物,在行为学测试后开展海马胆碱能θ节律振荡的记录一方面可以从行为学及神经网络电生理两个角度阐述分析问题,另一方面也大大减少了实验动物的使用数量,更符合实验动物伦理学的原则。
当然,本实验未能直接监测大鼠在警觉性静止及异相睡眠状态下的海马胆碱能θ节律振荡,而是在乌拉坦麻醉的状态下借助感觉刺激诱导胆碱能θ节律振荡来评估生理状态下大鼠产生胆碱能θ节律振荡,尚不属于真正意义的行为学电生理实验。如果能够监测Morris水迷宫行为学测试及异相睡眠过程中海马胆碱能θ节律振荡及非胆碱能θ节律振荡,可能能够更加直接的阐述两种θ节律振荡对空间学习记忆活动的影响。行为学电生理实验是目前研究行为学脑机制的一个前沿的、重要的研究领域,也是本实验室正在着手准备开展的研究方向。可以肯定的说,借助更有力的行为学电生理手段,能够更直观、更全面、更严谨地探究脑的高级神经功能的机制及诸如AD等神经系统疾病的机制;为包括使用电针等手段通过增强氧自由基清除系统的功能,提高机体抗氧化能力实现对AD患者改善性治疗研究(电针治疗方案可能为临床最佳治疗方案)的基础实验筛选提供最佳行为、认知、记忆动物模型。
| [1] | Ferreira ST, Klein WL. The Abeta oligomer hypothesis for synapse failure and memory loss in Alzheimer's disease[J]. Neurobiol Learn Mem, 2011, 96 (4) : 529–543. DOI:10.1016/j.nlm.2011.08.003 |
| [2] | Scott L, Feng J, Kiss T, et al. Age-dependent disruption in hippocampal theta oscillation in amyloid-beta overproducing transgenic mice[J]. Neurobiol Aging, 2012, 33 (7) : 1413–1423. |
| [3] | Epelbaum S, Youssef I, Lacor PN, et al. Acute amnestic encephalopathy in amyloid-beta oligomer-injected mice is due to their widespread diffusion in vivo[J]. Neurobiol Aging, 2015, 36 (6) : 2043–2052. DOI:10.1016/j.neurobiolaging.2015.03.005 |
| [4] | Mucke L, Selkoe DJ. Neurotoxicity of amyloid beta-protein: synaptic and network dysfunction[J]. Cold Spring Harb Perspect Med, 2012, 2 (7) : a006338. |
| [5] | Shin J, Gireesh G, Kim SW, et al. Phospholipase C beta 4 in the medial septum controls cholinergic theta oscillations and anxiety behaviors[J]. J Neurosci, 2009, 29 (49) : 15375–15385. DOI:10.1523/JNEUROSCI.3126-09.2009 |
| [6] | Yamaguchi Y. A theory of hippocampal memory based on theta phase precession[J]. Biol Cybern, 2003, 89 (1) : 1–9. |
| [7] | Yue XH, Liu XJ, Wu MN, et al. [Amyloid beta protein suppresses hippocampal theta rhythm and induces behavioral disinhibition and spatial memory deficit in rats][J]. Sheng Li Xue Bao, 2014, 66 (2) : 97–106. |
| [8] | Leung LS, Shen B. Glutamatergic synaptic transmission participates in generating the hippocampal EEG[J]. Hippocampus, 2004, 14 (4) : 510–525. DOI:10.1002/(ISSN)1098-1063 |
| [9] | Morris R. Developments of a water-maze procedure for studying spatial learning in the rat[J]. J Neurosci Methods, 1984, 11 (1) : 47–60. DOI:10.1016/0165-0270(84)90007-4 |
| [10] | Jutras MJ, Buffalo EA. Synchronous neural activity and memory formation[J]. Curr Opin Neurobiol, 2010, 20 (2) : 150–155. DOI:10.1016/j.conb.2010.02.006 |
| [11] | Cornwell BR, Johnson LL, Holroyd T, et al. Human hippocampal and parahippocampal theta during goal-directed spatial navigation predicts performance on a virtual Morris water maze[J]. J Neurosci, 2008, 28 (23) : 5983–5990. DOI:10.1523/JNEUROSCI.5001-07.2008 |
| [12] | 沈恩华, 王如彬, 张志康. θ相移在单次学习过程中促进神经网络对空间位置顺序记忆的研究[J]. 动力学与控制学报, 2009, 7 (2) : 183–187. |
| [13] | Villette V, Poindessous-Jazat F, Simon A, et al. Decreased rhythmic GABAergic septal activity and memory-associated theta oscillations after hippocampal amyloid-beta pathology in the rat[J]. J Neurosci, 2010, 30 (33) : 10991–11003. DOI:10.1523/JNEUROSCI.6284-09.2010 |
| [14] | Robinson TE, Kramis RC, Vanderwolf CH. Two types of cerebral activation during active sleep: relations to behavior[J]. Brain Res, 1977, 124 (3) : 544–549. DOI:10.1016/0006-8993(77)90954-4 |
| [15] | Zhang B, Veasey SC, Wood MA, et al. Impaired rapid eye movement sleep in the Tg2576 APP murine model of Alzheimer's disease with injury to pedunculopontine cholinergic neurons[J]. Am J Pathol, 2005, 167 (5) : 1361–1369. DOI:10.1016/S0002-9440(10)61223-0 |
| [16] | Rubio SE, Vega-Flores G, Martinez A, et al. Accelerated aging of the GABAergic septohippocampal pathway and decreased hippocampal rhythms in a mouse model of Alzheimer's disease[J]. FASEB J, 2012, 26 (11) : 4458–4467. DOI:10.1096/fj.12-208413 |
| [17] | Pace-Schott EF, Spencer RM. Sleep-dependent memory consolidation in healthy aging and mild cognitive impairment[J]. Curr Top Behav Neurosci, 2015, 25 : 307–330. |
| [18] | Fogel SM, Smith CT, Beninger RJ. Evidence for 2-stage models of sleep and memory: learning-dependent changes in spindles and theta in rats[J]. Brain Res Bull, 2009, 79 (6) : 445–451. DOI:10.1016/j.brainresbull.2009.03.002 |
 2016, Vol. 33
2016, Vol. 33