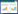文章信息
- 杨龙, 杨帆, 杨欣莹, 张蕾, 于卉娟, 王跃飞
- YANG Long, YANG Fan, YANG Xin-ying, ZHANG Lei, YU Hui-juan, WANG Yue-fei
- 血府逐瘀汤不同剂型数字化指纹图谱的构建*
- The establishment of UPLC-Digitized fingerprinting of multiple dosage forms of Xuefu Zhuyu decoction
- 天津中医药, 2016, 33(9): 559-564
- Tianjin Journal of traditional Chinese Medicine, 2016, 33(9): 559-564
- http://dx.doi.org/10.11656/j.issn.1672-1519.2016.09.13
-
文章历史
- 收稿日期: 2016-03-30
2. 天津国际生物医药联合研究院中药新药研发中心, 天津 300457;
3. 天津宏仁堂药业有限公司, 天津 300385
血府逐瘀汤源自清代医学家王清任的《医林改错》,由当归、生地、桃仁、枳壳、牛膝、赤芍、柴胡、甘草、川芎、桔梗、红花11味药组成[1],是桃红四物汤、四逆散(熟地黄换成生地,白芍换成赤芍)加桔梗、牛膝的变通方[2],具有活血化瘀,行气止痛功效[3],广泛用于治疗内外妇儿各科疑难病证属血瘀气滞证者,多用于心血管疾病包括冠心病[4]、心绞痛[5]等的治疗。血府逐瘀汤作为经典名方,临床疗效确切,基于血府逐瘀汤研究开发了多个现代制剂,包括血府逐瘀片、口服液、胶囊、软胶囊等多种剂型。血府逐瘀汤[6-8]中含有机酸(没食子酸等)、黄酮(羟基红花黄色素A、柚皮苷等)、皂苷(甘草酸等)、环烯醚萜类(芍药苷、芍药内酯苷等)和其他成分,化学物质群复杂,给血府逐瘀汤不同制剂的质量控制带来挑战。
目前研究建立的质量控制方法多以单一成分作为检测指标,不能全面真实的反映血府逐瘀汤的内在质量。指纹图谱是一种国内外公认的综合的、可量化的鉴别手段[9-11],能够有效地体现中药成分的整体性,更好地评价中药的质量[12-13]。血府逐瘀汤已被开发成多个剂型,目前血府逐瘀汤的指纹图谱研究多限于单个制剂,未阐明指纹峰的化学结构。本课题组对血府逐瘀汤多种剂型开展了深入研究,采用超高效液相色谱-电喷雾串联三重四极杆质谱(UPLC-ESI-MS/MS)对血府逐瘀汤及其多种剂型的化学成分进行了定量分析,采用超高效液相色谱-电喷雾串联四极杆飞行时间质谱(UPLC-DAD/ESI-Q-TOF MS)对血府逐瘀汤的化学成分进行定性分析,检测并鉴定了103个化学成分[14-15]。在此基础上,本研究开展了血府逐瘀汤不同剂型的指纹图谱研究。
本研究建立的指纹图谱分析方法时间仅为35 min,以野漆树苷为参照峰,建立了5个不同剂型的UPLC指纹图谱,共标定了30个共有峰。采用标准品比对的方法鉴定了绿原酸、羟基红花黄色素A、芍药内酯苷、芍药苷、甘草苷、柚皮苷、野漆树苷、橙皮苷、新橙皮苷、柚皮素等16个共有峰。该方法具有全面、快速、可靠的优点,通过该方法可获得全面的指纹图谱信息,为血府逐瘀汤不同剂型质量控制研究提供依据。
1 材料 1.1 仪器ACQUITY超高效液相色谱仪(美国Waters公司,包括Waters ACQUITY二元泵,DAD检测器,自动进样器,在线脱气机,柱温箱,Empower色谱工作站);超纯水仪(Milli-Q,美国Millipore公司);Vortex-5涡旋振荡器(海门市其林贝尔仪器制造有限公司);J25低温高速离心机(美国Thermo Forma公司);十万分之一天平(METTLER TOLEDO XS205,瑞士METTLER公司);万分之一天平(METTLER TOLEDO AL204,瑞士METTLER公司);SCIENTZ SB 25-12DTN超声波清洗机(宁波新芝生物科技股份有限公司);JSP-200粉粹机(浙江永康金穗机械制造厂)。
1.2 药品与试剂样品:血府逐瘀胶囊:TJHRT,批号:E03051、E03052、E03053、E03054、E03055、E03056、E03057、E03058、E03059、E03060、E03061、E03062、E03063。
血府逐瘀片:SXHT,批号:140903、150301;WFZS,批号:141111、150102;CQXEA,批号为140414、140416、141204、150101、150102、150103、150104、150105、150106、150201。
血府逐瘀口服液:JLADYB,批号:1407001、1407024、1408010、1408011、1408017、1412028、1412030、1501013、1501014;SDHJT,批号:1312001、1403007。
血府逐瘀软胶囊:JLHNSH,批号:20140302、20140701、20140903、20141102、20150102、20150206、20150301、20150304、20150401、20150402。
血府逐瘀汤:实验室自制。
标准品:芍药苷(RS0453)、野漆树苷(THB-TS40S)、芍药内酯苷(RS0042)、柚皮素(THB-2S340)、竹节参皂苷IVa(THB-1S375)购自于天津拓海生物科技有限公司;柚皮苷(110722-200610)、没食子酸(110831-200803)、甘草苷(111610-201106)、甘草酸(110731-201317)购自中国食品药品检定研究院;绿原酸(WOZ-4-2)、蜕皮甾醇、甘草素、橙皮苷、新橙皮苷、山奈酚(纯度均≥98%)购自天津中新药业研究中心;羟基红花黄色素A(Q-008-14073)购自成都瑞芬思生物科技有限公司。
乙腈(Sigma-Aldrich公司,色谱纯),甲酸(天津市大茂化学试剂厂,分析纯),水为超纯水,其余试剂均为分析纯。
2 方法 2.1 溶液的配制 2.1.1 对照品溶液的制备取芍药苷、野漆树苷、芍药内酯苷、柚皮素、甘草素、竹节参皂苷IVa、柚皮苷、没食子酸、甘草苷、甘草酸、绿原酸、蜕皮甾醇、橙皮苷、新橙皮苷、山奈酚、羟基红花黄色素A对照品适量,精密称定,分别加入50%甲醇水溶液,即得到浓度分别为:芍药苷(0.93 g/L)、野漆树苷(1.52 g/L)、芍药内酯苷(1.53 g/L)、柚皮素(1.09 g/L)、甘草素(1.12 g/L)、竹节参皂苷IVa(1.27 g/L)、柚皮苷(0.92 g/L)、没食子酸(1.17 g/L)、甘草苷(1.02 g/L)、甘草酸(0.98 g/L)、绿原酸(1.37 g/L)、蜕皮甾醇(1.18 g/L)、橙皮苷(0.87 g/L)、新橙皮苷(0.61 g/L)、山奈酚(0.69 g/L)、羟基红花黄色素A(1.27 g/L)的对照品储备液。取各对照品储备液100 μL,置于2 mL棕色量瓶中,加入50%甲醇水溶液定容至刻度,摇匀,制成浓度分别为:芍药苷(0.047 g/L)、野漆树苷(0.076 g/L)、芍药内酯苷(0.077 g/L)、柚皮素(0.055 g/L)、甘草素(0.056 g/L)、竹节参皂苷IVa(0.064 g/L)、柚皮苷(0.046 g/L)、没食子酸(0.059 g/L)、甘草苷(0.051 g/L)、甘草酸(0.049 g/L)、绿原酸(0.069 g/L)、蜕皮甾醇(0.059 g/L)、橙皮苷(0.044 g/L)、新橙皮苷(0.031 g/L)、山奈酚(0.035 g/L)、羟基红花黄色素A(0.064 g/L)的混合对照品溶液。
2.1.2 供试品溶液的制备血府逐瘀胶囊和软胶囊的内容物、片剂、汤剂粉末适量,研细,分别取上述样品0.5 g,精密称定,置于25 mL棕色量瓶中,加入50%甲醇水溶液适量,超声20 min,取出,放凉,加入50%甲醇水溶液定容至刻度,摇匀,置1.5 mL EP管中14 000 r/min离心10 min,取上清液,即可。
精密量取血府逐瘀口服液1 mL,置于25 mL棕色量瓶中,加入50%甲醇水溶液定容至刻度,摇匀,置1.5 mL EP管中14 000 r/min离心10 min,取上清液,即可。
2.2 UPLC色谱条件色谱柱ACQUITY UPLC BEH C18(2.1 mm×100 mm,1.7 μm);以0.1%甲酸水溶液为流动相A,乙腈为流动相B,进行梯度洗脱:0~8 min,3%~8% B;8~24 min,8%~19% B;24~35 min,19%~45% B。检测波长:280 nm,柱温:50 ℃,流速:0.3 mL/min,进样2 μL,记录35 min色谱图。
3 方法学考察 3.1 精密度实验取血府逐瘀汤粉末,按照“2.1.2项”下方法制备供试品溶液,按照“2.2项”下色谱条件进样,连续进样6次,记录色谱图,以21号峰野漆树苷为参照峰,计算各个峰的相对保留时间和相对峰面积。结果表明,峰面积占总峰面积大于3%的色谱峰的相对峰面积和各共有峰的相对保留时间基本一致(RSD<1.68%),表明仪器精密度良好。
3.2 重现性实验取血府逐瘀汤粉末,按照“2.1.2项”下方法制备供试品溶液6份,按照“2.2项”下色谱条件进样,记录色谱图,以21号峰野漆树苷为参照峰,计算各个峰的相对保留时间和相对峰面积。结果表明,峰面积占总峰面积大于3%的色谱峰的相对峰面积和各共有峰的相对保留时间基本一致(RSD<1.49%),表明该方法重现性良好。
3.3 稳定性实验取血府逐瘀汤粉末,按照“2.1.2项”下方法制备供试品溶液,按照“2.2项”下色谱条件进样,在4 ℃条件下分别于0、2、4、6、8、10 h进行测定,记录色谱图,以21号峰野漆树苷为参照峰,计算各个峰的相对保留时间和相对峰面积。结果表明,峰面积占总峰面积大于3%的色谱峰的相对峰面积和各共有峰的相对保留时间基本一致(RSD <2.88%),表明血府逐瘀汤在10 h内稳定。
3.4 延迟测试取血府逐瘀汤粉末,按照“2.1.2项”下方法制备供试品溶液,按照“2.2项”下色谱条件进样,测定,延长测试时间至1 h,观察有无滞后峰出现。结果表明:无滞后峰出现,结果见图 1。
|
| 图 1 280 nm下血府逐瘀汤指纹图谱延迟测试色谱图 Fig. 1 The chromatogram of time-delay analysis of fingerprint of Xuefu Zhuyu decoction at 280 nm |
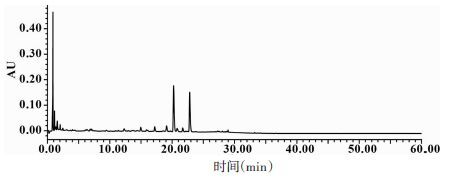
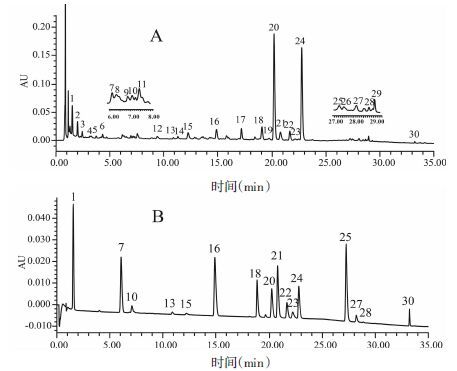
将血府逐瘀胶囊和软胶囊内容物、片剂、汤剂、口服液按“2.1.2”项下方法制备供试品溶液,进样2 μL,注入超高效液相色谱仪,按“2.2”项下色谱条件测定血府逐瘀汤不同剂型的指纹图谱,如图 2~3所示,记录各个共有峰的保留时间及峰面积,以野漆树苷为参照峰,计算各个共有峰的相对保留时间及相对峰面积,共标定共有峰30个,通过标准品比对,鉴定了16个共有峰,结果见表 1。
|
| 图 2 280 nm下血府逐瘀汤标准指纹图谱(A)和混合对照品溶液的色谱图(B) Fig. 2 Representative fingerprint chromatogram of Xuefu Zhuyu decoction (A) and mixed standards solution (B) at 280 nm |
|
| 图 3 280 nm下血府逐瘀胶囊(A)、口服液(B)、片剂(C)、软胶囊(D)、汤剂(E)指纹图谱 Fig. 3 Fingerprint of multiple dosage forms of Xuefu Zhuyu decoction at 280 nm, A: capsule; B: oral liquid; C: tablet; D: soft capsule; E: decoction |
| 峰号 | 相对保留时间(RRT±5%)# | 相对峰面积(RPA±SD) | 鉴定 | ||||
| 胶囊剂 | 口服液 | 片剂 | 软胶囊 | 汤剂 | |||
| 1* | 0.076±0.004 | - | - | 5.835±3.742 | 3.687±2.898 | 1.385±0.007 | 没食子酸 |
| 2 | 0.098±0.005 | 1.932±0.794 | - | - | 3.582±1.388 | - | NA |
| 3 | 0.119±0.006 | 0.554±0.314 | 4.893±4.913 | 1.665±0.963 | 20.136±9.417 | - | NA |
| 4 | 0.153±0.008 | - | - | - | 2.171±1.243 | - | NA |
| 5 | 0.178±0.009 | - | - | - | - | - | NA |
| 6 | 0.203±0.010 | - | - | - | 2.092±1.056 | - | NA |
| 7* | 0.296±0.015 | - | - | - | - | - | 绿原酸 |
| 8 | 0.308±0.015 | - | - | - | - | - | NA |
| 9 | 0.332±0.017 | - | - | - | 1.941±1.220 | - | NA |
| 10* | 0.359±0.018 | - | - | - | - | - | 羟基红花黄色素A |
| 11 | 0.384±0.019 | - | - | - | - | - | NA |
| 12 | 0.459±0.023 | - | - | - | - | - | NA |
| 13* | 0.527±0.026 | - | - | - | - | - | 芍药内酯苷 |
| 14 | 0.550±0.027 | - | - | - | - | - | NA |
| 15* | 0.596±0.030 | 0.669±0.068 | - | - | - | - | 芍药苷 |
| 16* | 0.699±0.035 | - | 17.970±1.256 | - | - | 1.067±0.016 | 甘草苷 |
| 17 | 0.829±0.041 | 0.674±0.170 | - | - | - | - | NA |
| 18* | 0.892±0.045 | 0.908±0.209 | - | - | 4.049±2.728 | - | 蜕皮甾醇 |
| 19 | 0.920±0.046 | 0.612±0.140 | 1.799±0.422 | - | - | 1.301±0.037 | NA |
| 20* | 0.974±0.049 | 6.904±0.582 | 15.915±3.481 | 13.886±4.852 | - | 11.286±0.064 | 柚皮苷 |
| 21(S)* | 1.000 | 1.000 | 1.000 | 1.000 | 1.000 | 1.000 | 野漆树苷 |
| 22* | 1.042±0.052 | 0.589±0.154 | - | 0.796±0.582 | 3.417±3.429 | - | 橙皮苷 |
| 23* | 1.065±0.053 | - | - | - | - | - | 甘草素 |
| 24* | 1.096±0.055 | 6.961±1.781 | 9.713±4.140 | 6.512±4.608 | - | 9.274±0.058 | 新橙皮苷 |
| 25* | 1.308±0.065 | - | - | - | - | - | 柚皮素 |
| 26 | 1.318±0.066 | - | - | - | - | - | NA |
| 27* | 1.349±0.067 | - | - | - | - | - | 山奈酚 |
| 28* | 1.376±0.069 | - | - | - | - | - | 竹节参皂苷 |
| 29 | 1.389±0.069 | - | - | - | - | - | NA |
| 30* | 1.592±0.080 | - | - | - | - | - | 甘草酸 |
| 注:“*”:通过与标准品比对鉴定的化合物,“S”:参照峰,“-”:峰面积占总峰面积小于3%,“NA”:没有对照品对照,“#”:相对保留时间以胶囊剂共有峰相对保留时间计。 | |||||||
将不同批次血府逐瘀制剂的色谱图导入国家药典委员会开发的中药色谱指纹图谱相似度评价系统(2004 A版),对不同批次血府逐逐瘀制剂的UPLC指纹图谱进行相似度评价与分析,进而评价血府逐瘀不同剂型的质量。
按剂型分类,通过对不同批次血府逐瘀制剂色谱图进行谱峰差异性和整体相似性评价的结果可以看出,血府逐瘀胶囊相似度均大于0.81,血府逐瘀片相似度均大于0.90,血府逐瘀口服液相似度均大于0.89,血府逐瘀软胶囊相似度均大于0.89,说明血府逐瘀制剂工艺和质量相对稳定。
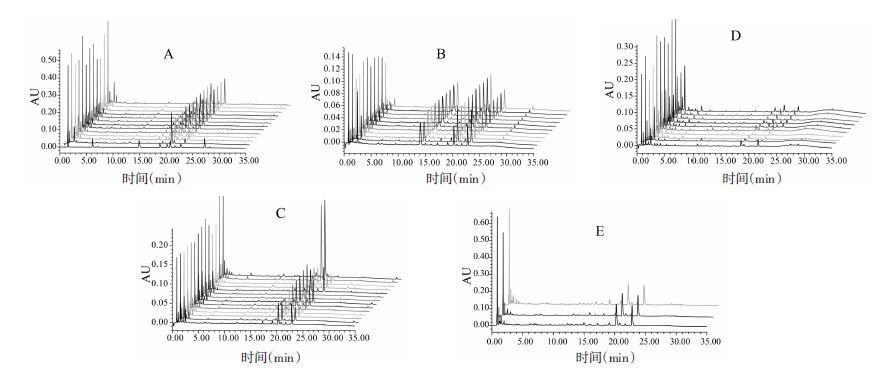
4.3 血府逐瘀汤不同制剂指纹图谱的PCA分析将血府逐瘀汤不同制剂的指纹图谱数据分别导入EZinfo软件,以相对峰面积为特征值进行PCA分析。如图 4所示,5种血府逐瘀汤制剂聚类在3个不同的区域,胶囊、片剂、汤剂在一个区域,口服液和软胶囊各在一个区域,表明血府逐瘀汤不同制剂存在明显差异。从样本分布的疏密程度分析:胶囊、片剂、汤剂在空间分布相对集中,而口服液、软胶囊在空间分布相对分散,表明胶囊、片剂的质量均一性较好。
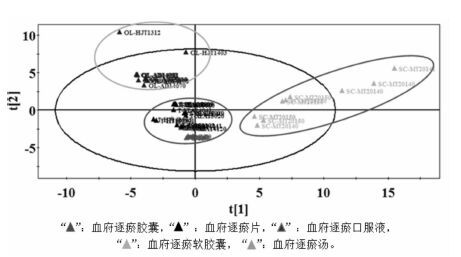
|
| 图 4 血府逐瘀汤不同剂型指纹图谱的PCA结果 Fig. 4 Principal components analysis for fingerprint of multiple dosage forms of Xuefu Zhuyu decoction |
针对于目前对血府逐瘀汤多剂型质量标准不统一的情况,本研究建立了基于UPLC-DAD技术一种快速、准确的血府逐瘀汤的UPLC指纹图谱分析方法,并应用于血府逐瘀汤及其制剂(胶囊、口服液、片剂、软胶囊)的质量评价。鉴定了血府逐瘀汤指纹图谱中的16个共有指纹峰,分别是没食子酸、绿原酸、羟基红花黄色素A、芍药内酯苷、芍药苷、甘草苷、蜕皮甾醇、柚皮苷、野漆树苷、橙皮苷、甘草素、新橙皮苷、柚皮素、山奈酚、竹节参皂苷IVa、甘草酸。血府逐瘀汤及其制剂指纹图谱的建立,进一步阐明了血府逐瘀汤的化学物质基础,为血府逐瘀汤的质量控制奠定了基础。
5.2 血府逐瘀汤不同制剂指纹图谱差异分析血府逐瘀汤不同制剂指纹图谱存在明显差异,产生差异的原因可能与不同剂型的生产工艺有关:血府逐瘀片及胶囊[16]均是取炒桃仁半量、当归、赤芍、麸炒枳壳、川芎、柴胡粉碎成细粉,其余红花等五味及剩余炒桃仁的水煎液浓缩为稠膏,细粉与稠膏混合制成;血府逐瘀汤是采用全部药材提取后入药方式制成;血府逐瘀口服液[17]是柴胡、当归、麸炒枳壳、川芎先蒸馏提取芳香水,药渣和其余七味药经水提醇沉处理后经一系列制药工艺制成;软胶囊采用复方中全部药材经提取后提取物制成。
| [1] | 王清任. 医林改错·卷上[M]. 上海: 科学技术出版社, 1966 : 22 |
| [2] | 陈介柄. 略论血府逐瘀汤的组方原理与临床验证[J]. 中医药学报, 1989, 17 (3) : 35–36. |
| [3] | 张学文. 《医林改错》一书的学习与活血化瘀方药的运用[J]. 天津中医药, 2006, 23 (1) : 1–6. |
| [4] | 张秋雁, 苏剑锋. 血府逐瘀汤治验3则[J]. 湖南中医药导报, 2003, 9 (5) : 55. |
| [5] | 李延松. 血府逐瘀汤临床运用三则[J]. 湖北中医学院学报, 2000, 2 (1) : 41. |
| [6] | 孙明谦, 卢健秋, 张宏桂. 液质联用技术分析血府逐瘀汤中的化学成分[J]. 中成药, 2009, 31 (5) : 793–794. |
| [7] | Liu L, Cheng Y, Zhang H. Phytochemical analysis of anti-atherogenic constituents of Xue-Fu-Zhu-Yu-Tang using HPLC-DAD-ESI-MS[J]. Chem Pharm Bull (Tokyo), 2004, 52 (11) : 1295–1301. DOI:10.1248/cpb.52.1295 |
| [8] | Zhang HJ, Cheng YY. An HPLC/MS method for identifying major constituents in the hypocholesterolemic extracts of Chinese medicine formula ‘Xue-Fu-Zhu-Yu decoction’[J]. Biomed Chromatogr, 2006, 20 (8) : 821–826. DOI:10.1002/(ISSN)1099-0801 |
| [9] | 甘师俊, 李振吉, 邹健强, 等. 中药现代化发展战略[J]. 医学研究通讯, 2002 (4) : 22–23. |
| [10] | 李和. 中药指纹图谱质控及其评价方法[J]. 中药材, 2002, 25 (4) : 290–292. |
| [11] | 韩凤梅, 蔡敏, 陈勇. 中药指纹图谱技术研究现状[J]. 分析科学学报, 2004, 20 (6) : 647–651. |
| [12] | 谢培山. 色谱指纹图谱分析是中草药质量控制的可行策略[J]. 中药新药与临床药理, 2001, 12 (3) : 141–151. |
| [13] | 房德敏. 中药指纹图谱技术的研究与应用[J]. 中草药, 2005, 36 (4) : 632–634. |
| [14] | Zhang L, Zhu L, Wang Y. Characterization and quantification of major constituents of Xue Fu Zhu Yu by UPLC-DAD-MS/MS[J]. J Pharm Biomed Anal, 2012, 62 : 203–209. DOI:10.1016/j.jpba.2011.12.026 |
| [15] | Zhang L, Jiang ZZ, Yang J. Chemical material basis study of XuefuZhuyu decoction by ultra-performance liquid chromatography coupled with quadrupole time-of-flight mass spectrometry[J]. J Food Drug Anal, 2015, 23 (4) : 811–820. DOI:10.1016/j.jfda.2015.06.004 |
| [16] | 国家药典委员会.中华人民共和国药典(一部)[S]. 北京:中国医药科技出版社,2015: 851-853. |
| [17] | 国家药典委员会.中华人民共和国药典(一部)[S]. 北京:中国医药科技出版社,2015: 849-850. |
2. Research and Development Center of Traditional Chinese Medicine, Tianjin International Joint Academy of Biotechnology and Medicine, Tianjin 300457, China;
3. Tianjin Hongrentang Pharmaceutical Co., Ltd., Tianjin 300385, China
 2016, Vol. 33
2016, Vol. 33