文章信息
- 马卫国, 孟凤仙, 张继胜, 陆妍, 王亚南, 沈志明, 王洁, 刘慧
- MA Wei-guo, MENG Feng-xian, ZHANG Ji-sheng, LU Yan, WANG Ya-nan, SHEN Zhi-ming, WANG Jie, LIU Hui
- 加味四妙勇安汤对CIA大鼠关节炎性病理损伤的作用研究
- Study on pathological and molecular mechanism of the effect of the modified Simiao Yong'an decoction on the arthritis in CIA rats
- 天津中医药, 2017, 34(1): 43-47
- Tianjin Journal of traditional Chinese Medicine, 2017, 34(1): 43-47
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.01.11
-
文章历史
- 收稿日期: 2016-09-20
2. 中国中医科学院西苑医院, 北京 100091
类风湿关节炎(RA)是以多关节滑膜炎症为主要表现的高致残性自身免疫病,关节病理以滑膜内膜层增生,炎性细胞浸润为特征,炎性细胞进而分泌细胞因子促进炎症反应,增生的滑膜内膜衬里层产生大量的蛋白酶,是导致RA发生骨侵蚀的重要因素[1]。目前对本病的治疗研究围绕遏制关节滑膜炎症展开,相关炎性分子中,肿瘤坏死因子-α(TNF-α),白细胞介素-6(IL-6)和白细胞介素-17(IL-17)作为细胞因子网络中的重要角色参与了疾病过程的慢性化[1],并且TNF-α和IL-6已经成为RA治疗的靶点。四妙勇安汤具有清热解毒消肿的功效,是治疗RA的经典方。本实验采用II型胶原诱导性关节炎(CIA)大鼠模型,通过对大鼠关节炎指数(AI)积分评价、关节组织病理学及大鼠体内IL-6,IL-17,TNF-α水平的检测,探讨中药加味四妙勇安汤对CIA大鼠关节炎改善作用及分子机制。
1 材料和方法 1.1 实验动物和实验环境SPF级雄性SD大鼠90只,体质量200~220 g,购自北京维通利华实验动物技术有限公司(许可证号:SCXK(京)2012-0001)。北京中医药大学动物实验室实验动物使用许可证号:SYXK(京)2011-0024。适应性饲养1周,室温(18±2) ℃,相对湿度60%~70%。
1.2 仪器与试剂试剂:牛源性II型胶原蛋白(CII),购自Chondrex公司(Lot130087);完全弗氏佐剂(CFA),购自SIGMA公司(CAS 9007-81-2)。仪器:移液器(20~200 μL),游标卡尺,电子天平,制冰机,HC-3018R高速冷冻离心机(中科中佳公司),超净工作台(SW-CJ-IFD)。
1.3 实验药物中药加味四妙勇安汤(忍冬藤15 g,金银花15 g,玄参30 g,当归20 g,甘草10g),由北京中医药大学东方医院药剂科制剂室提供。来氟米特片(苏州长征-欣凯制药有限公司,国药准字H20000550)。
1.4 造模及分组90只大鼠随机选出84只以备造模,另外6只为正常对照。两组大鼠周龄及体质量差别无统计学意义。
1.4.1 牛II型胶原与完全弗氏佐剂混合乳剂的配制(浓度为1mg/mL)0.1 mL/L的冰醋酸先溶解CⅡ,浓度为4 mg/mL,放置4 ℃冰箱过夜,与CFA等体积混合,在冰浴条件下将其充分混合,完全乳化。
1.4.2 造模方法初次免疫时(0 d),于造模组大鼠尾根部皮内注射200 μL已制备好的混合乳剂(含CII 200 μg)。加强免疫时(9 d),于大鼠尾根部皮内注射100 μL混合乳剂(含CII 100 μg),正常对照组注射等体积的生理盐水。16 d时对CIA大鼠模型进行评价。
1.4.3 模型评价标准及成模数量AI评分标准:0分,正常。1分,明显可见的腕/踝关节轻度肿胀或局限于单个关节肿胀或少数几个关节受累。2分,中度的腕/踝关节肿胀,仅局限于单个腕/踝关节,不累及其他指间关节。3分,严重的腕/踝关节肿胀,累及足爪(足背及掌指/跖趾关节)。4分,整个肢体肿胀累及多个关节。四肢AI评分累计≥4分者视为模型成功[2]。
1.4.4 实验分组抽取造模成功大鼠30只,随机分为模型组,阳性药物组,中药高剂量组,中药中剂量组,中药低剂量组,每组各6只,另有已设正常对照组6只。
1.5 干预方法正常组与模型组均给予蒸馏水10 mL/(kg·d)灌胃。阳性药组予来氟米特灌胃,剂量为1.87 mg/(kg·d)。中药高剂量组按照生药量16.4 g/(kg·d)灌胃给药。中药中剂量组按照生药量8.2 g/(kg·d)灌胃给药。中药低剂量组按照生药量4.1 g/(kg·d)灌胃给药。干预治疗12周。
1.6 观察指标 1.6.1 大鼠一般情况毛色、形态,活动情况,体质量。
1.6.2 大鼠AI积分变化干预治疗后每周1次对各组每只大鼠的四肢分别进行AI评分,累计得出每只鼠的关节总AI积分,观察关节炎指数变化情况。
1.6.3 大鼠右踝关节组织病理学变化干预治疗12周后,10%水合氯醛麻醉,取右踝关节放入10%甲醛溶液固定,将固定好的右踝关节取材、脱钙后,流水冲洗数小时,经梯度乙醇脱水,二甲苯透明,石蜡包埋后,4 μm切片,进行苏木精-伊红(HE)染色,光镜观察关节滑膜被覆上皮有无变性、增生,间质有无炎细胞浸润及肉芽组织形成;关节腔有无减小或闭塞,关节软骨有无破坏或纤维化,关节周围软组织有无炎性细胞浸润或纤维化。
1.6.4 大鼠滑膜组织及血清IL-6、IL-17、TNF-α含量干预治疗12周后,10%水合氯醛麻醉,取血2 mL,离心,取上清液备酶联免疫吸附实验(ELISA)法检测。大鼠处死后,在冰皿上快速切取双膝关节滑膜,置于5 mL冻存管中,放入液氮,以备做逆转录-聚合酶链反应(RT-PCR)检测。
1.6.4.1 RT-PCR技术检测大鼠滑膜组织IL-6、IL-17、TNF-αmRNA转录水平取大鼠关节滑膜组织,使用Trizol试剂提取RNA后,进行一步法RT-PCR反应,检测IL-6、IL-17、TNF-α的mRNA转录水平。反应体积为25 μL,反应体系含样本RNA 2 μL,10Pmol引物各0.8 μL。IL-6、IL-17、TNF-α基因序列:针对IL-6基因序列的上下游引物分别是:5-CCCTGACTGGCTAAAGGACA-3和5-CAGTACAG-CCGCCTTCT AGG-3;针对IL-17基因序列的上下游引物分别是:5-TACAACCTCCTTGCAGCTCC-3和5-GGATCTTCATGAGGTGTCAGTC-3;针对TNF-α基因序列的上下游引物分别是:5-GGATCTCAAAGACAACCAAC-3和5-ACAGAGC-AATGACTCCAAAG-3;针对看家基因GAPDH基因序列的引物分别是:5- CCCATCTATGAGGGTTAC-GC -3和5-TTTA ATGTCACGCACGATTTC -3。扩增条件为:42 ℃灭活5 min,95 ℃变性10 s,95 ℃退火5s,60 ℃延伸34 s,共40个循环。反应结束后进行熔解曲线分析,以鉴定PCR产物的特异性。使用SDS软件分析RT-PCR过程各检测样本的Ct(Threshold of cycle)值。
1.6.4.2 ELISA技术检测大鼠血清IL-6、IL-17、TNF-α蛋白表达水平按照试剂盒说明书要求,顺序规范操作。
1.7 统计学处理应用SPSS 18.0统计软件。计量资料以均数±标准差(x±s)表示,对不同组间同一时点的关节炎指数,体重及细胞因子测量数据比较用单因素方差分析,组间两两比较时若方差齐采用LSD法,若方差不齐采用Dunnett’s T3法,P<0.05为差异有统计学意义。
2 结果 2.1 加味四妙勇安汤对大鼠一般情况的影响正常对照组大鼠皮毛光泽,较活泼,纳食正常,其余各组皮毛光泽度较差,轻度脱毛,动作迟缓,纳食较少,体重增长较慢。除正常对照组以外,各组大鼠均表现有关节肿痛,活动减少,关节活动受限甚至强直。其中模型组大鼠在治疗期间,表现得相对明显。整个治疗期间内,模型组大鼠体质量较正常组显著减低(P<0.01),各治疗组大鼠较模型组大鼠体质量差异无统计学意义。见表 1。
| g | ||||||||
| 组别 | 动物数 | 0周 | 2周 | 4周 | 6周 | 8周 | 10周 | 12周 |
| 正常组 | 6 | 366.8±22.8 | 413.0±41.5 | 452.3±50.6 | 482.0±57.3 | 505.5±66.5 | 532.0±68.3 | 542.7±81.2 |
| 模型组 | 6 | 312.1±19.4## | 321.0±32.1## | 358.9±40.7## | 392.7±53.9## | 409.8±55.8# | 437.5±65.8## | 433.8±93.8## |
| 阳性药组 | 6 | 302.8±32.4 | 327.3±47.9 | 368.3±50.2 | 412.6±55.0 | 435.5±55.3 | 463.5±55.2 | 474.1±54.4 |
| 中药高剂组 | 6 | 291.4±22.4 | 309.4±41.8 | 345.8±42.2 | 383.8±46.9 | 409.6±51.6 | 417.6±43.2 | 430.4±44.9 |
| 中药中剂量组 | 6 | 306.5±14.2 | 318.4±25.3 | 371.9±26.0 | 419.7±35.8 | 435.1±57.0 | 478.6±62.0 | 487.4±86.1 |
| 中药低剂组 | 6 | 292.9±26.7 | 303.3±31.4 | 356.7±30.1 | 405.4±28.5 | 431.4±31.4 | 463.4±35.9 | 469.3±27.3 |
| 注:与正常组比,#P<0.05,##P<0.01。 | ||||||||
在治疗期间,与正常组比较,模型组大鼠关节总AI积分在0~4周,6~12周均有显著升高(P<0.05或P<0.01),提示模型成功,且较稳定。与模型组比较,各治疗组的总AI积分总体呈下降趋势。阳性对照药组在7~12周时关节总AI积分明显降低,具有统计学差异(P<0.05或P<0.01)。中药3种剂量组在6~12 周时AI分值较模型组明显下降(P<0.05或P<0.01);而且在8~10周还分别表现出短期内较阳性药物组显著的改善(P<0.05或P<0.01)。见表 2。
| 分 | ||||||||||||||
| 组别 | 动物数 | 0周 | 1周 | 2周 | 3周 | 4周 | 5周 | 6周 | 7周 | 8周 | 9周 | 10周 | 11周 | 12周 |
| 正常组 | 6 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 | 0.00±0.00 |
| 模型组 | 6 | 7.17±1.33## | 8.33±0.82## | 8.50±0.84## | 8.67±1.21## | 8.50±0.84## | 5.17±4.31 | 8.50±1.76## | 9.33±2.07## | 9.17±2.04## | 9.17±2.40## | 2.07±0.84## | 9.83±3.49## | 7.17±3.37## |
| 阳性药组 | 6 | 7.67±1.97 | 7.50±2.17 | 7.50±2.66 | 7.50±1.76 | 8.00±1.79 | 3.00±3.35 | 6.33±2.07 | 4.67±2.73** | 6.50±1.98* | 5.67±2.34** | 1.51±0.62** | 4.50±3.02** | 3.67±1.51** |
| 中药高剂量组 | 6 | 7.33±1.51 | 8.50±3.89 | 8.33±3.93 | 8.83±4.49 | 6.83±2.71 | 7.00±5.44 | 5.50±3.45* | 3.33±3.01** | 3.60±3.58**Δ | 3.00±2.83**Δ | 2.60±1.67** | 3.80±2.28** | 3.20±2.59** |
| 中药中剂量组 | 6 | 7.17±1.84 | 8.20±2.49 | 7.80±3.35 | 7.40±3.29 | 6.80±3.03 | 5.20±4.32 | 3.80±2.68** | 2.80±2.28** | 3.20±1.79**ΔΔ | 3.40±1.95** | 2.20±1.48** | 3.40±2.19** | 2.60±1.67** |
| 中药低剂量组 | 6 | 7.00±1.55 | 8.17±2.23 | 8.33±4.08 | 6.33±5.12 | 5.83±2.04* | 4.00±6.23 | 4.33±3.01** | 3.67±3.20** | 1.83±0.41**ΔΔ | 1.33±0.82**ΔΔ | 1.00±1.67**ΔΔ | 2.00±1.79** | 2.00±1.41** |
| 注:与正常组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01;与阳性药组比较,△P<0.05,△△P<0.01。 | ||||||||||||||
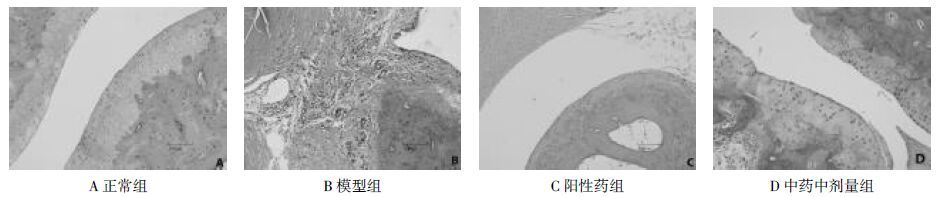
正常组大鼠右踝关节面光滑,软骨细胞排列整齐,关节周围组织未见炎性细胞浸润。模型组大鼠右踝关节软骨滑膜被覆上皮细胞轻度增生,关节腔缩小,周围软组织见轻度纤维增生,轻度炎性细胞浸润,以淋巴细胞为主。阳性药物组:关节面光滑,软骨细胞排列整齐,关节周围组织未见炎性细胞浸润。加味四妙勇安汤高、中剂量组:关节周围软组织见轻度纤维组织增生,未见炎性细胞浸润,滑膜、软骨等较模型组未见明显差异。加味四妙勇安汤低剂量组:关节滑膜增生,有少量淋巴细胞浸润,关节软骨纤维化,周围软组织有轻度纤维组织增生,较模型组无统计学差异。见图 1。
|
| 图 1 光镜下观察各组大鼠踝关节病理变化(标尺=500 μm) Fig. 1 Pathological changes of ankle joint in rats under light microscope(Scale=500 μm) |
与正常组比较,模型组大鼠关节滑膜IL-6、IL-17、TNF-α mRNA转录水平显著升高(P<0.01)。与模型组比较,阳性药物(来氟米特)组、中药高、中、低剂量组IL-6、IL-17、TNF-α mRNA转录水平显著降低,差异有统计学意义(P<0.01或P<0.05)。见表 3。
| 组别 | 动物数 | IL-6 | IL-17 | TNF-α |
| 正常组 | 6 | 119.57±13.52 | 112.16±14.62 | 107.46±17.01 |
| 模型组 | 6 | 514.38±22.73## | 516.21±13.24## | 704.33±48.39## |
| 阳性药物组 | 6 | 193.29±22.70** | 343.07±18.40** | 272.68±25.89** |
| 中药高剂量组 | 6 | 327.71±21.49** | 339.23±33.31** | 441.84±22.73** |
| 中药中剂量组 | 6 | 332.89±24.26** | 422.69±16.23** | 522.42±38.24** |
| 中药低剂量组 | 6 | 423.76±21.80** | 493.48±18.53* | 530.08±23.38** |
| 注:与正常组比,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01。 | ||||
与正常组比较,模型组大鼠血清IL-6、IL-17、TNF-α蛋白表达水平显著升高(P<0.01)。与模型组比较,阳性药物(来氟米特)组、中药高、中、低剂量组IL-6、IL-17、TNF-α 蛋白表达水平显著降低,差异有统计学意义(P<0.01)。见表 4。
| ng/L | ||||
| 组别 | 动物数 | IL-6 | IL-17 | TNF-α |
| 正常组 | 6 | 36.110±3.590 | 6.890±1.820 | 96.972±15.930 |
| 模型组 | 6 | 51.948±7.225## | 14.832±2.006## | 380.640±62.273## |
| 阳性药物组 | 6 | 38.427±3.300** | 5.960±3.357** | 119.579±9.157** |
| 中药高剂量组 | 6 | 42.408±4.103** | 4.312±1.490** | 114.071±40.178** |
| 中药中剂量组 | 6 | 43.159±2.880** | 7.534±4.014** | 185.317±85.314** |
| 中药低剂量组 | 6 | 41.769±4.871** | 8.098±3.562** | 216.337±117.702** |
| 注:与正常组比,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01。 | ||||
几乎所有的血清学阳性的RA患者滑膜组织中分离出的B细胞,都可以活跃地分泌Ⅱ型胶原抗体[3]。Ⅱ型胶原诱导型关节炎(CIA)即是通过Ⅱ型胶原混合弗氏佐剂,注射入动物体内,诱发其产生抗Ⅱ型胶原的IgG型抗体,引起动物慢性增殖性滑膜炎,进而发生软骨与骨的破坏,导致关节肿热,甚至强直的关节炎动物模型[4]。由于CIA模型存在对Ⅱ型胶原的强烈免疫反应,在关节肿胀、组织病理学和影像学改变方面均与RA极为相似[5-6],且CIA大鼠血清及组织中可见TNF-α,IL-17及IL-6等多种细胞因子的高表达,已成为目前评价RA治疗的经典模型。本实验也从病理及细胞因子检测两方面观察到CIA大鼠在成模后12周,具备RA活动期的免疫炎性病理损伤特点。
四妙勇安汤为治疗RA急性发作期常用方剂。CIA模型表现出四肢多关节红肿热痛,急性起病,慢性进展,与RA患者活动期较为常见的痰热瘀毒痹阻经络关节[7]的征象相似,而且对清热解毒,化瘀通络的中药反应较好[8],更加符合热毒瘀结证型。因此采用CIA模型大鼠作为研究对象,能够较好的模拟加味四妙勇安汤适用的证型。
AI总积分的动态变化反映出,药物干预6周后,AI总积分在各治疗组与模型组间差异较明显。中药各组分别在治疗第8、9、10周出现AI总积分显著低于阳性对照药物组,而在11周以后各治疗组间AI总分无统计学差异。提示中药与阳性对照药来氟米特的起效时间均在5周以后,起效早期,加味四妙勇安汤的治疗作用更强。
病理结果证实了CIA大鼠模型组的滑膜增生,炎性细胞浸润,符合RA关节病理特征,中药中剂量组对CIA大鼠关节炎性病理损伤有改善作用。但在中药高、低剂量组中观察到了物理指标的改善,未见明显病理改善,而在阳性药物组、中药中剂量组同时见到了两方面的改善,提示:1)中药3剂量组中,中等剂量组的量效关系最佳。加味四妙勇安汤与阳性对照药均能够改善CIA病情,而不是仅有消缓肿胀症状的作用。2)本实验模拟的是一种慢性自身免疫性炎症,12周的治疗期对CIA大鼠来说,时间较短,这可能是中药高、低组关节炎症体征好转,病理改善不明显的原因,如果延长治疗期,疗效或许更为显著。
分子水平的研究已表明,尽管在RA发生的机制路径上有众多的炎性因子参与其中,但TNF-α,IL-17及IL-6以其在RA的细胞因子网络中的重要作用备受瞩目。TNF-α是RA滑膜炎症反应的关键性细胞因子,具有多种炎性和免疫反应活性,几乎参与RA炎症反应的所有环节,在RA滑膜炎、骨及软骨的破坏中起非常重要的作用[9]。Th17细胞/调节性T细胞亚群失衡在RA发病中具有极为重要的作用,且以Th17细胞占优势[10]。活化的Th17细胞分泌多种前炎症细胞因子,其中最具特征的就是IL-17,具有促产生炎性细胞因子(如IL-6、TNF-α),趋化因子和基质金属蛋白酶的表达,引起炎性浸润和组织破坏的作用[11]。IL-17还能激活多种参与RA发病的细胞类型,包括滑膜成纤维细胞、单核细胞、巨噬细胞、软骨细胞及成骨细胞[12]。IL-6是一种促炎细胞因子,通过促进炎症细胞聚集、刺激滑膜血管翳形成、破骨细胞活化等,可导致关节炎症及骨破坏,在RA 的进程中起关键作用[13]。IL-6促进Th17的活化,活化的Th17细胞又分泌IL-17等多种前炎性因子,而IL-17能进一步促进IL-6、TNF-α等细胞因子的释放和其他致炎细胞的激活[14]。这种瀑布样叠加的炎症激活作用,导致RA免疫炎性损伤进展及滑膜血管翳形成、软骨与骨受到破坏。本研究证实加味四妙勇安汤能显著下调CIA大鼠体内IL-6,IL-17,TNF-α的mRNA转录水平及蛋白表达。提示该药可能是通过下调这些RA发病机制中的关键细胞因子,而抑制了炎性细胞因子网络的活跃状态,从而减轻自身免疫反应,以达到缓解RA症状,改善病理损伤的作用。
| [1] | 栗占国, 唐福林(译). 凯利风湿病学[M]. 北京: 北京大学医学出版社, 2011: 1135 |
| [2] | Holmdahl R, Jansson L, Andersson M, Larsson E. Immunogenetics of tyPe II collagen autoimmunity and suscePtibility to collagen arthritis[J]. Immunology, 1988, 65 (2): 305–310. |
| [3] | Tarkowski A, Klareskog L, Carlsten H, et al. Secretion of antibodies to tyPes I and II collagen by synovial tissue cells in Patients with rheumatoid arthritis[J]. Arthritis Rheum, 1989, 32 : 1087. DOI:10.1002/(ISSN)1529-0131 |
| [4] | Trentham DE, Townes AS, Kang AH. Autoimmunity to tyPe II collagen:an exPerimental model of arthritis[J]. J ExP Med, 1977, 146 (3): 857–68. DOI:10.1084/jem.146.3.857 |
| [5] | Trentham DE. Collagen arthritis as a relevant model for rheumatoid arthritis[J]. Arthritis Rheum, 1982, 25 : 911. DOI:10.1002/(ISSN)1529-0131 |
| [6] | 张新梅. T淋巴细胞与胶原诱导性关节炎[J]. 中国试验动物学报, 2004, 48 (1): 53–56. |
| [7] | 姜泉, 曹炜. 475例类风湿关节炎患者中医临床证候分析研究[J]. 中医杂志, 2007, 48 (3): 253–255. |
| [8] | 陆妍, 王亚南, 刘慧, 等. 中药藤莓汤对Ⅱ型胶原诱导性大鼠关节炎性病理损伤的影响[J]. 中国比较医学杂志, 2015, 25 (4): 48–57. |
| [9] | 黄峻, 黄祖瑚. 临床药物手册[M]. 上海: 上海科学技术出版社, 2015: 345 |
| [10] | Boissier MC, Assier E, Falgarone G, et a1. Shifting theimbalance from Th1/Th2 to Thl7/Treg:the changingrheumatoid arthritis Paradigm[J]. JointBone SPine, 2008, 75 (4): 373–375. |
| [11] | Lubberts E. Thl7 cytokines and arthritis[J]. Semin ImmunoPathol, 2010, 32 : 43–53. DOI:10.1007/s00281-009-0189-9 |
| [12] | Komiyama YS, Nakae T, Matsuki A, et a1. IL-17 Play animPortant role in the develoPment of exPerimentalautoimmune encePhalomyelitis[J]. J Immunol, 2006, 177 (1): 566–573. DOI:10.4049/jimmunol.177.1.566 |
| [13] | Nofihiro Nishimoto, Tadamitsu Kishimoto. Interleukin 6:frombench to bedside[J]. Nature Clinical Practice Rheumatology, 2006, 2 : 619–626. DOI:10.1038/ncprheum0338 |
| [14] | 史群, 尤欣, 郑乐婷, 等. 白介素-6受体拮抗剂对类风湿关节炎患者外周血单个核细胞Th17分化的影响[J]. 中日友好医院学报, 2013, 27 (3): 159–163. |
2. Xiyuan Hospital, China Academy of Chinese Medical Sciences, Beijing 100091, China
 2017, Vol. 34
2017, Vol. 34