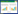文章信息
- 梁勇, 郭鹏, 陈作, 李艳灵, 刘永宇, 孙玲, 曹书华, 高克俭
- LIANG Yong, GUO Peng, CHEN Zuo, LI Yan-ling, LIU Yong-yu, SUN Ling, CAO Shu-hua, GAO Ke-jian
- 心复康丸对压力超负荷大鼠心肌组织microRNA-1影响的实验研究
- Experimental study of Xinfukang pills on microRNA-1 in cardiac tissue of pressure overloaded rats
- 天津中医药, 2017, 34(1): 48-53
- Tianjin Journal of traditional Chinese Medicine, 2017, 34(1): 48-53
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.01.12
-
文章历史
- 收稿日期: 2016-09-13
2. 天津市北辰区中医医院重症医学科, 天津 300400;
3. 天津市儿童医院药剂科, 天津 300134
心力衰竭是指由于各种原因造成的心脏收缩和(或)舒张功能异常,使心脏排血不能满足机体需求而导致的复杂病理生理过程和临床证候群[1]。症状性心力衰竭的发病率伴随着年龄的增长而显著升高,65岁以上老年患者的发病率接近6%~10%。超过50%的心力衰竭患者4 a内将死亡,对于终末期心力衰竭患者而言其1 a病死率就高达50%,这甚至超过了某些恶性肿瘤[2-3]。而心肌肥厚和心室重构是导致心力衰竭的始动环节及独立危险因子,因此尽早采取有效的措施干预/逆转心肌肥厚和心室重构具有深远意义。心复康丸是治疗心肾阳虚、肾不纳气冠心病慢性心功能不全的有效方剂,且目前研究显示对心功能不全患者的心功能及心室重塑有明显的改善作用[4-6],但其作用机制尚不明确。本研究采用腹主动脉缩窄法制作压力超负荷大鼠心肌肥厚和心室重构模型,研究心复康丸对不同病理阶段模型大鼠心肌组织microRNA-1(miR-1)的影响,探讨其减轻心肌肥厚和心室重构的作用机制,为其在临床应用提供实验依据。
1 材料和方法 1.1 动物雄性健康Wastar大鼠,体质量180~220 g,由北京维通利华实验动物有限公司提供,生产许可证号:SCXK(京)2012-0001。
1.2 主要仪器BX51T-PHD-J11型显微镜(日本奥林巴斯公司)、Image-Pro Plus 6.0多功能真彩色细胞图象分析管理系统(美国Media Cybernetics公司)、LineGene 9620实时定量PCR仪(杭州博日科技有限公司)、TC-96/g/h(b)PCR仪(杭州博日科技有限公司)。
1.3 药物与试剂心复康丸(天津市北辰区中医医院制剂室提供,批准文号:津药制字(2002)Z第0805号,规格:每袋10 g),马来酸依那普利片(扬子江药业集团江苏制药股份有限公司,批准文号:国药准字H32026567),Fibullin-2抗体、钙离子ATP酶(SERCA2)抗体(北京博奥森生物技术有限公司),Trizol(天津灏洋生物制品科技有限责任公司),DEPC(Sigma公司)。
1.4 动物造模、分组及给药采用腹主动脉缩窄法制备压力负荷性大鼠模型[7]。常规消毒腹部皮肤,以3.2%水合氯醛(10 mL/kg)腹腔注射麻醉,除毛,取上腹正中切口打开腹腔,分离左肾动脉起始部上段腹主动脉约10 mm,将1个8号注射器光滑针头平行置于该段腹主动脉上,以4.0丝线将腹主动脉连同针头一起结扎,然后缓慢将针头抽出,腹腔内注入青霉素2×105 U后逐层缝合肌肉及皮肤,术后常规抗炎 7 d。取术后7 d存活大鼠80只按随机数字表法随机分为模型组(M组),依那普利组(E组),心复康丸低剂量组(L组),心复康丸高剂量组(H组),另设假手术组(S组),S组不结扎腹主动脉,其他处理相同。所有大鼠实验时间为8周或12周。各药物组剂量按大鼠与人体表面积转换系数计算。将心复康丸以及依那普利片研磨碎后溶于生理盐水配置为溶液,术后4周始予以胃管灌胃给药,L组心复康丸剂量为52 mg/(kg·d),H组心复康丸剂量为208 mg/(kg·d),E组依那普利剂量为1.04 mg/(kg·d),S组及M组予等量生理盐水灌胃。分别于术后8、12周每组各取10只大鼠行相关检测。
1.5 检测指标及方法 1.5.1 标本取材及处理开胸取出心脏,用冰生理盐水洗净残血,滤纸吸干心脏并用电子天平称取心脏质量,计算心脏肥大指数,HW/BW(mg/g)=心脏质量(HW)/体质量(BW)×100%。于左心室垂直于长轴心尖处切取厚约3 mm的心肌组织块迅速放入液氮中保存留作分子生物学相关指标检查。再横向切取厚度大约为4 mm心肌组织浸入4%多聚甲醛中固定,留作相关指标检查使用。所有标本制作条件完全相同以避免实验误差。
1.5.2 Masson胶原特殊染色及胶原容积分数(CVF)的测定常规石蜡切片脱蜡,采用Masson染色,逐级乙醇脱水,中性树脂包埋,镜下观察并摄片。采用图像分析系统测量CVF,CVF=胶原面积/总面积,每张切片均随机取3个视野测量,计算平均值。
1.5.3 免疫组织化学法检测心肌组织SERCA2、Fibullin-2蛋白的表达脱蜡,1%甲醇双氧水灭火内源性酶。0.01 mol/L柠檬酸盐缓冲液(pH6.0)行抗原修复。正常山羊血清封闭液。滴加兔抗大鼠第一抗体,4 ℃孵育过夜。滴加生物素化第二抗体(IgG)。以磷酸盐缓冲液(PBS)代替一抗做阴性对照。以DAB显色,双蒸水终止反应,苏木素复染细胞核,盐酸乙醇分化,二甲苯透明后中性树脂封片,置镜下观察和拍摄。
1.5.4 实时聚合酶链反应(PCR)法检测心肌组织miR-1的表达引物制备分别参照Gen-Bank基因库中关于大鼠miR-1序列设计引物,引物由上海生物工程有限公司合成。Trizol法提取心肌组织中的总RNA,测定总RNA纯度。RNA逆转录为cDNA后进行PCR循环,循环参数: 95 ℃预变性10 min,94 ℃变性20 s,50 ℃退火加延伸20 s,45个循环。实验数据采用2-ΔΔCt法分析[8]。miR-1基因序列号NR_032116.1,引物长度82 bp,上游引物5' TGC CTA CTC AGA GCA CAT ACT 3',下游引物5' TAC CTA CCC AAA ATA CAC ACT 3';β-actin基因序列号NM_ 031144,扩增长度169 bp,上游引物5' TCA GGT CAT CAC TAT CGG CAA 3',下游引物5' AGC ACT GTG TTG GCA TAG AGG 3'。
1.5.5 统计学处理使用SPSS 21统计软件进行统计学处理。计量资料数据用均数±标准差(x±s)表示,组间比较采用单因素方差分析(one-way ANOVA)。组间两两比较先检验方差齐性(Homogeneity of variance),当方差齐时(Equal variance assumed),选择LSD法(Least significant difference);当方差不齐时(Equal variance not assumed),选择Dunnett's T3法。P<0.05代表有统计学差异。
2 研究结果 2.1 各组大鼠心脏肥大指数变化结果术后大鼠心脏出现明显的心肌肥厚,心脏肥大指数显著增加。8周时,与S组比较,M组大鼠心脏肥大指数显著增加(P<0.01)。与M组比较,L组明显降低心脏肥大指数(P<0.05),H组显著降低心脏肥大指数(P<0.01),其作用与E组相当。12周时,与S组比较,M组大鼠心脏肥大指数显著增加(P<0.01)。与M组比较,L组明显降低心脏肥大指数(P<0.05),H组显著降低心脏肥大指数(P<0.01),其作用与E组相当。见表 1。
| 组别 | HW/BW(mg/g) | |||
| 动物数 | 术后8周 | 动物数 | 术后12周 | |
| S组 | 10 | 2.29±0.18 | 10 | 2.13±0.18 |
| M组 | 10 | 3.50±0.27** | 9 | 3.13±0.47** |
| E组 | 10 | 2.68±0.15**## | 9 | 2.58±0.24**## |
| L组 | 10 | 3.26±0.14**# | 10 | 2.80±0.45**# |
| H组 | 9 | 2.87±0.18**## | 8 | 2.47±0.21*## |
| 注:与同期S组比较,*P<0.05,**P<0.01;与同期M组比较,#P<0.05,##P<0.01。 | ||||
术后各组大鼠心肌纤维化面积明显增加。8周时,与S比较,M组大鼠心肌纤维化面积显著增加(P<0.01)。与M组比较,L组明显减少心肌纤维化面积(P<0.05),H组显著减少心肌纤维化面积(P<0.01)其作用与E组相当。12周时,与S组比较,M组大鼠心肌纤维化面积显著增加(P<0.01)。与M组比较,L组明显减少心肌纤维化面积(P<0.05),H组显著减少心肌纤维化面积(P<0.01),其作用与E组相当。见表 2、图 1。
| 组别 | 动物数 | 术后8周 | 动物数 | 术后12周 |
| S组 | 10 | 23.14±2.42 | 10 | 25.08±2.81 |
| M组 | 10 | 49.09±5.06** | 9 | 51.28±5.37** |
| E组 | 10 | 37.15±4.57**## | 9 | 42.91±4.28**## |
| L组 | 10 | 44.26±6.08**# | 10 | 46.94±5.10**# |
| H组 | 9 | 33.17±3.59**## | 8 | 31.48±3.07**## |
| 注:与同期S组比较,**P<0.01;与同期M组比较,#P<0.05,##P<0.01。 | ||||
|
| 图 1 各组大鼠心脏切片Masson胶原染色图片(×400) Fig. 1 Masson collagen stained images of heart slices of rats in each group (×400) |
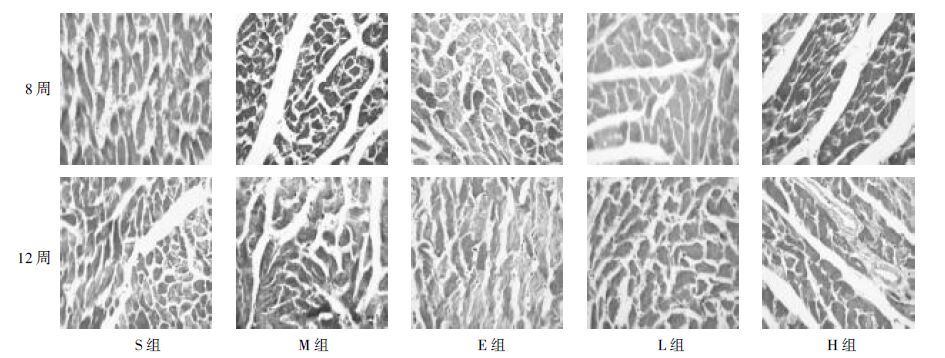
术后各组大鼠心肌组织SERCA2蛋白含量显著降低。与S组比较,M组各时间点可见心肌组织SERCA2蛋白含量均显著降低(P<0.01)。8周时,与M组比较,L组和E组对心肌组织SERCA2蛋白含量无明显影响,H组显著升高心肌组织SERCA2蛋白含量(P<0.01)。12周时,与M组比较,L组对心肌组织SERCA2蛋白含量无明显影响,H组显著升高心肌组织SERCA2蛋白含量(P<0.01),其作用优于E组。见表 3、图 2。
| 组别 | 动物数 | 术后8周 | 动物数 | 术后12周 |
| S组 | 10 | 29.70±6.24 | 10 | 29.30±6.07 |
| M组 | 10 | 15.20±4.10** | 9 | 14.78±5.80** |
| E组 | 10 | 19.00±3.94** | 9 | 19.78±4.79**# |
| L组 | 10 | 18.30±2.83** | 10 | 18.70±5.33** |
| H组 | 9 | 22.44±6.37**## | 8 | 22.88±4.52**## |
| 注:与同期S组比较,**P<0.01;与同期M组比较,#P<0.05,##P<0.01。 | ||||
|
| 图 2 各组大鼠心脏切片SERCA2蛋白免疫组化染色图片(×400) Fig. 2 Immunohistochemical staining of SERCA2 protein of heart slices of rats in each group(×400) |
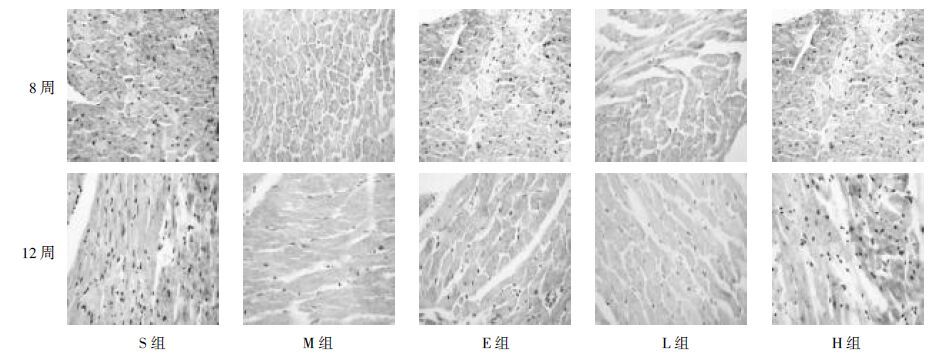
术后各组大鼠心肌组织Fibullin-2蛋白含量显著升高。与S组比较,M组各时间点可见心肌组织Fibullin-2蛋白含量均显著升高(P<0.01)。8周时,与M组比较,L组明显升高Fibullin-2心肌组织蛋白含量(P<0.05),其作用与E组相当,H组显著抑制Fibullin-2心肌组织蛋白含量(P<0.01)。12周时,与M组比较,L组和E组对心肌组织Fibullin-2蛋白含量无明显影响,H组显著抑制心肌组织Fibullin-2蛋白含量(P<0.01)。见表 4、图 3。
| 组别 | 动物数 | 术后8周 | 动物数 | 术后12周 |
| S组 | 10 | 12.90±3.75 | 10 | 13.10±3.98 |
| M组 | 10 | 29.89±2.76** | 9 | 30.75±3.58** |
| E组 | 10 | 21.50±6.20**# | 9 | 24.56±5.22** |
| L组 | 10 | 21.00±6.57**# | 10 | 25.10±3.84** |
| H组 | 9 | 17.70±3.80*## | 8 | 18.89±6.13*## |
| 注:与同期S组比较,*P<0.05,**P<0.01;与同期M组比较,#P<0.05,##P<0.01。 | ||||
|
| 图 3 各组大鼠心脏切片Fibullin-2蛋白免疫组化染色图片(×400) Fig. 3 Immunohistochemical staining of Fibullin-2 protein of heart of rats in each group (×400) |
术后各组大鼠心肌组织miR-1表达量显著减少。与S组比较,M组各时间点可见心肌组织miR-1表达量均显著减少(P<0.01)。8周时,与M组比较,L组和E组对心肌组织miR-1表达量无明显影响,H组显著升高心肌组织miR-1表达量(P<0.01);12周时,与M组比较,L组和E组对心肌组织miR-1表达量无明显影响,H组显著升高心肌组织miR-1表达量(P<0.01)。见表 5。
| 组别 | 动物数 | 术后8周 | 动物数 | 术后12周 |
| S组 | 10 | 1.024±0.154 | 10 | 1.014±0.142 |
| M组 | 10 | 0.304±0.111** | 9 | 0.267±0.078** |
| E组 | 10 | 0.396±0.088** | 9 | 0.316±0.075** |
| L组 | 10 | 0.367±0.103** | 10 | 0.305±0.133** |
| H组 | 9 | 0.501±0.106**## | 8 | 0.391±0.100**## |
| 注:与同期S组比较,**P<0.01;与同期M组比较,##P<0.01。 | ||||
心复康丸主要由制附子、黄芪、肉桂、党参、沉香、茯苓、丹参、生地、知母、阿胶等药物组成。心复康丸中制附子温肾助阳,回阳救逆,针对阳虚的基本病机起主要治疗作用,故为君药。黄芪补中益气,肉桂补火助阳,丹参活血化瘀,为臣药。佐以生地、知母滋阴清热,以制附子、肉桂之燥,茯苓健脾淡渗利湿,阿胶滋阴补血。现代医学研究发现,附子具有明显的强心作用,还能改善外周及冠状循环,促进窦房结和房室传导和增强心肌收缩力,还具有增加缺血心肌血流灌注作用,可增加缺血心肌的供氧,减少因缺氧引起的心律失常的发生[9-10]。黄芪可改善心肌缺血,改善心肌代谢,改善心功能[11]。党参可以通过增加心肌细胞内的环磷酸腺苷(cAMP),以增强心肌正性舒张和收缩功能。诸药合用,具有温补心肾,益气活血,化气利水之功效,起到强心、利尿、扩血管之效,增加心肌收缩力,改善心功能,从而缓解心力衰竭所造成的各种阴阳失衡。
随着目前分子生物学研究的深入,越来越多的目光集中在microRNAs(miRs)上。正常情况下,miRs与靶因子之间形成非常精细的网络调控结构,共同对机体的发育及生理功能进行调控,这种miRs与靶因子之间存在动态的平衡状态,和中医强调的“阴阳平衡"思想不谋而合,正如《素问·生气通天论》指出“阴平阳秘,精神乃治;阴阳离绝,精气乃绝。"心肌肥厚及心力衰竭产生是miRs与靶因子间精细而有序的调控秩序被打破,即miRs与靶因子相互对立制约的动态平衡状态被破坏,产生阴阳偏盛偏衰的失衡改变,从而导致疾病的发生。笔者认为,中药复方制剂具有多组分、多途径、多方式、多靶点的作用优势,假设其可广泛参与miRs调控网络,通过直接或间接调节相关miRs的表达,恢复miRs与靶因子之间的动态平衡,促进机体恢复阴阳平衡状态,从而达到“治病求本"的目的。
miR-1作为心肌细胞含量最丰富的miR,约占心脏miRs总量的40%,包括miR-1-1和miR-1-2两个亚型,其基因长度均为21 bp[12]。miR-1作为首个确定的肌相关miR,通过调节心脏平滑肌基因表达网络转录及效应节点来增强横纹肌的基因表型[13],并广泛参与心脏病理生理过程中的多个环节。miR-1的异常表达在心肌肥厚过程中具有重要作用,在左室肥厚大鼠和去氧肾上腺素诱导的心肌细胞肥大中其表达均显著降低,并伴随其靶因子细胞骨架调节蛋白twinfilin-1表达增加,促进心肌肥厚发生。而且,过表达的miR-1能够抑制心肌细胞肥大和降低心肌肥厚基因Acta1、Myh7、Nppa、CaM、Mef2a、RasGAP、Cdk9、GATA4等的表达[14-16]。研究也证实miR-1基因表达的恢复治疗是逆转心肌肥厚和心室重构的潜在治疗策略;同时确认Fibullin-2蛋白是miR-1直接靶因子,后者作为一种分泌性蛋白参与细胞外基质的形成[17]。本验结果显示,模型组大鼠各时间点可见心肌组织Fibullin-2蛋白含量均明显升高,Masson染色提示心肌纤维化面积显著增加,同时心肌组织miR-1表达量显著减少,表明心室重构发生过程中心肌组织miR-1表达量的减少,使其失去对其靶因子Fibullin-2蛋白的抑制作用,导致心肌纤维化显著增加。与M组比较,H组能使大鼠心肌组织miR-1表达量增加,使其靶因子Fibullin-2蛋白表达受到抑制,从而延缓心肌纤维化,提示其抗心肌肥厚和心室重构作用可能与其通过恢复miR-1基因表达,抑制其靶因子Fibullin-2蛋白表达水平,从而降低心肌胶原容积分数有关。
SERCA2是调节细胞内Ca2+的释放、摄取、储存并维持细胞内Ca2+平衡的重要因素。Matusi与Zierhut等[18-19]指出在压力负荷所致的心肌肥厚中SERCA2表达下调,且随着心肌肥厚进展直至心力衰竭,SERCA2下降的水平越趋明显。所以,SERCA2表达下降是心脏收缩不良、心肌细胞扩大导致心力衰竭的主要原因之一。本实验结果显示,M组大鼠各时间点心肌组织SERCA2蛋白含量均显著降低。与M组比较,H组能使大鼠心肌组织SERCA2表达量增加,提示其抗心肌肥厚和心室重构作用可能与其通过减轻心肌细胞钙超负荷有关。近期的研究确定miR-25可以阻断SERCA2基因,从而延缓慢性心力衰竭的进程[20],这为进一步研究中医药作用机制提供了方向。
总之,心复康丸的抗心肌肥厚和心室重塑作用可能是其可广泛参与miRs调控网络,通过直接或间接调节相关miRs的表达,恢复miRs与靶因子之间的动态平衡,促进机体恢复阴阳平衡状态,是多途径、多靶点综合起效的结果。而且,心复康丸抗心肌肥厚和心室重构作用存在一定量效关系,高剂量优于低剂量。
| [1] | Go AS, Mozaffarian D, Roger VL, et al. Executive summary:heart disease and stroke statistics-2014 update:a report from the American Heart Association[J]. Circulation, 2014, 129 (3): 399–410. DOI:10.1161/01.cir.0000442015.53336.12 |
| [2] | Yancy CW, Jessup M, Bozkurt B, et al. 2013 ACCF/AHA guideline for the management of heart failure:a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines t[J]. J Am Coll Cardiol, 2013, 128 (16): 1810–1852. |
| [3] | Yang J, Xu WW, Hu SJ. Heart Failure:Advanced Development in Genetics and Epigenetics[J]. Biomed Res Int, 2015 : 1–11. |
| [4] | 石秀梅, 高克俭. 心复康丸治疗冠心病心功能不全30例临床观察[J]. 河北中医, 2004, 26 (8): 594. |
| [5] | 高克俭, 石秀梅, 傅莲英, 等. 心复康丸对冠心病心功能及心室重塑影响的研究[J]. 天津中医药, 2005, 22 (1): 22–24. |
| [6] | 施乐. 心复康丸治疗慢性心力衰竭伴发阵发性心房颤动的临床研究[J]. 河北中医, 2012, 34 (7): 975–978. |
| [7] | Desjardins S, Mueller RW, Cauehy MJ. A pressure overload model of congeative heart failure in rats[J]. Cardiovascular Research, 1988, 22 (10): 696–702. DOI:10.1093/cvr/22.10.696 |
| [8] | Pfaffl MW. A new mathematical model for relative quantification in real-time RT-PCR[J]. Nucleic Acids Res, 2001, 29 (9): e45. DOI:10.1093/nar/29.9.e45 |
| [9] | 王锦鸿, 史欣德, 李婴, 等. 新编常用药物手册[M]. 北京: 金盾出版社, 1994: 64 |
| [10] | 马宗超, 唐智宏, 张海. 谈附子的药理及临床应用[J]. 时珍国医国药, 2004, 15 (11): 790. |
| [11] | 孙延涛, 孙琦. 黄芪的药理作用研究[J]. 黑龙江医药, 2007, 20 (3): 256–257. |
| [12] | Li JZ, Dong XM, Wang ZP, et al. MicroRNA-1 in cardiac diseases and cancers[J]. Korean J Physiol Pharmacol, 2014, 18 (5): 359–363. DOI:10.4196/kjpp.2014.18.5.359 |
| [13] | Heidersbach A, Saxby C, Carver-Moore K, et al. MicroRNA-1 regulates sarcomere formation and suppresses smooth muscle gene expression in the mammalian heart[J]. Elife Sciences, 2013, 2 (1630): 464–478. |
| [14] | Li Q, Song XW, Zou J, et al. Attenuation of microRNA-1 derepresses the cytoskeleton regulatory protein twinfilin-1 to provoke cardiac hypertrophy[J]. J Cell Sci, 2010, 123 (Pt 14): 2444–2452. |
| [15] | Ikeda S, He A, Kong SW, et al. MicroRNA-1 negatively regulates expression of the hypertrophy-associated calmodulin and Mef2a genes[J]. Mol Cell Biol, 2009, 29 (8): 2193–2204. DOI:10.1128/MCB.01222-08 |
| [16] | Sayed D, Hong C, Chen IY, et al. MicroRNAs play an essential role in the development of cardiac hypertrophy[J]. Circ Res, 2007, 100 (3): 416–424. DOI:10.1161/01.RES.0000257913.42552.23 |
| [17] | Karakikes I, Chaanine AH, Kang S, et al. Therapeutic cardiac-targeted delivery of miR-1 reverses pressure overload-induced cardiac hypertrophy and attenuates pathological remodeling[J]. J Am Heart Assoc, 2013, 2 (2): e000078. |
| [18] | Matsui H, MacLennan DH, Alpert NR, et al. Sarcoplasmi creticulum gene expression in pressure overload-induced cardiac hypertrophy in rabbi[J]. Am J Physiol, 1995, 268 (1 pt 1): c252–258. |
| [19] | Zierhut W, Studer R, Laurent D. Left ventricular wall stress and sarcoplasmic reticulum Ca2+-ATPase gene expression in renal hypertensive rats:dose-dependent effects of ACE inhibit]ion and AT 1-receptor blockade[J]. Cardi ovasc Res, 1996, 31 (5): 758–768. |
| [20] | Wahlquist C, Jeong D, Rojas-Muñoz A, et al. Inhibition of miR-25 improves cardiac contractility in the failing heart[J]. Nature, 2014, 508 (7497): 531–535. DOI:10.1038/nature13073 |
2. Intensive Care Unit of Tianjin Beichen District Chinese Medicine Hospital, Tianjin 300400, China;
3. Pharmacy Department of Tianjin Children's Hospital, Tianjin 300134, China
 2017, Vol. 34
2017, Vol. 34