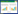文章信息
- 王欢, 王庆甫, 杨黎黎, 张栋, 王伟利, 丁昊彬, 郭玉茹, 杜汪洋, 徐铭康, 甘稳
- WANG Huan, WANG Qing-fu, YANG Li-li, ZHANG Dong, WANG Wei-li, DING Hao-bin, GUO Yu-ru, DU Wang-yang, XU Ming-kang, GAN Wen
- 桂皮醛对滑膜成纤维细胞增殖、凋亡及周期影响的实验研究
- Experimental research on the influence of cinnamic aldehyde on the proliferation, apoptosis and cell cycle of fibroblast-like synovial cells
- 天津中医药, 2017, 34(1): 54-58
- Tianjin Journal of traditional Chinese Medicine, 2017, 34(1): 54-58
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.01.13
-
文章历史
- 收稿日期: 2016-08-21
2. 北京中医药大学第三附属医院, 北京 100029
全球约有多于三分之二的老年人受各种类型的骨性关节炎(OA)困扰[1],并且OA的发病率有逐年增长和年轻化的趋势[2]。而滑膜组织的炎症反应是OA的主要始动和推进因素[3],异常增殖的滑膜成纤维细胞(FLS)能引起软骨细胞的损伤和细胞外基质的降解[4],因此,控制FLS的生长是治疗OA的有效方案之一。研究表明,从樟科植物桂皮的精华油中提取出的生物活性化合物桂皮醛(CA)是OA的有效靶向抗炎剂[5-6],但其具体的抗炎机理尚未有明确阐述。本研究利用四甲基偶氮唑盐微量酶反应比色法(MTT)和流式细胞术(FCM)对不同浓度的CA作用下的FLS的增殖、凋亡和周期进行检测,全面分析CA对FLS生长的影响与抗炎作用的关系,进一步揭示其对OA的调控机制,为OA的治疗提供数据支持。
1 材料 1.1 试剂桂皮醛(纯度≥ 98%)(源叶生物,中国);DMEM/F12培养基、胎牛血清、0.25%胰蛋白酶、DPBS缓冲液、PBS缓冲液(Gibco,美国);IItype-胶原蛋白酶、LPS、MTT、DMSO、PI-RNase(Sigma,美国);Annexin V-FITC /PI凋亡试剂盒(BD,美国)。
1.2 细胞来源无菌的新鲜滑膜组织取自北京中医药大学第三附属医院和望京医院行关节置换手术患者的膝关节,胶原酶法分离培养[7]。
2 方法 2.1 MTT法检测CA对FLS增殖的影响选取正处于对数生长期的生长状态良好的FLS,用培养液稀释成1×105个/mL密度的细胞悬液,每孔100 μL接种于96孔培养板中培养过夜。次日,吸弃孔内液体后,分别加入500、250、62.5、15.625、3.90625、0 μg/mL浓度的CA溶液,每孔100 μL,每组均设5个重复孔。恒温二氧化碳培养箱孵育48 h后,用PBS缓冲液清洗各孔内残余液体,加入MTT孵育4 h。将各孔内液体小心吸弃干净加入DMSO每孔100 μL,摇床慢速溶解蓝紫色结晶后置于酶联免疫检测仪490 nm处波长下检测各孔吸光值(用A表示)。以细胞生长抑制率(IR)和存活分数(SF)来反映不同浓度的CA对FLS增殖的影响,计算公式:IR(%)=(A对照-A药液)/A对照×100;SF(%)= A药液/A对照×100。根据计算结果,选取不影响FLS活力的浓度作为后续流式细胞仪相关检测的细胞处理药液浓度。
2.2 FLS处理及检测样本制备分别配制各组干预药液:CA高浓度组(1 μg/mL LPS+10 μg/mL CA);CA低浓度组(1 μg/mL LPS+1 μg/mL CA);对照组(1 μg/mL LPS);空白组(细胞培养液)。加入LPS诱导24 h后的FLS中,温育48 h后用不含EDTA的胰蛋白酶消化细胞至EP管中,PBS溶液清洗两次备用。
2.3 流式细胞术检测细胞周期将上述收集的细胞样本用多聚甲醛固定1 h后,1000 rmp/min离心5 min,加入预冷的乙醇重悬,-20 ℃冰箱储存备用。上机检测前,用PBS缓冲液清洗各管内乙醇两次,加入500 μL的PI-RNase染液混匀,室温避光孵育15 min,滤膜过滤至流式管中用流式细胞仪(FACSCantoTMⅡ型,美国BD公司)检测。
2.4 流式细胞术检测细胞凋亡将2.2中收集的细胞样本用100 μL 1×Binding Buffer重悬,分别加入5 μL FITC-Annexin V和5 μL PI混匀,室温避光孵育15 min后,再加入400 μL 1×Binding Buffer,滤膜过滤至流式管中流式细胞仪检测。
2.5 数据的处理及分析采用FACSDiva Version 6.1.3软件对凋亡相关数据进行分析,采用ModFit LT V3.3.11软件对细胞周期相关数据进行分析。所有检测所获得的数据资料均表示为均数±标准差(x±s)的形式,并用SPSS 18.0统计软件对其进行统计分析,组间比较均采用单因素方差分析(ANOVA),两两比较采用卡方χ2检验,P<0.05检验水平为差异显著,结果有统计学意义。
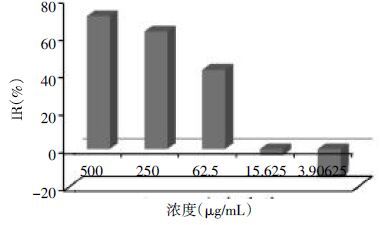
3 结果 3.1 不同浓度的CA对FLS增殖的影响5个浓度梯度的CA溶液对体外FLS增殖的影响有一定的差异,具体表现为:较低浓度的CA对FLS的生长有微弱的促进作用,但随着CA浓度的不断增高,对FLS生长的抑制作用呈递增趋势,较高浓度CA可使FLS的存活率显著降低(P<0.05),呈明显的浓度依赖性。结果见图 1、图 2。
|
| 图 1 不同浓度的CA对FLS抑制率的影响 Fig. 1 Influence of different concentration of CA for the IR of FLS |
|
| 图 2 不同浓度的CA对FLS存活分数的影响 Fig. 2 Influence of different concentration of CA for the SF of FLS |
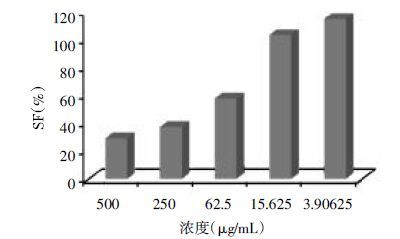
从Annexin V-FITC /PI荧光双标记参数图(图 3)结合数据(表)可见,对照组较未经LPS诱导的空白组Q2和Q4区的细胞比率均明显减少(P<0.05),说明LPS同时减缓了FLS的早期凋亡和晚期凋亡,并减少了坏死细胞比率,对FLS的生长有促进作用,炎症模型模拟成功。与对照组相比,CA高浓度组与低浓度组的Q2和Q4区细胞比率明显增加(P<0.05),说明CA能诱导FLS凋亡,尤其是CA高浓度组的细胞凋亡最为显著,而且有一小部分细胞开始坏死。各组Q1区细胞数量均少于5%,说明在收集过程中因为操作等原因引起的机械损伤较少。大部分的细胞都位于Q3正常活细胞区,也能间接地反映CA较小的细胞毒性。
|
| 图 3 CA对FLS凋亡的影响 Fig. 3 Influence of CA for the apoptosis of FLS |
从细胞周期分布图(图 4)结合数据(表 2)中可以看出,对照组G1期细胞比率明显低于空白组,而S期则明显高于空白组,说明LPS对FLS的增殖有显著的促进作用,造模成功。与对照组相比,CA高浓度组与低浓度组均能使细胞的G1期延长、S期缩短(P<0.05),说明CA可能通过对影响细胞周期的某种相关因子的抑制使更多的细胞停滞于DNA复制尚未开始的G1期,同时减少了一倍体DNA复制成二倍体DNA的S期的细胞比率,从而抑制FLS的增殖。其中,CA高浓度组比低浓度组对FLS增殖的抑制作用更强。
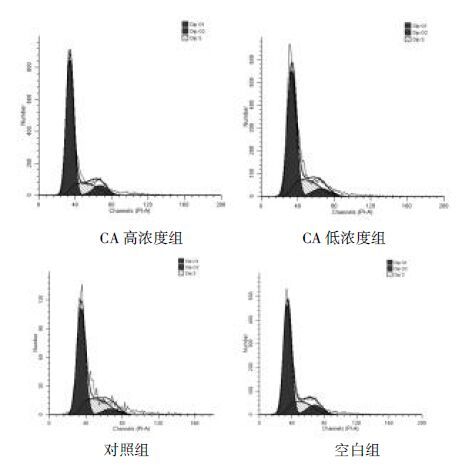
|
| 图 4 CA对FLS周期的影响 Fig. 4 Influence of CA for the cell cycle of FLS |
| 组别 | 早期凋亡率 | 晚期凋亡率 | 总凋亡率 |
| CA高浓度组 | 11.5±2.69 | 9.8±3.42 | 21.3±6.11 |
| CA低浓度组 | 06.7±1.24 | 7.1±2.97 | 13.8±4.21 |
| 对照组 | 03.9±1.54 | 1.7±0.94 | 05.6±2.48 |
| 空白组 | 05.6±0.78 | 03±0.66 | 08.6±1.44 |
| 组别 | G1 | G2 | S |
| CA高浓度组 | 70.04±6.29 | 9.48±2.23 | 20.48±3.61 |
| CA低浓度组 | 66.86±5.70 | 8.17±2.20 | 24.97±2.53 |
| 对照组 | 64.31±4.58 | 7.32±1.27 | 28.37±4.44 |
| 空白组 | 66.44±6.29 | 11.1±3.74 | 22.46±2.19 |
细胞的凋亡和周期情况是反映该细胞增殖活性的最客观的指标[8]。细胞凋亡是指细胞自主而有序的死亡过程,是维持机体内环境稳态的一种非病理非被动的自体损伤现象。病理状态下的细胞凋亡大多应用在肿瘤相关的研究中作为药物干预的有效目标[9],但实际上,细胞凋亡的紊乱也与其他疾病的进展密切相关,属疾病过程中重要的调节机制之一。Annexin V-FITC /PI荧光双标记染色法是目前检测细胞凋亡的最常用方法之一,既可特异性的区分正常、凋亡及坏死细胞并给出准确的细胞分布比率,更重要的是,还可检测出的早期细胞凋亡先于细胞形态的改变。而一个细胞周期就是细胞由一次分裂完成至下一次分裂完成所经历的时间。利用处于有丝分裂过程中细胞DNA加倍的原理,通过PI对DNA的标记,检测其发出的荧光信号,并用积分面积表示,进而反应细胞的周期变化,是区分细胞周期各阶段的有效方法。细胞凋亡和周期直接反映细胞的增殖活性,其失衡是引起各种疾病的重要因素[10]。
OA作为关节疾病最常见的形式[11],以活动相关的疼痛、渐进破坏的关节结构和降低的生活质量为主要特征[12],影响着全球数以百万计的人群[13-14],是老年人最主要的致残原因[15]。其发病原因是多方面的,与年龄、性别、种族和对遗传的敏感性、骨质密度、雌激素水平、膳食营养情况等均有关[16]。在OA的发病进程中,生物力学因素和炎症反应扮演着重要的角色,影响着包括滑膜(SM)、软骨、软骨下骨等整个关节结构[17]。声和磁共振成像已检测到了早期和晚期OA中的滑膜炎症,它甚至存在于没有明显OA临床症状的关节中[18]。越来越多的证据肯定了滑膜炎症在OA病原学中的意义[19-20]。作为关节慢性炎症反应的主要位置和软骨及周围组织破坏的主要的参与者,其发生所释放的炎性因子和关节损伤介质不仅可以降解软骨基质导致渐进的软骨溶解,还能影响钙化软骨区的软骨下骨,入侵深层的透明软骨[21]。因此,以滑膜炎症为目标的研究可以为OA的治疗提供相当大的有益作用。正常的SM是一个富含细胞的薄层内膜,主要由疏松结缔组织细胞、血管和淋巴管组成。OA滑膜炎症症状和体征的形成是多种细胞类型共同的协调行为,除了巨噬细胞和T细胞,FLS作为滑膜组织的重要组成部分,在参与炎症的传播和关节的损伤中发挥着至关重要的发起和推动作用[22]。它们除了生产透明质酸营养润滑关节腔各组织结构之外,还有间充质干细胞(MSC)属性能诱导软骨形成和强大的再生潜力[23]。而且,炎症细胞的浸润也归因于FLS的增殖和对细胞凋亡的对抗,这也被认为是OA的主要特征之一。在疾病条件下,由于SM衬里层激活的FLS延长的生命期限,使其不断的的增生和侵略性增长使得内膜层和内膜下层加速增厚,导致缺氧诱导因子和促炎性细胞因子共存在OA的病变滑膜,而这些因子反过来可使FLS产生趋化因子分泌多种细胞因子、降解酶和花生四烯酸,代谢物进一步加重组织缺氧、促进血管生成,最终会形成一个称为血管翳的多层的肉芽组织,进一步入侵软骨和骨的界面,导致渐进的关节和软组织破坏。因此,FLS作为滑膜炎症的关键调节器,针对其增殖、凋亡、周期的干预也为干扰OA主要疾病过程提供潜在的机会。国际上建议将OA治疗的主要焦点放在对症状的控制上[24]。但止痛剂对控制OA相关疼痛的效果仅仅略优于安慰剂且是短暂的,其他的包括手术或应用抗炎药物等的治疗方法没有一种可以促进软骨再生或能永久性的改善初始损伤[25]。因此,新的药物需要既能减轻疼痛又能延缓疾病的进展。最新的研究发现,中国传统中草药中分离出的某些活性成分能在包括OA的各种慢性炎症性疾病中控制疼痛和抑制炎症反应。CA作为中药桂枝的主要活性成分,就是这样一种新型的具有免疫调节功能的抗炎剂。
在这项研究中,课题组针对OA的一个主要特点即FLS的侵略性生长和疾病本身对FLS凋亡的抵抗,测试CA在FLS的增殖、凋亡、周期方面的干预作用,及其间接表现出的软骨保护的潜力,以期从OA的潜在机制上探寻CA的对OA的药理作用。MTT实验中课题组发现,FLS对CA的调节呈浓度依赖性:高浓度的CA对FLS的生长有明显的抑制作用,而这种抑制作用随着CA浓度的降低而减弱;低浓度的CA则对FLS有轻微的促进作用。在流式细胞仪分析PI和Annexin V双荧光标记的FLS检测细胞凋亡的实验中,显示CA主要通过诱导FLS的早期凋亡进而起到抑制FLS增殖的作用;在流式细胞仪分析PI-RNase标记的FLS检测细胞周期的实验中,显示CA诱导细胞复制的S期细胞周期阻滞,而延长复制前间歇期G1 期。综上所述,得出这样的结论:在体外,CA可通过诱导FLS凋亡和周期阻滞来抑制其增殖,进而调控OA滑膜炎症反应。这个结果为未来探寻治疗OA药物的作用机制及对OA的理想治疗需求的满足提供了实验数据支持。
| [1] | Wehling P, Reinecke J. Composition comprising interleukin-1 receptor antagonist and corticosteroid, US8828946[P]. 2014. http://cn.bing.com/academic/profile?id=bc39c5ea029cd4b88d6ba5e4bda53e89&encoded=0&v=paper_preview&mkt=zh-cn |
| [2] | Conaghan PG, Porcheret M, Kingsbury S R, et al. Impact and therapy of osteoarthritis:the Arthritis Care OA Nation 2012 survey[J]. Clinical Rheumatology, 2015, 34 (9): 1–8. |
| [3] | Cillero-Pastor B, Eijkel G, Blanco F, et al. Specific peptide distribution in human osteoarthritic synovial membranes reveals different grades of tissue inflammation[J]. Osteoarthritis & Cartilage, 2014, 22 (4): S48–S49. |
| [4] | Sun S, Bay-Jensen AC, Karsdal MA, et al. The active form of MMP-3 is a marker of synovial inflammation and cartilage turnover in inflammatory joint diseases[J]. Bmc Musculoskeletal Disorders, 2014, 15 (4): 618–618. |
| [5] | Mendes SJF, Sousa FIAB, Pereira DMS, et al. Cinnamaldehyde modulates LPS-induced systemic inflammatory response syndrome through TRPA1-dependent and independent mechanisms[J]. International Immunopharmacology, 2016, 34 : 60–70. DOI:10.1016/j.intimp.2016.02.012 |
| [6] | Hanc D, Altun H, Cetinkaya EA, et al. Cinnamaldehyde is an effective anti-inflammatory agent for treatment of allergic rhinitis in a rat model[J]. International Journal of Pediatric Otorhinolaryngology, 2016, 84 : 81–87. DOI:10.1016/j.ijporl.2016.03.001 |
| [7] | 王欢, 王庆甫, 杨黎黎, 等. 基于体外细胞模型的建立探讨通络止痛方对滑膜炎症反应的影响[J]. 长春中医药大学学报, 2016, 4 : 684–687. |
| [8] | Manzano-Moreno FJ, Ramos-Torrecillas J, Luna-Bertos ED, et al. High doses of bisphosphonates reduce osteoblast-like cell proliferation by arresting the cell cycle and inducing apoptosis[J]. Journal of cranio-maxillo-facial surgery:official publication of the European Association for Cranio-Maxillo-Facial Surgery, 2015, 43 (3): 396–401. DOI:10.1016/j.jcms.2014.12.008 |
| [9] | Mullard A. Pioneering apoptosis-targeted cancer drug poised for FDA approval[J]. Nature Reviews Drug Discovery, 2016, 15 (3): 147–149. DOI:10.1038/nrd.2016.23 |
| [10] | Ghosh R, Alajbegovic A, Gomes AV. NSAIDs and Cardiovascular Diseases:Role of Reactive Oxygen Species[J]. Oxidative Medicine & Cellular Longevity, 2015, 15 (12): 15–17. |
| [11] | Moghimi J. Educational paper on osteoarthritis[J]. La Medicina Del Lavoro, 2014, 105 (3): 231–233. |
| [12] | Marks R. A Review on the Management of Hip and Knee Osteoarthritis[J]. Pain Studies & Treatment, 2015, 3 (2): 7–22. |
| [13] | Schween R, Gehring D, Gollhofer A. Immediate effects of an elastic knee sleeve on frontal plane gait biomechanics in knee osteoarthritis[J]. Plos One, 2015, 10 (1): e0115782–e0115782. DOI:10.1371/journal.pone.0115782 |
| [14] | Ezra C, Lee Y C. A Mechanism-Based Approach to the Management of Osteoarthritis Pain[J]. Current Osteoporosis Reports, 2015, 13 (6): 1–8. |
| [15] | Sampiero T, Cardoso J, Bush R, et al. Association of socioeconomic factors with pain and function in older adults with knee osteoarthritis[J]. Journal of Pain, 2016, 17 (4): S28. |
| [16] | Runolfsdottir HL, Sigurdsson G, Franzson L, et al. Gender comparison of factors associated with age-related differences in bone mineral density[J]. Archives of Osteoporosis, 2015, 10 (1): 1–9. DOI:10.1007/s11657-015-0203-x |
| [17] | Andriacchi TP, Favre J. The Nature of In Vivo Mechanical Signals That Influence Cartilage Health and Progression to Knee Osteoarthritis[J]. Current Rheumatology Reports, 2014, 16 (11): 1–8. |
| [18] | Hall M, Doherty S, Courtney P, et al. Synovial pathology detected on ultrasound correlates with the severity of radiographic knee osteoarthritis more than with symptoms[J]. Osteoarthritis & Cartilage, 2014, 22 (10): 1627–1633. |
| [19] | Sandell L J. Etiology of osteoarthritis:genetics and synovial joint development[J]. Nature Reviews Rheumatology, 2012, 8 (2): 77–89. |
| [20] | Utomo L, van Osch GJ, Bayon Y, et al. Guiding synovial inflammation by macrophage phenotype modulation:an in vitro study towards a therapy for osteoarthritis[J]. Osteoarthritis & Cartilage, 2016 . |
| [21] | Ho-Joong Kim, Jin S. Yeom, Yong-Gon Koh, et al. Anti-inflammatory effect of platelet-rich plasma on nucleus pulposus cells with response of TNF-α and IL-1[J]. Journal of Orthopaedic Research:official Publication of the Orthopaedic Research Society, 2014, 32 (4): 551–556. DOI:10.1002/jor.v32.4 |
| [22] | Canete JD, Celis R, Yeremenko N, et al. Ectopic lymphoid neogenesis is strongly associated with activation of the IL-23 pathway in rheumatoid synovitis[J]. Annals of the Rheumatic Diseases, 2015, 17 (Suppl 1): 1–12. |
| [23] | Kubosch EJ, Heidt E, Bernstein A, et al. The trans-well coculture of human synovial mesenchymal stem cells with chondrocytes leads to self-organization, chondrogenic differentiation, and secretion of TGFβ[J]. Stem Cell Research & Therapy, 2016, 7 (1): 1–11. |
| [24] | Stukstette MJ, Dekker J, Broeder AAD, et al. No evidence for the effectiveness of a multidisciplinary group based treatment program in patients with osteoarthritis of hands on the short term; results of arandomized controlled trial[J]. Osteoarthritis & Cartilage, 2013, 21 (7): 901–910. |
| [25] | Balmaceda CM. Evolving guidelines in the use of topical nonsteroidal anti-inflammatory drugs in the treatment of osteoarthritis[J]. Bmc Musculoskeletal Disorders, 2014, 15 (1): 1–5. DOI:10.1186/1471-2474-15-1 |
2. The Third Affiliated Hospital of Beijing University of Chinese Medicine, Beijing 100029, China
 2017, Vol. 34
2017, Vol. 34