文章信息
- 温时媛, 陈燕燕, 李晓男, 王跃飞, 姜苗苗
- WEN Shi-yuan, CHEN Yan-yan, LI Xiao-nan, WANG Yue-fei, JIANG Miao-miao
- 黄花夹竹桃叶中总强心苷的快速提取及含量测定研究
- Study on a rapid extraction method and content determination method of total cardiac glycosides from leaves of Thevetia peruviana
- 天津中医药, 2017, 34(1): 59-61
- Tianjin Journal of traditional Chinese Medicine, 2017, 34(1): 59-61
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.01.14
-
文章历史
- 收稿日期: 2016-08-25
2. 天津国际生物医药联合研究院, 中药新药研发中心, 天津 300457
黄花夹竹桃[Thevetia peruviana (Pers.) K. Schum.]为夹竹桃科Apocynaceae黄花夹竹桃属Thevetia Linn.植物[1-2]。主要分布于广东、福建等地。其根、枝、叶、果仁、种子中都含有多种强心苷类,目前分离鉴定出的强心苷均为甲型强心苷[3-10]。
质子核磁共振(1H-NMR)可以提供化合物结构确证的定性信息,也可以提供含量测定的定量信息,且该方法简便易行,专属性强,无需复杂前处理和预分离,因此被广泛应用于药物、食品、农业等领域,且中国2010版药典将1H-NMR收载在附录中[11]。
1 仪器与材料Bruker AvanceⅢ 600型超导核磁共振波谱仪,质子激发频率600.23 MHz,配置BBFO正相观察宽带探头和BVT3200数字控温仪;FDU-1200冷冻干燥机(上海爱朗仪器有限公司);A1204 万分之一电子天平(梅特勒-托利多仪器(上海)有限公司);5 mm标准核磁样品管(美国Norell公司);重水(D2O)氘代度 > 99.8%(美国Sigma-Aldrich公司);3-(三甲基甲硅烷)丙酸钠-d4(TSP)氘代度 > 98%(美国Sigma-Aldrich公司)。
黄花夹竹桃叶子,分别于2015年4月和10月采集于广州市,经鉴定为黄花夹竹桃属Thevetia Linn.植物[Thevetia peruviana (Pers.) K. Schum.]的叶子。
2 方法与结果 2.1 提取方法 2.1.1 甲醇冷浸提取工艺将4月份采集的黄花夹竹桃叶子干燥、粉碎;称取50 g,用15倍量的甲醇溶液冷浸提取2次,合并提取液;将提取液于60 ℃以下减压浓缩至干,加水超声溶解;水作洗脱液过大孔树脂除去色素;将水溶液于60 ℃以下减压浓缩至干,用乙醚洗涤;70 ℃烘干至恒重。
2.1.2 70%乙醇加热回流提取工艺将4月份采集的黄花夹竹桃叶子干燥、粉碎,称取50 g;用15倍量的70%乙醇溶液加热回流提取2次,合并提取液;将其于60 ℃以下减压浓缩至干,加水超声溶解;水作洗脱液过大孔树脂除去色素;将水溶液减压浓缩至少量,用二氯甲烷萃取;将水层冷冻干燥至恒重。
2.1.3 70%乙醇冷浸提取工艺将4月份采集的黄花夹竹桃叶子干燥、粉碎,称取50 g;用15倍量的70%乙醇溶液冷浸提取2次,合并提取液;将提取液中加碳酸钠(Na2CO3)调pH至中性,于60 ℃以下减压回收乙醇至含醇量为10% ~ 20%,于15 ℃以下静置析胶,过夜;次日吸取上清液,减压浓缩乙醇至无醇味;用二氯甲烷萃取,将水层冷冻干燥至恒重。
2.1.4 95%乙醇温浸提取工艺将4月份采集的黄花夹竹桃叶子干燥、粉碎,称取50 g,用15倍量的95%乙醇溶液40 ℃温浸提取2次,合并提取液;将提取液中加Na2CO3调pH至中性,于60 ℃以下减压回收乙醇至含醇量为10%~20%,于15 ℃以下静置析胶,过夜;次日吸取上清液,减压浓缩乙醇至无醇味;用二氯甲烷萃取,将水层冷冻干燥至恒重。
2.2 1H-NMR测定含量方法 2.2.1 内标溶液的配制精密称取0.870 9 g磷酸氢二钾(K2HPO4)、0.600 0 g磷酸二氢钠(NaH2PO4)与5.03 mg内标物TSP于10 mL容量瓶中,用D2O溶解并定容至刻度线,用于所有实验溶剂。
2.2.2 供试品溶液的制备精密称取以上5种方法提取得到的粉末20 mg,每种方法平行3个样品,加入400 μL吡啶和100 μL含2.92 mmol/L TSP的重水,涡旋,得供试品溶液。将其转移至5 mm核磁管,用于1H-NMR测试。
2.2.3 1H-NMR图谱的测定条件将核磁管置于核磁共振仪中,采用水峰抑制脉冲序列测定样品溶液的1H-NMR图谱,其中测试参数及条件为:抑水峰序列zgcppr,观测频率600.23 MHz,测定温度300.6 K,谱宽12 335.5 Hz,90°脉冲宽度13.540 0 μs,采样数据点65 536,扫描次数16次,延迟时间10 s,接受增益32。
2.2.4 1H-NMR图谱处理采用MestReNova软件对1H-NMR图谱进行相位调整、基线校正、定标。
2.2.5 总强心苷含量测定黄花夹竹桃中主要含有甲型强心苷,具有五元不饱和内酯环(Δα β-γ内酯环)的高保守结构特征,该片段中C-22位烯氢在1H-NMR 图谱中δ 5.6~6.0之间显示特征质子信号峰,受C-17位和C-21位质子氢耦合裂分的影响而呈较宽单峰,该信号峰无其他质子峰干扰适用于计算总强心苷的含量。在上述实验条件下采集和处理图谱,对内标TSP甲基和强心苷C-22位烯氢的信号峰分别进行积分,根据以下公式计算总强心苷物质的物质的量浓度:
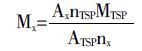 |
其中,ATSP和Ax分别是TSP甲基峰和样品定量峰的积分面积,nTSP 和nx分别代表TSP甲基峰和样品定量峰的质子个数,MTSP和Mx分别是TSP和样品的物质的量浓度。
|
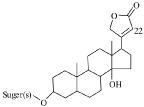
| 图 1 甲型强心苷结构 Fig. 1 Structure of cardenolides |
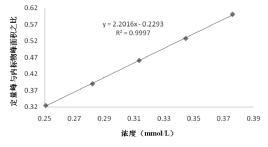
精密称定70%乙醇冷浸提取的总强心苷,按上述方法制成供试品溶液,浓度依次为0.250 7、0.282 1、0.313 4、0.344 7、0.376 1 mmol/L,按上述1H-NMR测试参数及条件测试1H-NMR图谱,记录定量峰积分面积,以质量浓度(mmol/L)为横坐标(X),定量峰与内标物峰面积之比为纵坐标(Y)进行线性回归,得到回归方程为$\hat{y}$=1.825 3X-0.229 3,r2= 0.999 7。其他提取方法的线性考察也可按照上述方法进行。
|
| 图 2 线性关系 Fig. 2 Linear relation |
分别精密称定地高辛、洋地黄毒苷、去乙酰毛花苷0.95 mg,按上述方法制成供试品溶液,浓度为 0.41 g/L,按上述1H-NMR测试参数及条件测试1H-NMR图谱,记录定量峰积分面积,计算强心苷含量。根据以下公式计算误差率:
 |
得出误差率为0.99%。
2.5 实验结果精密称定4种提取方法得到的粉末,1H-NMR内标法计算总强心苷量,结果见表 1。
| 提取方法 | 粉末量(g) | 强心苷量(mol/g) |
| 甲醇冷浸提取 | 7.1657 | 0.0735±0.0007 |
| 70%乙醇加热回流提取 | 8.1586 | 0.2576±0.0065 |
| 70%乙醇冷浸提取 | 8.859 | 0.2008±0.0052 |
| 95%乙醇温浸提取 | 6.3298 | 0.4049±0.0038 |
将10月份采集的黄花夹竹桃叶子采用95%乙醇温浸提取工艺进行总强心苷的提取,得到了7.789 3 g粉末,然后采用上述含量测定方法进行总强心苷含量的测定,得到(0.727 1±0.002 3)mol/g。
2.7 定量限定量限是指样品中被测物能被定量测定的最低量,常采用信噪比法确定,以信噪比为10:1时相应的量确定定量限。经计算1H-NMR法测定强心苷含量定量限为0.020 4 mmol/L。
3 讨论本实验结果表明,在不同条件下强心苷的提取效果具有较大差异。4种提取工艺的影响因素不同且各有优缺点,包括1)不同提取溶剂的影响,70%乙醇提取的提取率高,甲醇和95%乙醇提取的叶绿素较多。2)不同提取温度的影响,加热回流提取容易破坏强心苷使其分解为苷元且提取的叶绿素和色素较多,40 ℃温浸提取的提取率高且不破坏强心苷。3)不同除色素方法的影响,静置析胶除色素专属性强,优于大孔树脂,大孔树脂除色素会损失强心苷的量,且比较繁琐。
综合考虑以上因素,70%乙醇冷浸提取的提取率最高,但其富集到的强心苷量没有95%乙醇多,确定95%乙醇40 ℃温浸提取工艺为快速提取黄花夹竹桃叶子中总强心苷的最佳提取工艺。同时本实验还考察黄花夹竹桃叶子采集时间对强心苷含量的影响,采集时间不同其总强心苷的含量也有较大差异,秋季采集的叶子中强心苷量较多。
95%乙醇温浸提取强心苷时,提取的温度定为40 ℃,减压浓缩温度定为60 ℃,对易分解为苷元的强心苷起到一定保护作用。静置析胶法除色素时条件严格,专属性强,需含醇量在10% ~ 20%之间用Na2CO3调pH至中性,调节pH为中性可以避免酸性时苷元的某些羟基取代基脱水。
1H-NMR法具有样品前处理简单、耗时短、无偏向性、谱图直观等优点,能准确检测出样品中有效成分,为中药有效成分的定量测定提供了一种快速简便的手段。从黄花夹竹桃中分离鉴定的强心苷均为甲型强心苷,而甲型强心苷结构中Δαβ-γ内酯环C-22位烯氢质子在5.6 ~ 6.0之间呈较宽单峰,从而可以利用1H-NMR法快速测定出总强心苷量。
| [1] | 杨仓良. 毒药本草[M]. 北京: 中国中医药出版社, 1993 |
| [2] | 江苏新医学院. 中药大辞典[M]. 上海: 上海科技出版社, 1986 |
| [3] | Kohls S, Scholz-Böttcher BM, Teske J, et al. Cardiac glycosides from Yellow Oleander (Thevetia peruviana) seed[J]. Phytochemistry, 2012, 75 : 114–127. DOI:10.1016/j.phytochem.2011.11.019 |
| [4] | Tian DM, Cheng HY, Jiang MM, et al. Cardiac glycosides from the seeds of Thevetia peruviana[J]. J Nat Prod, 2016, 79 (1): 38–50. DOI:10.1021/acs.jnatprod.5b00611 |
| [5] | 匡海学. 中药化学[M]. 北京: 中国中医药出版社, 2003 |
| [6] | Jose Manuel CM, Estefania BM, Manuel Luis O, et al. Evaluating the cancer therapeutic potential of cardiac glycosides[J]. Biomed Res Int, 2014 : 794930. |
| [7] | Cerella C, Dicato M, Diederich M. Assembling the puzzle of anti-cancer mechanisms triggered by cardiac glycosides[J]. Mitochondrion, 2013, 13 (3): 225–234. DOI:10.1016/j.mito.2012.06.003 |
| [8] | Calderon-Montano JM, Burgos-Moron E, Lopez-Lazaro M. The in vivo antitumor activity of cardiac glycosides in mice xenografted with human cancer cells is probably an experimental artifact[J]. Oncog, 2014, 33 (22): 2947–2948. DOI:10.1038/onc.2013.229 |
| [9] | Strese S, Fryknas M, Larsson R, et al. Effects of hypoxia on human cancer cell line chemosensitivity[J]. BMC Cancer, 2013, 13 : 331. DOI:10.1186/1471-2407-13-331 |
| [10] | Wen SY, Chen YY, Lu YF, et al. Cardenolides from the Apocynaceae family and their anticancer activity[J]. Fitoterapia, 2016, 112 : 74–84. DOI:10.1016/j.fitote.2016.04.023 |
| [11] | 中华人民共和国药典委员会. 中华人民共和国药曲(一部)[S]. 北京:中国医药科技出版社, 2015. |
2. Research and Development Center of Traditional Chinese Medicine Tianjin International Joint Academy of Biotechnology and Medicine, Tianjin 300457, China
 2017, Vol. 34
2017, Vol. 34