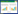文章信息
- 黄瑞, 郭盼, 刘勃缨, 丁苗苗, 张兵, 张丽娜, 刘志东
- HUANG Rui, GUO Pan, LIU Bo-ying, DING Miao-miao, ZHANG Bing, ZHANG Li-na, LIU Zhi-dong
- 藤黄酸纳米结构脂质载体的制备及抗肿瘤作用初步评价
- The preparation and preliminary evaluation of anti-tumor effect of Gambogic acid nanostructure lipid carrier
- 天津中医药, 2017, 34(1): 62-65
- Tianjin Journal of traditional Chinese Medicine, 2017, 34(1): 62-65
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.01.15
-
文章历史
- 收稿日期: 2016-05-07
2. 天津中医药大学, 天津市现代中药重点实验室-省部共建国家重点实验室培育基地, 天津 300193
藤黄(gamboge)为藤黄科植物藤黄树 (Garcinia hanbaryi Hook. f.)分泌的干燥树脂。自古以来就被用于治疗瘰疬、痈疸、疖肿等顽疾[1]。藤黄酸(GA)是藤黄的有效成分之一,现代药理研究报道 GA 对多种肿瘤细胞有潜在抑制作用,包括从白血病病人中提取的肿瘤细胞,及子宫颈癌,胆管癌,肝癌,乳腺癌,胃癌,胶质母细胞瘤和骨肉瘤细胞[2-14]。然而,由于藤黄酸水溶性极差(小于1 μg/mL),刺激性强、体内消除半衰期短[15-16],限制了其在临床上的应用。纳米结构脂质载体(NLC)是第二代脂质纳米载体系统,在继承传统纳米粒能增加难溶性药物的溶解度、降低药物刺激性、延长药物在体内滞留时间等优点的同时,通过向固体脂质加入与其空间上不相容的液体脂质,使药物以结晶缺陷型或无定型结构存在,增加了对药物分子的包容性,提高药物的载药量,克服了固体脂质纳米粒(SLN)在放置过程中药物泄露、包封率降低等现象[17]。
本实验采用乳化-固化法制备纳米结构脂质载体包载藤黄酸,增加其溶解度,对其粒径、电位、包封率进行测定,用差示扫描量热法(DSC)表征其物理性质,同时考察了藤黄酸纳米结构脂质载体(GA-NLC)对人乳腺癌细胞MDA-MB-231的体外抑制作用。
1 材料与试剂 1.1 仪器Nano ZS型激光散射粒径分析仪(Malvern,英国),超滤离心管(100KD)、Milli-Q 超纯水系统(Millipore,美国),冷冻离心机(Thermo,美国),岛津高效液相色谱仪LC-20A(日本),Jade型差示扫描量热仪(PerkinElmer,美国),infinite M200型多功能酶标仪(Tecan,瑞士)。
1.2 试剂藤黄酸(四川省维克奇生物科技有限公司,≥98%,批号130927);卵磷脂(Lipoid S-100,上海东尚实业有限公司);聚氧乙烯(40)硬脂酸酯(Myrj52,南京威尔化工有限公司);山嵛酸甘油酯ATO888(Gattefosse,法国);辛酸/癸酸三甘油酯(Miglyol812,北京凤礼精求商贸有限公司);三氯甲烷、乙醇(分析纯,天津康科德科技有限公司);甲醇(色谱纯,天津康科德科技有限公司);DMSO(Gibco);L-15(Corning);胎牛血清(Gibco);PBS(Corning);CCK-8(东仁化学科技(上海)有限公司)。(Gibco);PBS(Corning);CCK-8(东仁化学科技(上海)有限公司)。
2 方法与结果 2.1 藤黄酸NLC的制备采用乳化-固化法制备GA-NLC。将处方量的的山嵛酸甘油酯(Compritol ATO888)、液体脂质辛酸/癸酸三甘油酯(Miglyol812)溶于三氯甲烷,藤黄酸和卵磷脂溶于无水乙醇,在74~75 ℃水浴中混合均匀构成油相;将处方量的Myrij52溶于水构成水相,在磁力搅拌条件下,将有机相注入74~75 ℃的水相中,搅拌均匀至澄清,至于4 ℃条件下冷藏固化2 h即得GA-NLC。
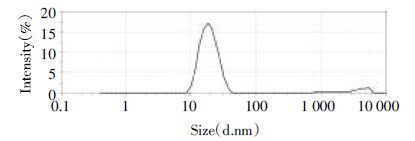
2.2 粒径、Zeta电位的测定取GA-NLC溶液适量,用蒸馏水稀释20倍,经0.22 μm微孔滤膜过滤后,采用Zetasizer激光粒度仪测定其粒径和Zeta电位。粒径为(20.96±1.13) nm,见图 1,Zeta电位为-(5.86±0.64) mA,见图 2。
|
| 图 1 GA-NLC粒径分布图 Fig. 1 Particle size distribution of GA-NLC |
|
| 图 2 GA-NLC Zeta电位分布图 Fig. 2 Zeta potential of GA-NLC |
色谱柱为Diamonsil C18(200 mm×4.6 mm,5μm),流动相:甲醇-0.1%磷酸水(95∶5),检测波长:360 nm,流速:1 mL/min,柱温:30℃,进样量:10 μL。
2.3.2 标准曲线的制备精密称取GA 5 mg,加适量甲醇溶解配制成100 μg/mL的GA母液。分别取GA母液适量用甲醇稀释至2、4、6、12、20 μg/mL,进样10 μL,以峰面积(A)对质量浓度(C)做回归曲线,回归方程为A=13 668 C- 4372.4,r2=0.999 1,结果表明GA在2~20.0 μg/mL范围内线性关系良好。
2.3.3 精密度实验取质量浓度为2、6、12 μg/mL的GA甲醇溶液,于1 d内测定3次,计算日内精密度,连续测定3 d,计算日间精密度。结果日内RSD分别为1.20%、0.48%、0.61%,日间RSD 分别为1.85%、1.87%、1.30%,均小于2%,仪器精密度符合要求。
2.3.4 过膜回收率测定取浓度为2、6、12 μg/mL 3种浓度的GA溶液2 mL于100 KD 超滤离心管中,4 000 r/min 离心40 min 后取下层滤液,HPLC测定GA质量浓度(C),过膜回收率=C过膜前/C过膜后。低、中、高三种浓度GA溶液过膜回收率分别为95.62 %、104.26 %、96.60 %。超滤离心管对GA无吸附作用,可用来测定GA-NLC的包封率。
2.3.5 GA-NLC包封率的测定取0.5 mL GA-NLC至10 mL容量瓶中,加入无水乙醇适量,超声40 min使之完全破乳,定容至刻度线。过0.22 μm滤膜,HPLC 测定其浓度,记为C总。另取0.5 mL GA-NLC,放入100 KD超滤离心管中,4 000 rpm离心20 min后取下层滤液,HPLC测定其浓度,记为C游离。由以下公式计算GA-NLC包封率。
包封率(EE)=(1-W游离/W总)×100%
式中,W游离为GA-NLC混悬液中游离药物质量,W总为GA-NLC混悬液中总的药物质量。结果,GA-NLC包封率为(99.46±0.23)%,n=3。
2.4 DSC检测将GA标准品,空白NLC冻干粉,GA-NLC 冻干粉和GA标准品与空白NLC物理混合物(1∶1)适量分别置于坩埚中。以氮气流20 mL/min,加热速率10 ℃/min的条件下,从50 ℃升温到200 ℃,空白铝锅作为对照,记录数据与图谱,见图 3。

|
| 图 3 DSC图谱 Fig. 3 DSC thermogram |
结果显示,GA在74 ℃有相变峰,空白NLC 在65 ℃出现相变峰。比较GA-NLC与物理混合物DSC曲线,物理混合物在74 ℃和65 ℃出现两个相变峰,分别对应空白NLC和GA的相变温度。而GA-NLC的DSC 曲线中,GA单体的相变峰消失,表明GA以无定型形式包裹于纳米粒中与脂质材料形成新的固体结晶。
2.5 细胞毒性实验 2.5.1 MDA-MB-231细胞培养将MDA-MB-231细胞悬浮于细胞培养基(L-15,10%胎牛血清,100 U/ml青霉素,100 mg/L链霉素)并接种于培养瓶中,在37 ℃、5% CO2培养箱中培养两天,达到80%融合时进行传代培养。
2.5.2 细胞活力测定采用CCK-8法评价GA-NLC对人乳腺癌细胞MDA-MB-231的细胞毒性。将MDA-MB-231细胞接种于96孔板中,每孔5 000个,6个复孔。置于细胞培养箱中培养1~2 d,细胞贴壁后将一系列浓度的空白NLC、游离GA溶液、GA-NLC(GA终浓度分别为0.312 5、0.625、1.25、2.5,5、10、20 μmol/L加入细胞培养孔,设置溶剂对照和空白参比孔。给药细胞于细胞培养箱中孵育24 h后吸取培养液,用PBS清洗2~3遍,每孔加入10%的CCK-8溶液(以L-15基培稀释配制)100 μL,在37℃摇床中避光、孵育30 min,用酶标仪测定450 nm波长下的吸光度(A)。按下列公式,计算细胞存活率。
存活率%=(实验组A450-空白组A450)/(对照组A450-空白组A450)×100%
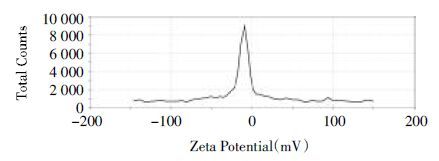
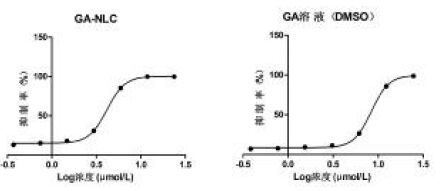
细胞存活率结果见图 5,根据细胞存活率利用GraphPad软件算出GA溶液与GA-NLC的半数抑制浓度(IC50),结果见表 1和图 5。
|
| 图 4 不同浓度GA对MDA-MB-231细胞活力的影响 Fig. 4 Influence on MDA-MB-231 cell vitality of different concentrations of GA |
|
| 图 5 不同浓度GA对MDA-MB-231细胞的抑制率曲线 Fig. 5 Inhibition rate curve of MDA-MB-231 cell by different concentrations of GA |
| 组别 | IC50(μmol/L) |
| GA溶液 | 8.401 |
| GA-NLC | 4.163 |
0.3125~20μmol/L浓度范围内的GA溶液及GA-NLC均能抑制MDA-MB-231细胞的活力,且随着浓度增加,对细胞的抑制作用增强。相同浓度的GA-NLC比GA溶液对体外MDA-MB-231细胞抑制作用更强,GA-NLC的IC50为4.163 μmol/L,GA溶液IC50为8.401 μmol/L,具有显著性差异。
3 讨论藤黄酸作为一种高效低毒的天然抗肿瘤药物,桥环氧杂蒽酮结构是其抗肿瘤效应的基础[18-19]。临床使用的藤黄酸常以注射剂为主,由于藤黄酸水溶性很差,目前报道的藤黄酸原料药主要是使用硼砂溶液溶解配制,或在藤黄酸原料药中加入 L-精氨酸、葡甲胺、赖氨酸等助溶剂或者聚氧乙烯蓖麻油、聚山梨酯等增溶剂改善其溶解度和稳定性[20]。寻找藤黄酸的新剂型是要解决的首要任务。
本实验通过乳化-固化法制备了外观澄清透明、粒径为20 nm左右的GA-NLC,由于所制得的纳米粒粒径较小,葡聚糖凝胶法及高速离心法均不能有效分离游离药物与包载在纳米粒中的药物,故采用离心超滤-HPLC法测定包封率,此方法耗时短,准确率高,重现性好。以人乳腺癌细胞MDA-MB-231细胞为模型研究GA溶液及GA-NLC的体外抗肿瘤作用。结果,不同浓度的GA溶液及GA-NLC 均能一定程度地抑制MDA-MB-231细胞的活力,高浓度的GA溶液及GA-NLC对体外肿瘤细胞有较显著的杀伤作用,且相同浓度的GA-NLC比GA溶液对体外MDA-MB-231细胞抑制作用更强。为排除GA-NLC中辅料对其抗肿瘤作用有干扰,本实验制备了与GA-NLC相同处方的空白NLC,并按照GA-NLC同法稀释至各浓度,考察了空白NLC对MDA-MB-231细胞活力的影响。结果,不同浓度的空白NLC与细胞共孵育24 h后,细胞活力均在70%以上,表明NLC中辅料对MDA-MB-231毒性较小,可以忽略其对GA-NLC抑瘤作用的干扰。藤黄酸是一种多靶点广谱抗肿瘤药,因此,后期实验将进一步考察GA-NLC对其他多种肿瘤细胞的体外抑制作用,并深入开展GA-NLC动物体内抗肿瘤药效学研究,为GA-NLC应用于临床提供充分的实验依据。
| [1] | 杨企铮, 贾淑杰, 李德华. 中药藤黄的近代研究[J]. 中国肿瘤临床, 1994, 6 : 65–67. |
| [2] | Wang Y, Chen Y, Chen Z, et al. Gambogic acid induces death inducer-obliterator 1-mediated apoptosis in Jurkat T cells[J]. Acta Pharmacologica Sinica, 2008, 29 (3): 349–354. DOI:10.1111/aphs.2008.29.issue-3 |
| [3] | Li R, Chen Y, Zeng L, et al. Gambogic acid induces G0/G1 arrest and apoptosis involving inhibition of SRC-3 and inactivation of Akt pathway in K562 leukemia cells[J]. Toxicology, 2009, 262 (2): 98–105. DOI:10.1016/j.tox.2009.04.059 |
| [4] | Zhang L, Yi Y, Chen J, et al. Gambogic acid inhibits Hsp90 and deregulates TNF-α/NF-κB in HeLa cells[J]. Biochemical and biophysical research communications, 2010, 403 (3): 282–287. |
| [5] | Hahnvajanawong C, Boonyanugomol W, Nasomyon T, et al. Apoptotic activity of caged xanthones from Garcinia hanburyi in cholangiocarcinoma cell lines[J]. World J Gastroenterol, 2010, 16 (18): 2235–2243. DOI:10.3748/wjg.v16.i18.2235 |
| [6] | Mu R, Lu N, Wang J, et al. An oxidative analogue of gambogic acid-induced apoptosis of human hepatocellular carcinoma cell line HepG2 is involved in its anticancer activity in vitro[J]. European Journal of Cancer Prevention, 2010, 19 (1): 61–67. DOI:10.1097/CEJ.0b013e328333fb22 |
| [7] | Yang Y, Yang L, You QD, et al. Differential apoptotic induction of gambogic acid, a novel anticancer natural product, on hepatoma cells and normal hepatocytes[J]. Cancer letters, 2007, 256 (2): 259–266. DOI:10.1016/j.canlet.2007.06.014 |
| [8] | Guo QL, You QD, Wu ZQ, et al. General gambogic acids inhibited growth of human hepatoma SMMC-7721 cells in vitro and in nude mice[J]. Acta Pharmacologica Sinica, 2004, 25 : 769–774. |
| [9] | Gu H, Rao S, Zhao J, et al. Gambogic acid reduced bcl-2 expression via p53 in human breast MCF-7 cancer cells[J]. Journal of cancer research and clinical oncology, 2009, 135 (12): 1777–1782. DOI:10.1007/s00432-009-0624-2 |
| [10] | Wang T, Wei J, Qian X, et al. Gambogic acid, a potent inhibitor of survivin, reverses docetaxel resistance in gastric cancer cells[J]. Cancer letters, 2008, 262 (2): 214–222. DOI:10.1016/j.canlet.2007.12.004 |
| [11] | Zhao L, Guo QL, You QD, et al. Gambogic acid induces apoptosis and regulates expressions of Bax and Bcl-2 protein in human gastric carcinoma MGC-803 cells[J]. Biological and Pharmaceutical Bulletin, 2004, 27 (7): 998–1003. DOI:10.1248/bpb.27.998 |
| [12] | Liu W, Guo QL, You QD, et al. Anticancer effect and apoptosis induction of gambogic acid in human gastric cancer line BGC-823[J]. World J. Gastroenterol, 2005, 11 (24): 3655–3659. DOI:10.3748/wjg.v11.i24.3655 |
| [13] | Qiang L, Yang Y, You QD, et al. Inhibition of glioblastoma growth and angiogenesis by gambogic acid:an in vitro and in vivo study[J]. Biochemical pharmacology, 2008, 75 (5): 1083–1092. DOI:10.1016/j.bcp.2007.10.033 |
| [14] | Zhao W, Zhou SF, Zhang ZP, et al. Gambogic acid inhibits the growth of osteosarcoma cells in vitro by inducing apoptosis and cell cycle arrest[J]. Oncology reports, 2011, 25 (5): 1289–1295. |
| [15] | Zhang ZH, Wang XP, Ayman WY, et al. Studies on lactoferrin nanoparticles of gambogic acid for oral delivery[J]. Drug delivery, 2013, 20 (2): 86–93. DOI:10.3109/10717544.2013.766781 |
| [16] | Hao K, Liu XQ, Wang GJ, et al. Pharmacokinetics, tissue distribution and excretion of gambogic acid in rats[J]. European journal of drug metabolism and pharmacokinetics, 2007, 32 (2): 63–68. DOI:10.1007/BF03190993 |
| [17] | Souto EB, Wissing SA, Barbosa CM, et al. Development of a controlled release formulation based on SLN and NLC for topical clotrimazole delivery[J]. International Journal of Pharmaceutics, 2004, 278 (1): 71–77. DOI:10.1016/j.ijpharm.2004.02.032 |
| [18] | Zhang HZ, Kasibhatla S, Wang Y, et al. Discovery, characterization and SAR of gambogic acid as a potent apoptosis inducer by a HTS assay[J]. Bioorganic & medicinal chemistry, 2004, 12 (2): 309–317. |
| [19] | 张百红, 王湘辉. 藤黄酸抑制肿瘤的实验研究进展[J]. 临床肿瘤学杂志, 2010, 06 : 564–566. |
| [20] | Peng LH, Ko CH, Siu SW, et al. In vitro & in vivo assessment of a herbal formula used topically for bone fracture treatment[EB/OL]. http://www.ncbi.nlm.nih.gov/pubmed/20600749. |
2. Tianjin State Key Laboratory of Modern Chinese Medicine Provice and Ministry Co-established State Key Laboratory Cultivation Base, Tianjn University of Traditional chinese Medicine, Tianjin 300193, China
 2017, Vol. 34
2017, Vol. 34