文章信息
- 陈景瑞, 魏静, 倪晶宇, 李敏, 樊官伟
- CHEN Jing-rui, WEI Jing, NI Jing-yu, LI Min, FAN Guan-wei
- 芪参益气滴丸对大鼠心肌缺血再灌注损伤保护作用的研究
- Study on the protective effects of Qishen Yiqi pill on myocardial ischemia reperfusion injury in rats
- 天津中医药, 2017, 34(10): 688-691
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(10): 688-691
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.10.13
-
文章历史
- 收稿日期: 2017-04-08
2. 天津中医药大学第一附属医院, 天津 300193
介入治疗作为急性冠状动脉综合征的主要治疗手段之一,在一定程度上有助于心肌疾病患者的康复,但是由于缺血再灌注损伤的存在,介入治疗并不能完全降低一系列严重的心脏病事件[1]。大量的动物实验和临床观察表明,再灌注后在改善心肌供血的同时又加重了单纯心肌缺血所造成的损伤,诸如心律失常、梗死面积扩大、心室功能下降等状况[2]。血小板在心肌缺血再灌注损伤的发生发展起着至关重要的作用,无论是其介导的炎症反应还是血栓形成都会进一步加剧缺血再灌注带来的损伤[3]。
现代药理学研究表明,芪参益气滴丸具有促进血管新生、抗炎、改善心肌能量代谢、抗血小板聚集、保护受损心肌等诸多药理作用[5]。本研究通过建立大鼠心肌缺血再灌注损伤(IRI)模型来模拟临床缺血性心脏病恢复血供治疗过程,考察芪参益气滴丸对IRI大鼠心脏功能、血流动力学和血小板功能的影响,探讨芪参益气滴丸发挥抗心肌缺血再灌注损伤作用及其机制。
1 实验材料 1.1 实验动物雄性Sprague-Dawley(SD)大鼠,体质量为(220±20)g,SPF级,由中国人民解放军军事医学科学院卫生学环境医学研究所实验动物中心提供,许可证号为SCXK(军)2009-0017。饲养于天津中医药大学动物房。
1.2 实验药物芪参益气滴丸浸膏由天士力制药集团股份有限公司提供;水合氯醛:天津市科密欧化学试剂有限公司,批号:Q/12HB 4218-2009。
1.3 试剂与仪器大鼠6酮前列腺素(6KPG)试剂盒、纤维蛋白原(FIB)检测试剂盒和大鼠环磷酸腺苷(cAMP)试剂盒购于BlueGene Biotech公司;E-选择素检测试剂盒、β-血小板球蛋白(β-TG)检测试剂盒、血栓素B2(TXB2)检测试剂盒和血小板因子4(PF4)检测试剂盒均购于Uscn Life science Inc公司。Vevo2100超高分辨率小动物超声实时影像系统(加拿大),酶标仪(美国PerkinElmer),蔡司解剖显微镜(STEMI2000-C,德国),BIOPAC多导生理记录仪MP100-CE(美国),Millar压力-容积系统(澳大利亚),恒温电热毯。
2 实验方法 2.1 分组与给药随机将大鼠分为假手术组(Sham)和心肌缺血再灌注组(I/R),后者又分为:模型组(I/R),芪参益气高剂量组(QSYQ-H)和低剂量组(QSYQ-L)。芪参益气滴丸给药组依据芪参益气滴丸的成人用量计算大鼠的日用量,实验前称取一定量的浸膏,用0.9%生理盐水分别配成浓度为20 mg/mL相当于芪参益气滴丸浓度60 mg/mL和10 mg/mL相当于芪参益气滴丸浓度30 mg/mL的混悬液。QSYQ-H组大鼠给药量按每天600 mg/kg体重给药,QSYQ-L组大鼠给药量按每天300 mg/kg体重给药。假手术组和模型组大鼠均给予等量生理盐水。每天上午1次,预给药1周,最后1次给药时间为手术前1 h。4组大鼠的进食、进水情况一致。
2.2 IRI模型建立将各组大鼠于术前禁食12 h,自由饮水,记录大鼠体重,用5%水合氯醛(6 mL/kg)腹腔注射麻醉。建立心肌缺血再灌注损伤模型,按照文献[5]进行操作,缺血30 min再灌注2 h。
2.3 超声心动图检测再灌注120 min后,进行大鼠心动超声,详见文献[6]。采用Vevo2100超高分辨率小动物超声实时影像仪,探头为MS-250。使用配套气体麻醉装置,1%氧气+2%异氟烷维持麻醉直到超声结束。在二维模式(B-Mode)下获得胸骨旁左室长切面图,在M-型超声图像下进行测量,选择长轴测量包(PLAX)对大鼠收缩期和舒张期进行测量,所有数据均在实验结束后,采用超声系统自带软件进行分析。
2.4 血流动力学检测超声结束后,用5%水合氯醛按6 mL/kg剂量腹腔注射麻醉,将大鼠固定在鼠板上,进行左室插管,检测血流动力学变化。具体过程按照文献[6]操作,待导管进入左心室后,停止插管。稳定数分钟后同时记录大鼠心率(HR)、左心室收缩压峰值(LVSP)及左心室收缩及舒张最大压力变化速率(±dp/dt max)。
2.5 血浆6KPG、cAMP、E-选择素、β-TG、TXB2、PF4和FIB含量的测定大鼠麻醉后,腹主动脉取血,加入肝素并分离上清液,严格按照试剂盒要求测定。
2.6 统计学处理实验数据用SPSS 17.0软件包进行统计学处理。实验结果以均数±标准差(x±s)进行表示,组间比较采用单因素方差分析(one-way ANOVA),P < 0.05为差异有统计学意义。
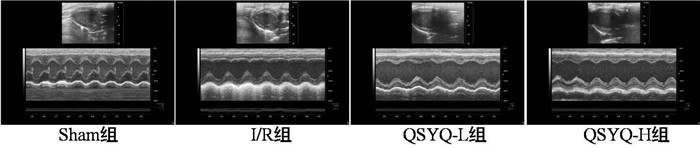
3 结果 3.1 芪参益气滴丸对IRI大鼠心脏功能的影响再灌注120min后,各组大鼠左心室M-Model超声心动图如图 1所示,模型组大鼠较之假手术组左室室壁运动减弱,收缩力下降,经芪参益气滴丸预干预后可以明显改善这一情况。模型组大鼠射血分数(EF)和短轴缩短率(FS)与假手术组相比明显降低(P<0.01),芪参益气滴丸高剂量组和低剂量组与模型组相比,EF和FS显著增加,差异有统计学意义(P<0.01),见表 1。
|
| 图 1 再灌注结束后各组大鼠超声心动示意图 Fig. 1 Echocardiography of rats in each group after the end of the reperfusion |
| % | ||
| 组别 | EF | FS |
| Sham | 72.23±4.45 | 40.72±3.95 |
| I/R | 40.56±3.28* | 20.18±1.86* |
| QSYQ-L | 55.01±3.69# | 28.72±3.59# |
| QSYQ-H | 58.74±3.80# | 29.61±1.04# |
| 注:与Sham组比较,*P < 0.01;与I/R组比较,#P < 0.01。 | ||
血流动力学检测结果显示,模型组大鼠反映左室收缩功能的指标LVSP和+dp/dt max和反映舒张功能的指标-dp/dt max明显低于假手术组,差异有统计学意义(P<0.01);芪参益气滴丸高剂量组大鼠与模型组相比LVSP、+dp/dtmax、-dp/dtmax均显著升高,组间具有统计学差异(P<0.05或P<0.01);芪参益气滴丸低剂量组大鼠LVSP和-dp/dtmax呈现出相似的趋势但无明显差异,而+dp/dtmax较之模型组显著增加,差异具有统计学意义(P<0.01)(表 2)。
| 组别 | LVSP (mmHg) |
+dp/dt max (mmHg/s) |
-dp/dt max (mmHg/s) |
| Sham | 114.49±7.25 | 7 603.92±574.53 | -6582.72±431.11 |
| I/R | 87.22±3.06* | 4 234.84±392.60* | -3 911.16±165.95* |
| QSYQ-L | 92.92±6.28 | 5 386.98±535.44## | -4 083.22±245.59 |
| QSYQ-H | 95.75±4.62# | 5 374.28±419.84## | -4 284.72±299.40# |
| 注:与Sham组比较,*P < 0.01;与I/R组比较,#P < 0.05,##P < 0.01。 | |||
模型组大鼠血浆中E-选择素、PF4、β-TG和FIB含量明显高于假手术组(P<0.01);较之模型组,芪参益气滴丸高、低组大鼠血浆E-选择素、PF4、β-TG和FIB含量显著降低,差异具有统计学意义(P<0.01)(表 3)。
| ng/mL | ||||
| 组别 | E-选择素 | β-TG | PF4 | FIB |
| Sham | 24.04±2.01 | 21.45±3.76 | 580±102.90 | 1443.66±208.04 |
| I/R | 35.25±3.57* | 42.31±6.64* | 1928.12±166.72* | 2175.18±294.11* |
| QSYQ-L | 18.09±2.15# | 26.71±6.53# | 816.01±137.76# | 1 793.23±313.95# |
| QSYQ-H | 23.64±4.69# | 27.39±6.68# | 606.53±126.20# | 1622.04±190.78# |
| 注:与Sham组比较,*P < 0.01;与I/R组比较,#P < 0.01。 | ||||
模型组大鼠血浆中6KPG含量相对于假手术组明显降低,芪参益气滴丸高、低剂量组大鼠血浆6KPG水平较之模型组显著升高,差异具有统计学意义(P<0.05)。与假手术组相比,模型组大鼠血浆中TXB2含量则显著升高;与模型组比较,芪参益气滴丸高、低剂量组大鼠血浆中TXB2水平明显降低,差异有统计学(P<0.01)。
同时,与假手术组相比,模型组6KPG/TXB2水平显著下降(P<0.01);芪参益气滴丸高、低剂量组可明显抑制这一下降趋势,差异有统计学意义(P<0.01);模型组大鼠血浆中cAMP含量较之假手术组显著降低;芪参益气滴丸高、低剂量组大鼠血浆中cAMP含量则明显要高于模型组(P<0.01),差异有统计学(P<0.05或P<0.01),见表 4。
| 组别 | TXB2(pg/mL) | 6KPG(ng/mL) | 6KPG/TXB2 | cAMP(pmol/mL) |
| Sham | 11.67±0.36 | 0.97±0.11 | 83.41±7.84 | 44.11±6.57 |
| I/R | 15.14±2.21** | 0.75±0.03** | 50.31±6.55** | 33.05±8.13* |
| QSYQ-L 1 | 1.50±0.81## | 0.95±0.13# | 83.17±11.00## | 50.83±12.74## |
| QSYQ-H | 10.58±0.54## | 0.91±0.10# | 85.82±10.48## | 47.62±11.14# |
| 注:与Sham组比较,*P < 0.05,**P < 0.01;与I/R组比较,#P < 0.05,##P < 0.01。 | ||||
血小板参与机体正常的止血功能,同时在血栓形成过程中,特别是在动脉血栓和微血管血栓形成的过程中起着关键作用,而血栓形成在心脑血管疾病如不稳定性心绞痛、心肌梗死和动脉粥样硬化等的发生和发展中起着促进作用[7]。
心肌缺血再灌注发生时,内皮细胞受损,前列环素(PGI2)合成减少,血栓素、花生四烯酸作用增强,引起血小板活化并大量聚集[11]。PGI2是抗血小板聚集和舒张血管的生物活性物质,可使微血管舒张、局部血流量增加,而且具有内源性心肌保护作用[12]。但因其生物半衰期短,约3 min,很快降解成稳定的衍生物6-酮-前列腺素(6KPG),在临床上可通过测定6KPG的浓度反应体内PGI2的浓度。正常状态下TXA2和PGI2处于一种平衡状态,两者之间的平衡是调控血管壁紧张度和血小板功能的重要因素。
环磷酸腺苷(cAMP)是血小板的第二信使[13],在血小板功能调节方面起着重要的作用,其主要是通过降低细胞内Ca2+水平,抑制血小板肌球蛋白磷酸化,降低血小板活化程度。同时还具有促进PGI2合成,抑制TXA2合成的作用[14-15],本实验结果显示芪参益气滴丸可以显著增加IRI大鼠血浆中cAMP的含量,这可能是芪参益气滴丸抑制血小板活化,改善IRI大鼠心脏功能的潜在机制之一。
此外,活化的血小板不但能够在微血管中形成血栓,而且还可以调节多种炎性介质的释放[16],增强中性粒细胞等炎症因子向缺血部位浸润[17],介导炎症反应[18]。有证据表明在再灌注的最初的几分钟内血小板是最先募集到梗死区[19],与中性粒细胞和内皮细胞相互作用最终加重心肌缺血再灌注损伤[20]。之前本课题组也实验证实了芪参益气滴丸可以抑制IRI大鼠的炎症反应[5]。
本研究提示芪参益气滴丸发挥抑制血小板活化减轻心肌缺血再灌注损伤的作用,可能是通过增加IRI大鼠血浆中第二信使cAMP的含量,从而抑制血小板肌球蛋白磷酸化,促进前列腺素合成,维持6KFG/TXB2的水平,同时抑制TXB2合成,最终降低血小板活化,减缓血栓形成。芪参益气滴丸在心肌缺血再灌注损伤中的药理学研究还有待进一步深入,为其在临床上开发和应用提供更多的科学依据。
| [1] | Trigueros ML, Gonzalez JM, Rivera J, et al. Hutchinson -Gilford progeria syndrome, cardiovascular disease and oxidative stress[J]. Frontiers in bioscience (Scholar edition), 2011, 3 : 1285. |
| [2] | 徐冬洲. 蓝萼甲素对小鼠心肌缺血再灌注损伤的保护作用及其机制研究[D]. 苏州: 苏州大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10285-1016212374.htm |
| [3] | Gawaz M. Role of platelets in coronary thrombosis and reperfusion of ischemic myocardium[J]. Cardiovasc Res, 2004, 61 : 498–511. DOI:10.1016/j.cardiores.2003.11.036 |
| [4] | Gu JY, Yuan G, Zhu YH, et al. Computational pharmacological studies on cardiovascular disease by Qishen Yiqi Diwan[J]. Sci China Ser B-Chem, 2009, 52 (11): 1871–1878. DOI:10.1007/s11426-009-0274-x |
| [5] | Chen JR, Wei J, Wang LY, et al. Cardioprotection against ischemia/reperfusion injury by QiShenYiQi Pill(R) via ameliorate of multiple mitochondrial dysfunctions[J]. Drug design, development and therapy, 2015, 9 : 3051–3066. |
| [6] | 胡珍, 陈景瑞, 魏静, 等. 冠状动脉结扎制备大鼠心肌梗死模型及评价实验研究[J]. 天津中医药, 2016, 33 (2): 90–95. DOI:10.11656/j.issn.1672-1519.2016.02.08 |
| [7] | 范华英. 丹酚酸A抗血小板及抗血栓作用的研究[D]. 吉林: 吉林大学生命科学学院, 2012: 1. http://cdmd.cnki.com.cn/Article/CDMD-10183-1012365669.htm |
| [8] | 刘红利, 李红蓉, 尹玉洁, 等. 通心络对新西兰兔动脉粥样硬化血小板活化的影响[J]. 中国病理生理杂志, 2016, 32 (6): 1106–1111. |
| [9] | 黄玉芬, 邹励宏, 李辉, 等. 血小板黏附作用相关因子研究进展[J]. 武警后勤学院学报(医学版), 2016, 25 (4): 327–331. |
| [10] | 李冀, 丁莹. 尖叶假龙胆对MIRI大鼠血清中TXB2和6-酮-PGF1的影响[J]. 中医药信息, 2016, 33 (2): 9–11. |
| [11] | 陈秋红, 李钦, 杨伟俊, 等. 黄酮类化合物抗心肌缺血再灌注损伤的相关机制研究进展[J]. 中国临床药理学杂志, 2013, 12 (29): 958–960. |
| [12] | 王峰, 王植荣, 陈建业, 等. 水蛭提取物对冠心病不稳定型心绞痛患者血管内皮功能的影响[J]. 中西医结合心脑血管病杂志, 2013, 110 : 1188–1189. DOI:10.3969/j.issn.1672-1349.2013.10.016 |
| [13] | 李益萍, 罗良国, 沈磊, 等. 速效救心丸对大鼠血小板聚集率及环磷腺苷水平的影响[J]. 中西医结合心脑血管病杂志, 2016, 14 (15): 1729–1732. DOI:10.3969/j.issn.1672-1349.2016.15.010 |
| [14] | 张倩, 陈岑, 杨丰庆, 等. 激动剂诱导血小板活化机制及抗血小板药物研究进展[J]. 中国药科大学学报, 2014, 45 (6): 632–648. DOI:10.11665/j.issn.1000-5048.20140604 |
| [15] | Bhatt DL. Intensifying platelet inhibition-navigating between Scylla and Charybdis[J]. N Engl J Med, 2007, 357 (20): 2078–2081. DOI:10.1056/NEJMe0706859 |
| [16] | Xu Y, Huo Y, Toufektsian MC, et al. Activated platelets contribute importantly to myocardial reperfusion injury[J]. Am J Physiol Heart Circ Physiol, 2006, 290 : H692–699. |
| [17] | Eltzschig HK, Eckle T. Ischemia and reperfusion——from mechanism to translation[J]. Nat Med, 2011, 17 : 1391–1401. DOI:10.1038/nm.2507 |
| [18] | Von Hundelshausen P, Weber C. Platelets as immune cells:bridging inflammation and cardiovascular disease[J]. Circ Res, 2007, 100 : 27–40. DOI:10.1161/01.RES.0000252802.25497.b7 |
| [19] | Massberg S, Enders G, Matos FC, et al. Fibrinogen deposition at the postischemic vessel wall promoters plaatelet adhesion during ischenia-reperfusion in vivo[J]. Blood, 1999, 94 (11): 3829–3838. |
| [20] | Kupatt C, Wichels R, Horstkotte J, et al. Molecular mechanisms of platelet -mediate leukocyte recruitment during mycardial reperfu-sion[J]. J Leukoc Biol, 2002, 72 (3): 455–461. |
2. The First Affiliated Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
 2017, Vol. 34
2017, Vol. 34