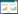文章信息
- 郭岱炯, 孙佳瑜, 陈宝清, 杨玉峰, 郭樱, 华南
- GUO Dai-jiong, SUN Jia-yu, CHEN Bao-qing, YANG Yu-feng, GUO Ying, HUA Nan
- 丹白涂膜剂对黄褐斑大鼠模型抗氧化作用及SCF/C-kit蛋白表达的影响
- Effect of Danbai plastics anti-oxidantion and SCF/C-kit protein expression in cholasma rat model
- 天津中医药, 2017, 34(10): 699-702
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(10): 699-702
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.10.16
-
文章历史
- 收稿日期: 2017-04-10
2. 深圳市福田区中医院, 深圳 518033;
3. 武警北京总队第三医院药剂科, 北京 100141
黄褐斑主要表现为面部皮肤色素沉着,多半由色素代谢障碍所引起,给患者带来生活及精神方面诸多烦恼和痛苦,严重影响了女性的生活质量,对于黄褐斑的研究也越来越深入,多数认为由于皮肤氧化应激增多,自身抗氧化能力下降,以及引起皮肤下的黑色素增多而导致黄褐斑[1]。深入研究发现,干细胞因子(SCF)和C-kit受体在黑色素代谢中起到关键作用[2-4]。研究发现,当一定量的UVB照射时能够促进黑色素细胞增殖和黑色素增多[5],因此,UVB照射是引起黄褐斑的一个重要外因。目前黄褐斑的治疗多采用西医的外治法,但久用毒副作用较大,寻找有效治疗黄褐斑的中医治疗已受到国内外的广泛重视。丹白涂膜剂是在本院传统验方消斑散改良而来,本实验通过建立黄褐斑动物和细胞模型,研究丹白涂膜剂对黄褐斑大鼠模型皮肤抗氧化作用以及对SCF/C-kit蛋白表达的调控作用。
1 实验药品、材料与动物 1.1 药品与试剂氢醌乳膏(批号20160405,规格0.2 g/支)广东人人康药业有限公司生产,黄体酮注射液(批号20160120,规格20 mg/mL)上海通用药业股份有限公司生产,谷胱甘肽过氧化酶(GSH-Px)、丙二醛(MDA)、超氧化物歧化酶(SOD)、一氧化氮(NO)、总抗氧化能力(T-AOC)、组织蛋白测定试剂盒均购于南京建成生物工程研究所。大鼠酪氨酸酶(TYR)ELISA测定试剂盒购于EK-Bioscience公司。兔抗人SCF抗体(英国Abcam公司)、兔抗人多克隆β-actin抗体(北京中杉金桥有限公司)、兔抗C-kit抗体(英国Abcam公司)、生物素标记数二抗(鼠抗兔IgG)(北京普利莱科技有限公司)、1640培养基和胎牛血清(美国Gbico公司)。
1.2 实验动物与细胞雌性SD大鼠,SPF级,40只,体质量为180~220 g,广东省医学实验动物中心提供,SPF级环境饲养。随机分笼饲养。HaCat细胞和黑素细胞购于中科院上海生命科学院细胞资源中心。
2 实验方法 2.1 药物配制与贮藏将丹参、白芷、白附子、茯苓、白鲜皮、白芨、白僵蚕、白薇、蒺藜、防风水提2次,每次2 h,合并,过滤,浓缩,放冷,加入倍量乙醇搅拌均匀,静置48 h。取上清液,回收乙醇,浓缩至适量,部分丹白提取液-20 ℃冰箱低温保存,另一部分加入羟苯乙酯、透皮吸收剂、冰片等制成丹白涂膜剂[6-7]。
2.2 动物模型建立、分组与给药30只雌大鼠, 肌肉注射黄体酮注射液1次/日,7.5 mg/kg,连续注射30 d。并紫外线每日以波长为320 nm的中波紫外线(UVB)照射背部皮肤1次,照射时间30 min,光源的距离为20 cm,模型完成后每只大鼠背部裸露色斑皮肤区域外涂丹白涂膜剂。每日1次,连续30 d。
2.3 HaCat细胞和黑素细胞UVB处理用UVB预照射30 min各细胞组,剂量为30 mJ/cm2,再用不同浓度丹白提取液处理。
2.4 动物皮肤生化指标检测末次给药1 h后,剪取适量照射区皮肤,低温匀浆调至10%。测定皮肤组织中GSH-Px、MDA、SOD、NO、T-AOC、TYR的水平。
2.5 动物皮肤病理学检测末次给药1 h后,取经紫外线照射的脱毛部位皮肤,取背部皮肤,进行苏木精-伊红(HE)染色,进行病理形态学检查。
2.6 检测HaCat细胞和黑素细胞增殖将Hacat细胞和黑素细胞以1×105/mL的密度种植于96孔板,每孔100 μL,分为6组,每组6个复孔,细胞培养箱常规培养24 h,移除培养基,PBS清洗3次后加入丹白提取液浓度分别为0、5、10、20、40、80 mg/mL浓度丹白提取物继续培养24 h后,加入CCK-8试剂,培养箱孵育2 h后,在波长570 nm下测定吸收光度,比较各组OD值。
2.7 HaCat细胞和黑素细胞SCF/C-kit蛋白检测设立空白培养基组、30 mJ/cm2 UVB照射组、20 mg/mL丹白提取物组、30 mJ/cm2 UVB照射+20 mg/mL丹白提取物组,待细胞铺满培养瓶80%时,给药处理后培养24 h。冰上裂解细胞30 min,4 ℃、14 000 r/min、5 min离心,取上清液,蛋白浓度采用BCA试剂盒测定,确定电泳蛋白样品量为35 μg,电泳后转膜至PVDF膜上,封闭后一抗4 ℃过夜。洗膜后二抗室温孵育1 h,洗膜3次,显影拍照。黑素细胞的C-kit蛋白检测与上述方法一致。
2.8 数据处理均以均数±标准差(x±s)表示,用ANOVA进行统计学检验,组间比较P<0.05视为差异有统计学意义。
3 实验结果 3.1 一般观察所有大鼠状态良好。UVB照射2周后,照射后大鼠背部脱毛区皮肤发红;UVB照射4周后,照射后大鼠脱毛区皮肤增厚变硬、结痂、晒伤的症状,但均无水泡溃烂症状。丹白涂膜组给药后症状都有减轻。
3.1 对大鼠皮肤生化指标的影响与对照组比较,模型组大鼠皮肤GSH-Px、SOD、NO、T-AOC明显减少(P<0.05);MDA和TYR明显增加(P<0.05)。与模型组比较,丹白涂膜剂组大鼠皮肤GSH-Px、SOD、T-AOC明显增加(P<0.05);MDA和TYR明显降低(P<0.05),见表 1。
| 组别 | 剂量(g/cm2) | 动物数 | GSH-Px | SOD(u/mg) | NO(μmol/g) | MDA(nmol/g) | T-AOC(u/mg) | TYR(nmol/g) |
| 对照组 | — | 10 | 492.3±132.5* | 82.7±26.5* | 15.80±1.14* | 5.46±1.34* | 8.15±1.26* | 621.3±201.4* |
| 模型组 | — | 10 | 212.4±103.6 | 62.4±18.2 | 8.40±2.56 | 8.97±2.45 | 4.96±0.97 | 904.5±187.6 |
| 氢酿组 | 2 | 10 | 421.6±131.4 | 81.6±22.7 | 9.98±4.17 | 6.01±1.86 | 7.02±1.12 | 692.1±167.6 |
| 丹白涂膜组 | 2 | 10 | 398.7±102.7* | 78.4±11.6* | 8.02±2.67 | 5.92±2.76* | 6.88±2.04* | 742.6±101.4* |
| 注:与模型组比较,*P<0.05。 | ||||||||
对照组大鼠皮肤组织层次清晰,结构完整,未见角质化和炎症细胞浸润。模型组见皮肤表皮层角质化过度,部分溃疡,炎性渗出,钙盐沉积,皮肤组织结构紊乱,大量炎性细胞浸润。氢醌组动物皮肤结构完整,炎症浸润不明显,接近于正常皮肤。丹白涂膜组皮肤未见炎症细胞,组织结构接近于正常皮肤。见图 1。
|
| 图 1 丹白涂膜剂对大鼠皮肤病理学的影响 Fig. 1 Effects of Danbai plastics on dermatopathology |
不同浓度丹白提取物作用于Hacat细胞和黑素细胞24 h后,用CCK-8试剂测定细胞的增殖情况。实验结果表明,当丹白提取物浓度为5 mg /mL时即可抑制HaCat细胞和黑素细胞增殖,丹白提取物浓度20 mg/mL能够对HaCat细胞的增殖产生最大抑制作用(P<0.01)。丹白提取物浓度40 mg/mL对黑素细胞的抑制效应最大(P<0.01),当丹白提取物浓度大于40 mg/mL时,显微镜下可见黑素细胞开始出现坏死、脱落。表 2。
| OD值 | 0 mg/mL | 5 mg/mL | 10 mg/mL | 20 mg/mL | 40 mg/mL | 80 mg/mL |
| HaCat细胞 | 1.52±0.23 | 1.32±0.46* | 0.68±1.14# | 0.50±0.19# | 0.45±0.11# | 0.22±0.09# |
| 黑素细胞 | 1.68±0.42 | 1.47±0.21* | 1.27±0.10* | 0.62±0.23# | 0.51±0.32# | 0.20±0.10# |
| 注:与0 mg/mL组比较,*P<0.05,#P<0.01。 | ||||||
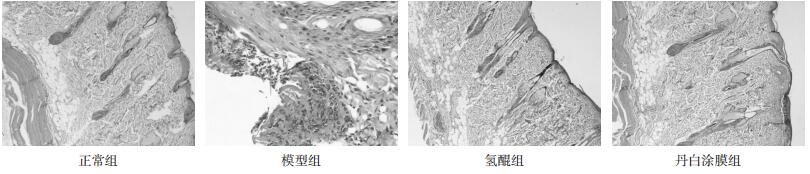
用Western blot法检测Hacat细胞实验各组SCF蛋白表达情况,与空白对照组比较,UVB能够上调Hacat细胞SCF蛋白表达,丹白提取物能够下调细胞SCF蛋白表达,并能够抑制UVB促进Hacat细胞SCF蛋白表达。见图 2。
|
| 图 2 丹白提取物对HaCat细胞SCF蛋白表达影响 Fig. 2 Effect of Danbai extract on SCF expression in HaCat cell |
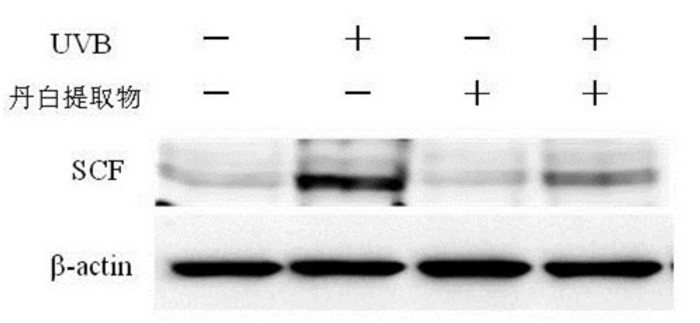
用Western blot法检测黑素细胞实验各组C-Kit蛋白表达情况,与空白对照组比较,UVB能够上调黑素细胞C-Kit蛋白表达,丹白提取物能够下调细胞C-Kit蛋白表达,并能够抑制UVB促进黑素细胞C-Kit蛋白表达。见图 3。
|
| 图 3 丹白提取物对黑素细胞C-Kit蛋白表达影响 Fig. 3 Effect of Danbai extract on C-Kit expression in melanocytes |
黄褐斑好发于中、青年女性,中医认为与肝、脾、肾三脏密切相关,主要病机为气血瘀滞、肝肾亏虚、经络失调等,最终导致面部皮肤养分丧失,诱发色斑。现代医学认为是黄褐斑发生的诱因主要是黑色素代谢障碍,这种代谢障碍可能是由于体内氧化应激过多,抗氧化作用降低等因素造成,进而引起脂质氧化物增多导致酪氨酸氧化过度[8-10]。引发黑色素代谢障碍的原因很多。本研究通过建立黄褐斑大鼠模型,丹白涂膜剂在黄褐斑处涂抹治疗后,检测动物皮肤中的SOD、MDA、T-AOC、NO及GSH-Px来评价丹白涂膜剂的抗氧化能力[11-12]。结果表明,丹白涂膜剂能够增加黄褐斑大鼠皮肤GSH-Px、SOD、T-AOC含量(P<0.05);降低皮肤中MDA和TYR含量(P<0.05),提示丹白涂膜剂能够提高黄褐斑大鼠模型皮肤组织的抗氧化能力。一般观察发现,经过紫外线照射后小鼠的皮肤明显增厚,角质化程度增加,出现结痂和晒伤的症状,通过各实验组治疗后的皮肤病理形态学分析,未经过治疗的模型组小鼠皮肤炎性细胞浸润明显,炎性渗出,皮肤的角质化过度,皮肤结构层次紊乱,模型组的症状和皮肤病理学与动物内分泌紊乱和紫外线照射引起的改变相。氢醌组和丹白提取物组经过治疗后,大鼠的皮肤症状和病理形态都较大幅度的改变,皮肤组织接近于正常。
西医认为人类黄褐斑的产生主要是黑色素在皮肤中增多所致,成熟的黑素小体转过多的转运到角质细胞,并在角质细胞中代谢分解所致黑色素增多,但是黄褐斑发生的真正机制尚不明确。文献表明一定量的UVB照射能够引起黑色素细胞增多,黑色素增多与SCF/KIT途径的表达上调有相关性,是色素沉着的关键因素[5, 13]。本实验通过研究丹白提取物对SCF/C-KIT蛋白表达的调节作用, 实验结果表明丹白提取物能够抑制HaCat细胞/黑素细胞的增殖,并呈剂量依赖性,对细胞增殖的最大效应浓度为20 mg/mL(P<0.01)和40 mg/mL(P<0.01),且对SCF和C-Kit蛋白的表达有抑制作用,同时能够降低UVB对SCF、C-Kit蛋白表达的促进作用。实验结果提示丹白提取物能够抑制与黄褐斑相关的SCF/C-Kit蛋白表达。综上所述,丹白涂膜剂能够增加黄褐斑模型大鼠皮肤的抗氧化能力,丹白提取物能够抑制与黄褐斑形成的相关的SCF和C-Kit蛋白表达,通过本实验为丹白涂膜剂治疗黄褐斑提供了有力的实验依据。
| [1] | Picardo M, Carrera M. New and experimental treatments of cloasma and other hypermelanoses[J]. Dermatol Clin, 2007, 25 (3): 353–362. |
| [2] | Eberle F, Saulich MF, Leinberger FH, et al. Cancer cell motility is affected through 3D cell culturing and SCF/c-Kit pathway but not by X-irradiation[J]. Radiother Oncol, 2016, 119 (3): 537–43. DOI:10.1016/j.radonc.2016.04.036 |
| [3] | Qiu W, Yang K, Lei M, et al. SCF/C -kit signaling is required in 12-O-tetradecanoylphorbol -13-acetate-induced migration and differentiation of hair follicle melanocytes for epidermal pigmentation[J]. Cell Tissue Res, 2015, 60 (2): 333–346. |
| [4] | Zhang Z, Zhu P, Zhou Y, et al. A novel slug-containing negativefeedback lopp regulates SCF/c -Kit -mediated hematopoietic stem cell self-renewal[J]. leukemia, 2017, 31 (2): 403–413. DOI:10.1038/leu.2016.201 |
| [5] | 潘建英, 竺逸. UVA与UVB对人体黑素细胞生长的影响[J]. 环境与职业医学, 2009, 26 (1): 43–45. |
| [6] | Febriyenti AM. Physical evaluations of Haruan spray for wound dressing and wound healing[J]. Int J Drug Deliv, 2011 (3): 115. |
| [7] | 程弘夏, 雷晓璐, 王仲, 等. 正交设计法优化黄柏涂膜剂成膜材料的制备工艺[J]. 化学与生物工程, 2012, 29 (8): 63–66. |
| [8] | Moin A, Jabery Z, Fallah N. Prevalence and awareness of melasma during pregnancy[J]. Int J Dermatol, 2006, 45 (3): 285–288. DOI:10.1111/ijd.2006.45.issue-3 |
| [9] | 陈志伟, 丁爱国, 聂小玲. 女性黄褐斑患者的甲状腺功能测定[J]. 中华皮肤科杂志, 2005, 38 (11): 704–705. DOI:10.3760/j.issn:0412-4030.2005.11.021 |
| [10] | 林新瑜, 罗旭松, 向雪岑, 等. 150例黄褐斑患者发病因素的统计分析[J]. 华西医学, 2003, 18 (3): 329–330. |
| [11] | 金到山, 梅世昌, 王锦传. 大豆异黄酮软胶囊治疗黄褐斑与抗氧化能力的实验研究[J]. 中国美容医学, 2006, 15 (7): 834–835. |
| [12] | 邓红娟, 郭延生, 曲亚玲, 等. 生当归、酒当归和油当归体外清除自由基活性研究[J]. 中草药, 2009, 40 (5): 784–787. |
| [13] | Hachiya A, Sriwiriyanont P, Kobayashi T, et al. Stem cell factor-KIT signalling plays a pivotal role in regulating pigmentation in mammalian hair[J]. J Pathol, 2009, 218 (1): 30–39. DOI:10.1002/path.v218:1 |
2. Shenzhen Futian District Traditional Chinese Medicine Hospital, Shenzhen 518033, China;
3. Department of Pharmacy, The Third Hospital of Beijing Army Police, Beijing 100141, China
 2017, Vol. 34
2017, Vol. 34