文章信息
- 谭宁, 杜守颖, 薛宇涛, 马军明, 陆洋, 李鹏跃
- TAN Ning, DU Shou-ying, XUE Yu-tao, MA Jun-ming, LU Yang, LI Peng-yue
- 几种辅料对葛根素液晶纳米粒粒径、电位、包封率的影响
- Effect of several materials on the particle size, Zeta potential and encapsulation efficiency of Pue-LCN
- 天津中医药, 2017, 34(10): 703-708
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(10): 703-708
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.10.17
-
文章历史
- 收稿日期: 2017-04-28
葛根素(Pue)为治疗缺血性脑中风常用中药—葛根的主要药效成分,疗效确切,药理作用广泛。临床实验表明,具有改善患者神经功能、提高日常生活能力的作用。体外动物实验研究表明,葛根素可以通过扩张脑血管,抑制血小板聚集,清除自由基,抗氧化,对大脑起到保护作用[1-2]。但溶解和吸收不好,油水分配系数为-0.35,溶解度为4.6 mg/mL。也有动物实验显示,静脉注射给药,脑靶向性极差,靶向指数Te不到2%[3-4]。为葛根素寻求一种安全性高、顺应性好、能够迅速发挥药效并且具有良好脑靶向性的给药途径,本实验前期已制备出一种体鼻腔吸收好的新型鼻腔给药制剂——葛根素立方液晶纳米粒(Pue-LCN)。液晶纳米粒(LCN)是两亲性脂质和水自发形成的闭合脂质双层纳米分散体系,与生物膜相类似,促吸收效果好[5-6]。但前期研究显示,采用常用辅料制备的液晶稳定性较差,故本实验拟从几种纳米制剂常用稳定剂(油酸、油酸钠、十八胺、吐温80、维生素E醋酸酯)中优选出适合液晶纳米粒的稳定剂,以提高液晶纳米粒的稳定性。
1 仪器与材料主要仪器:RE52CS旋转蒸发仪(上海亚荣生化仪器厂);Sartorius BT 125D电子分析天平(北京赛多利斯科学仪器有限公司);Techcomp CT15RT高速离心机(上海天美科学仪器厂);Nano series SZ-100型激光粒度仪;LC-20A岛津高效液相色谱仪(四元泵,紫外检测器);偏光显微镜(奥林巴斯BX51);投射式电子显微镜JEM-1230(HC)(日本电子株式会社)。
主要材料:葛根素对照品(食品药品检定研究院);葛根素提取物(北京普博欣生物科技有限责任公司);单油酸甘油酯(浙江嘉兴玛雅试剂);泊洛沙姆407(Lutrol F127,北京凤礼精求商贸有限公司);甘油(北京化工厂,分析纯);油酸;十八胺、油酸钠、吐温80(北京华威锐科);维生素E醋酸酯(阿达玛斯试剂,99%),甲醇(Sigma,色谱纯)。
2 方法 2.1 方法学考察1)线性:分别精密吸取1 mg/mL葛根素对照品溶液0.1、0.2、0.5、1.0、2.0、3.0 mL至25.0 mL容量瓶中,加流动相稀释至刻度,摇匀,HPLC测定峰面积。以浓度为横坐标,峰面积为纵坐标绘制标准曲线,并进行线性回归。2)精密度选择标准曲线中一个浓度(0.02 mg/mL)标准品测定,重复进样6次,计算峰面积。3)加样回收率加入制备好的葛根素液晶溶液0.25 mL,以及精密配制的2.315 8 mg/mL葛根素水溶液0.25 mL于3 k超滤离心管中,4 k r/min,离心40 min,平行操作3次。计算RSD。
2.2 Pue-LCN的制备 2.2.1 空白葛根素液晶纳米粒的制备对比高压匀质法、热熔剂法等方法,应用薄膜分散法制备液晶纳米粒更简便,易操作[7]。将葛根素溶解在水相中;GMO、F127、用无水乙醇混合溶解,减压回收乙醇至完全,使油相均匀涂布在圆底烧瓶玻璃壁内表面。将水相倒入圆底烧瓶中,加玻璃珠后,水合得到葛根素液晶纳米粒。
2.2.2 含稳定剂的葛根素液晶纳米粒的制备处方量的GMO、F127、0.5%几种稳定剂(处方一:油酸;处方二:油酸钠;处方三:十八胺;处方四:维生素E醋酸酯;处方五:吐温80)用无水乙醇混合溶解,减压回收乙醇后作为油相,其余步骤和上述方法相同,制备得到含稳定剂的葛根素液晶纳米粒。
2.3 包封率的测定采用超滤-离心法测定包封率,此法较凝胶色谱柱,透析法更为简便[8],耗时更少,并且方法稳定,结果准确。将Pue-LCN溶液加入到超滤管中,包封葛根素的立方液晶纳米粒由于粒径较大被节流在超滤膜上,未包封的游离Pue可透过超滤膜,实现分离。总药物含量通过50倍体积甲醇破乳得到,计算得到立方晶样品中Pue的包封率。
具体操作:取0.2 mL Pue-LCN, 用甲醇定容至10 mL容量瓶中,HPLC测定立方液晶纳米粒的总药物含量;0.5 mLPue-LCN至于30 kd超滤离心管中,4 000 r/min,离心40 min,取下滤液,HPLC测定游离葛根素含量。包封率计算公式如下:
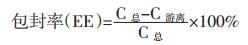 |
将未经稀释的液晶纳米用注射器加入到样品池至刻度,应用Zeta粒度—电位仪,测定液晶纳米粒的粒径,电位,PDI分配系数。
2.5 偏光显微镜将溶剂5%甘油-水、液晶纳米粒滴加于载玻片,用盖玻片盖住,偏光显微镜下观察液晶纳米粒状态。
2.6 投射式电子显微镜通过投射电镜可对液晶纳米粒微观形态进行观察。用1 mL注射器吸取适量Pue-LCN,分次滴加在覆盖碳膜的铜网上,自然干燥后投射电镜下观察立方液晶纳米形态结构。
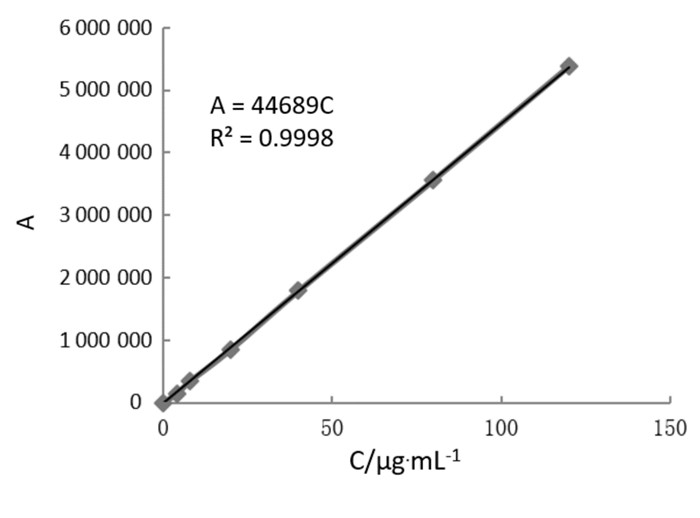
3 结果与分析 3.1 方法学考察结果 3.1.1 线性不同浓度与峰面积关系如下图,拟合关系曲线为Ŷ=44 689X,R2=0.999 8。葛根素浓度在0~120 μg/mL范围内的线性关系良好,符合要求。
|
| 图 1 线性关系曲线 Fig. 1 Standard curve |
见表 1。
| No. | 峰面积 | 均值 | RSD(%) |
| 1 | 852 900 | 857 015.5 | 0.7128 |
| 2 | 869 359 | ||
| 3 | 854 472 | ||
| 4 | 855 246 | ||
| 5 | 855 065 | ||
| 6 | 855 051 |
见表 2。
| 项目 | 1 | 2 | 3 | x±s |
| 葛根素加样量(mg) | 1.215 9 | 1.215 9 | 1.215 9 | - |
| 葛根素回收量(mg) | 1.212 5 | 1.222 5 | 1.211 2 | 1.215 4±0.005 07 |
| 加样回收率(%) | 99.72 | 100.54 | 99.61 | 99.96±0.51 |
加入油酸钠、吐温80的液晶纳米粒呈半透明样,具有丁达尔现象;其他三种维生素E醋酸酯、十八胺、油酸钠的加入对剂型外观基本无影响,呈乳白色。
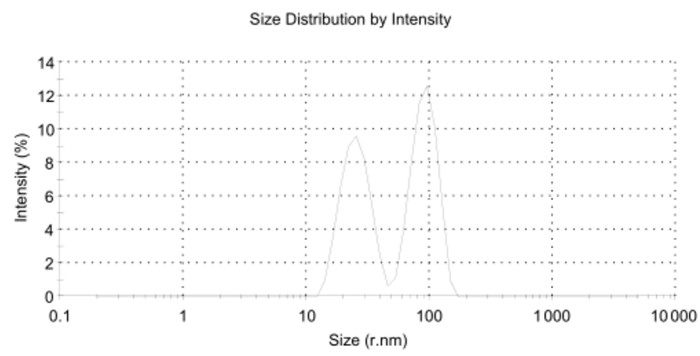
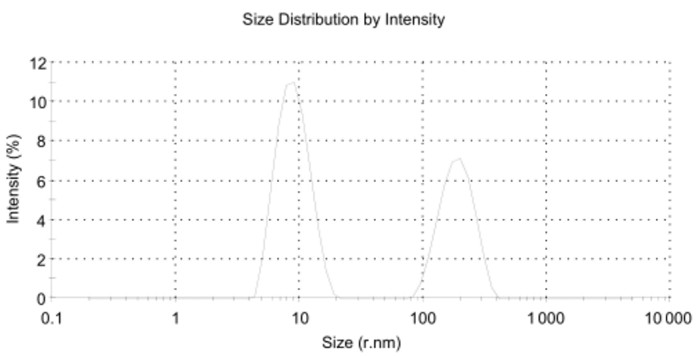
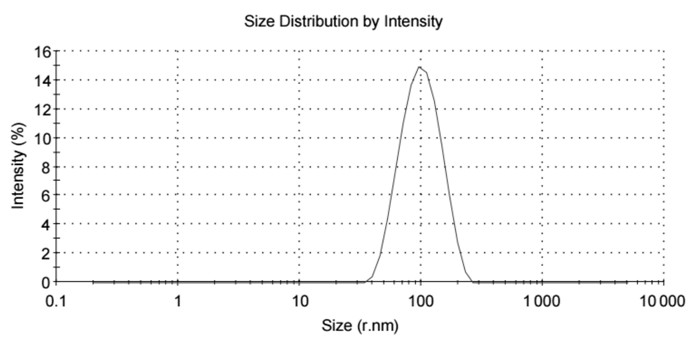
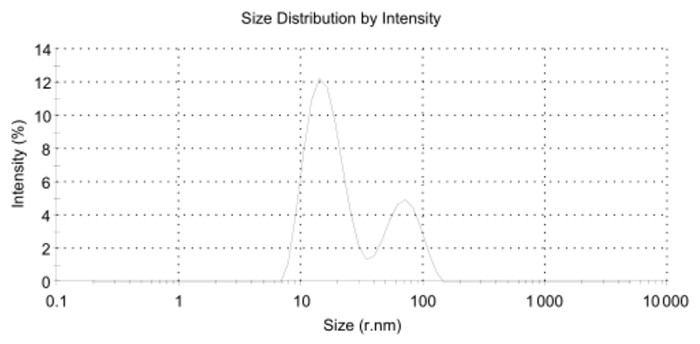
空白Pue-LCN粒径半径大小在(98.75±0.024 1)nm,PDI为0.153 7±0.129 2。以油酸,油酸钠,吐温80为稳定剂的制剂粒径分布不均,在一定纳米范围附近出现双峰(如下图 2、3、4)。其中,加入油酸钠,吐温80的制剂PDI较大,分别为0.987 7±0.021 36和0.620 8±0.075 68。粒径分布图和PDI结果提示含有油酸、油酸钠的处方无法形成粒径均一的液晶纳米粒。
|
| 图 2 处方一制剂粒径分布图 Fig. 2 Size distribution of perparation 1 |
|
| 图 3 处方二制剂粒径分布图 Fig. 3 Size distribution of perparation 2 |

|
| 图 4 处方三制剂粒径分布图 Fig. 4 Size distribution of perparation 3 |
从Zeta电位上看,与空白制剂相比,除油酸钠外,其余电位绝对值均有增加,体系稳定性明显增高。而加入油酸钠制剂的电位为-3.647±0.850,不稳定。加入稳定剂后的制剂,除油酸(7.13)外,pH均略增大,呈弱碱性。
| 处方 | 粒径(r,nm) | PDI(x±s) |
| 空白 | 98.75±0.024 1 | 0.153 7±0.129 2 |
| 处方一 | 25nm,79.95nm附近双峰 | 0.370 7±0.561 5 |
| 处方二 | 10nm,200nm附近双峰 | 0.987 7±0.021 3 |
| 处方三 | 106.9±47.938 | 0.383 7±0.009 5 |
| 处方四 | 94.62±3.18 | 0.387 0±0.005 1 |
| 处方五 | 18nm,178nm附近双峰 | 0.620 8±0.075 6 |
|
| 图 5 处方四制剂粒径分布图 Fig. 5 Size distribution of perparation 4 |
|
| 图 6 处方五制剂粒径分布图 Fig. 6 Size distribution of perparation 5 |
| 处方 | Zeta电位(mV) | pH |
| 空白 | 18.40±0.030 3 | 7.63 |
| 处方一 | -24.80±0.917 | 7.13 |
| 处方二 | -3.647±0.850 | 7.68 |
| 处方三 | 31.17±0.058 | 7.53 |
| 处方四 | -37.47±1.550 | 8.70 |
| 处方五 | -23.07±0.473 | 8.44 |
|
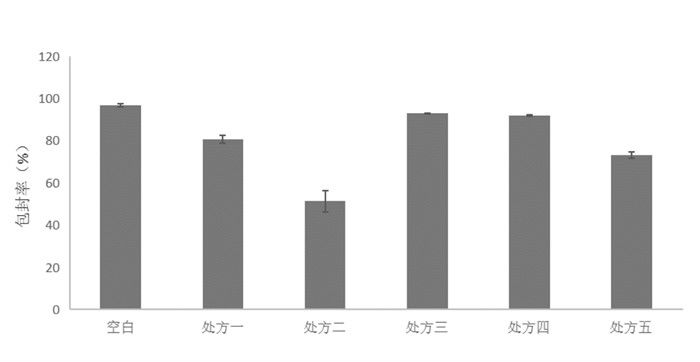
| 图 7 不同处方包封率考察表 Fig. 7 Encapsulation efficiency of different preparations |
各处方制剂包封率见表5。由表可见,加入油酸,十八胺,维生素E醋酸酯的包封率均大于80%,而油酸钠、吐温80的加入对包封率的影响较大,分别为51.43%±4.997%,73.10%±1.489 7%,偏低。
根据包封率、载药量、粒径、电位综合考察结果,以油酸钠和吐温80为稳定剂的制剂不符合制剂高包封率,电位稳定,粒径分布均匀的要求,故暂选择十八胺,维生素E醋酸酯为稳定剂制备样品,进行稳定性考察。
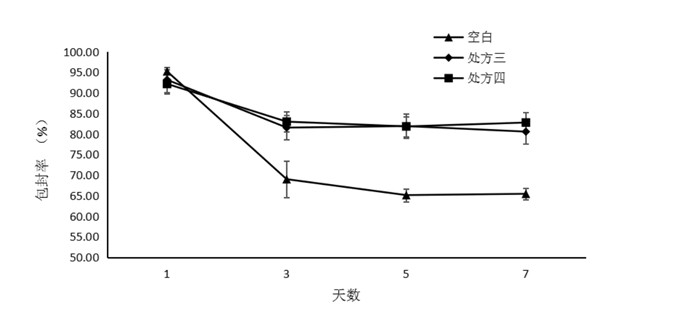
3.3 几种辅料加入后对样品粒径、包封率周内稳定性的影响 3.3.1 包封率周内稳定性根据加入稳定剂制剂的1周稳定性考察发现,加入十八胺和维生素E醋酸酯制剂包封率变化呈相同趋势,即在第3天包封率有下降分别从93.15%,92.15%下降到83.06%,82.97%,其后不再下降,并保持80%以上。
|
| 图 8 处方三、处方四一周包封率变化 Fig. 8 Encapsulation efficiency variation of prescription 3, 4 one week |
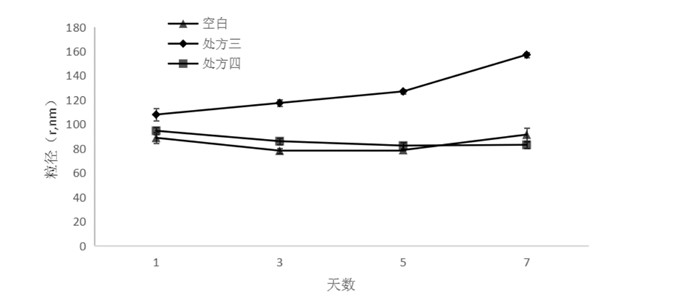
根据加入稳定剂制剂的一周粒径稳定性考察发现,加入维生素E醋酸酯制剂粒径半径与空白制剂变化呈相似趋势,在第三天略下降后保持稳定,保持在80 nm左右;而加入十八胺的制剂在一周内粒径呈逐步增加,半径达到160 nm,远大于空白液晶纳米粒,粒径过大。与不加稳定剂的制剂相比,十八胺不能保持制剂粒径大小均一,不符合制剂要求。
|
| 图 9 处方三、处方四一周粒径变化 Fig. 9 Particle size variation of prescription Ⅲ, Ⅳ in a week |
综上所述,几种辅料中维生素E醋酸酯最适合作为Pue-LCN的稳定剂,符合立方液晶纳米粒粒径分布良好,质地均匀等特点。
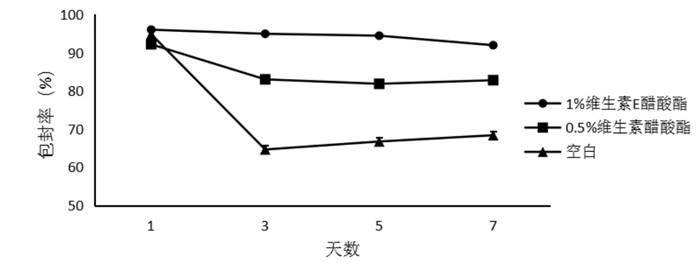
3.4 维生素E醋酸酯提高制剂周内包封率稳定性为提高Pue-LCN 1周内包封率稳定性,选择两个维生素E醋酸酯投料量(0.5%,1%)对维生素E醋酸酯含量对制剂稳定性影响进行考察。结果显示,0.5%、1%维生素E醋酸均可提高包封率周内稳定性。当投料量为1%时,可以明显提高制剂包封率稳定性,并保持90%以上。
|
| 图 10 不同含量维生素E醋酸酯的Pue-LCN周内包封率稳定性 Fig. 10 Encapsulation efficiency weekly stability of PueLCN |
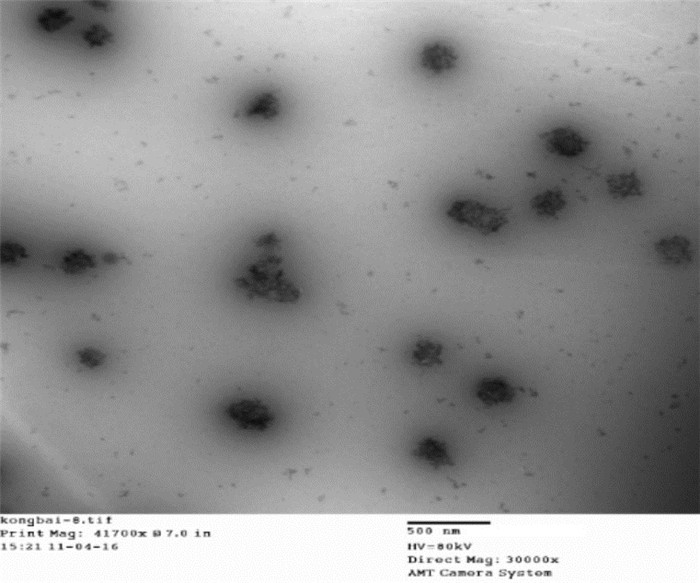
将含有1%维生素E醋酸酯的处方按照2.2下方法制备Pue-LCN。投射式电子显微镜下观察到液晶纳米粒形态完整,分布均匀。
|
| 图 11 Pue-LCN投射电镜图 Fig. 11 Transmission electron microscopy figure of PueLCN |
研究聚合物结晶形态的方法有很多,主要有电子显微镜法、偏光显微镜法、小角光散射法等[9],偏光显微镜法是目前实验室中较为简便的使用方法。其原理是将普通光改变为偏振光进行镜检以鉴别某一物质是单折射性或双折射性。偏光显微镜被广泛地应用于矿物、化学、生物学和植物学等领域[10]。
偏光显微镜内,在物镜与目镜间插入一个检偏镜片,光源与聚光器间镶有起偏镜片,圆形载物台可以作360°旋转。起偏与检偏镜片处于正交检偏位时,视野完全变黑。将被检物体放在显微镜台上。若被检物为单折射体,则旋转镜台,视野始终黑暗。若旋转镜台一周,视野内被检物时明时暗,则说明被检物是双折射体,即有晶体存在。
将溶剂5%甘油-水、液晶纳米粒滴加于载玻片,用盖玻片盖住,偏光显微镜下观察液晶纳米粒状态。图 12、图 13对比可见,液晶纳米粒在偏光显微镜下可见折射光,可初步判断有液晶存在,而溶剂则无。
|
| 图 12 溶剂5%甘油-水偏光显微镜图 Fig. 12 Polarizing microscope diagram of 5% glycerolwater |

|
| 图 13 液晶纳米粒偏光显微镜图 Fig. 13 Polarizing microscope diagram of Pue-LCN |
立方液晶作为药物载体,目前研究最多的体系是甘油酸单油酸酯和水的体系,其他类脂形成的立方晶也有报道,如甘油单反酸酯、磷脂酰乙醇胺、磷脂等[5]。泊洛沙姆407作为一种双亲型嵌段共聚物,是最常用的类脂型立方晶的稳定剂,有利于极性药物分子的包封和增溶[11-12],可影响GMO的相变[13]。但本实验结果提示单用泊洛沙姆不足以支撑体系的稳定性,几种或多种稳定剂合用更适合液晶纳米粒体系。液晶纳米粒制剂的稳定性与体系的pH值、粒径、电位、包封率等因素有关[14]。
油酸是一种含18个碳原子和1个双键的不饱和脂肪酸,常用来作稳定性和安全性高的医药基剂或辅助剂[15]。Cullis等研究发现,将油酸引进脂质体膜中后,能引起双分子层结构的严重破坏,促进形成片层六角相,张静等实验证实了这一点[16]。不适合作为立方液晶纳米粒的稳定剂。油酸钠由氢氧化钠与油酸反应制得的,pH显弱酸性,较油酸的酸性更弱,属于阴离子表面活性剂,在微乳剂中较常用来控制粒径的大小[17],但在脂质体、液晶制备中应用较少。在本课题研究中,两者对包封率和粒径的实验结果提示油酸和油酸钠的加入破坏了原有晶体结构,使得包封率下降,粒径不均一。
十八胺(又名硬脂胺)是一种阳离子表面活性剂,多用来制备阳离子脂质体,可使脂质体具有主动靶向作用[18]。本实验发现,十八胺可使液晶纳米粒表面带正电,体系Zeta电位达到(31.17±0.058)mV,稳定性提高,也可缓解周内包封率下降的问题。但是却无法防止因颗粒聚合导致的体系粒径增大,这不利于液晶纳米粒的黏膜吸收,影响药效。
吐温80是药物制剂中常用的辅料,常用作助溶剂、乳化剂和稳定剂等,为非离子型表面活性剂,对药物有明显增容作用[19]。在本实验处方中加入吐温80后,无法形成粒径均一的液晶纳米粒,使原有晶型结构发生改变药物泄露严重。
维生素E醋酸酯是由维生素E和醋酸酐酯合成而来[20],具有和维生素E相同的抗氧化作用。本实验研究发现维生素E醋酸酯适合作为液晶纳米粒的稳定剂,防止药物泄露,可实现周内包封率的稳定。这也提示维生素E醋酸酯可以抑制液晶纳米粒的过氧化反应,并且抗氧化能力随着浓度的增加而增强。
| [1] | Wei SY, Chen Y, Xu XY. Progress on the pharmacological research of puerarin:a review[J]. Chinese Journal of Natural Medicines, 2014, 12 (6): 407–414. DOI:10.1016/S1875-5364(14)60064-9 |
| [2] | 伟唯, 江培. 葛根素药理作用研究进展[J]. 黑龙江医药, 2014 (1): 51–55. |
| [3] | 李鹏跃. 基于MD-MS技术研究葛根总黄酮及葛根素静脉和鼻腔给药的药动学差异. [D]. 北京: 北京中医药大学, 2014. |
| [4] | 赵丽霞. 葛根素纳米给药系统药动学特性及对脑缺血再灌注损伤的保护作用研究[D]. 济南: 山东大学, 2014, 12(6): 407-414. http://cdmd.cnki.com.cn/Article/CDMD-10422-1013140421.htm |
| [5] | 刘治镇, 赵静, 廖光熙, 等. GMO/F127溶致液晶作为控释药物载体的研究[J]. 中国新药杂志, 2016, 35 (4): 464. |
| [6] | 王志宁, 郑利强. 类脂立方液晶作为药物载体的研究[J]. 化学进展, 2005, 17 : 417–42. DOI:10.3321/j.issn:1005-281X.2005.03.007 |
| [7] | 吴红兵, 霍东凤. 脂质立方液晶纳米粒[J]. 药学学报, 2008, 43 (5): 450–455. |
| [8] | 陈召红, 刘皈阳, 魏亚超. 脂质体包封率测定方法研究进展[J]. 解放军药学学报, 2011, 27 (1): 79–82. |
| [9] | 陈玉林, 桂双英, 钱珊珊. 溶致液晶作为药物载体的研究进展[J]. 中国新药杂志, 2013, 22 (6): 654–659. |
| [10] | 付建武. 复方姜黄素脂质立方液晶的制备、表征与评价[D]. 广州中医药大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10572-1013226482.htm |
| [11] | 陈琰, 陈建明, 陈酩, 等. 立方晶及其在药剂学中的研究进展[J]. 第二军医大学学报, 2009, 30 (7): 834–837. |
| [12] | 高丽新, 孙萍. 泊洛沙姆407的研究进展[J]. 亚太传统医药, 2012, 8 (1): 177–187. |
| [13] | 李超, 高缘. 泊洛沙姆F127和丹皮酚对GMO液晶相变的影响[J]. 2011, 69(13): 1503-1508. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hxxb201113001&dbname=CJFD&dbcode=CJFQ |
| [14] | 蔡明志, 王昆. 载药脂质体物理化学稳定性的研究进展[J]. 国外医学·药学分, 2005, 32 (6): 404–407. |
| [15] | 刘真, 卢义和, 宫素芝, 等. 我国油酸的生产现状及展望[J]. 河北化工, 2006, 29 (9): 18–22. |
| [16] | 张静, 孙润广. 液晶态油酸脂质体与生物膜相互作用的理化特性[J]. 物理学报, 1994, 9 : 1495–1501. DOI:10.7498/aps.43.1495 |
| [17] | 侯巍, 王淑君. 几种辅料对紫杉醇脂质体粒径及Zeta电位的影响[J]. 安徽农业科学, 2011, 39 (26): 15965–15967. DOI:10.3969/j.issn.0517-6611.2011.26.053 |
| [18] | Euan R, Jehan A, Malathi A, et al. A novel liposomal irinotecan formulation with significant anti-tumour activity:Use of the divalent cation ionophore A23187 and copper -containing liposomes to improve drug retention[J]. European Journal of Pharmaceutics and Biopharmaceutic, 2007, 68 (3): 617–617. |
| [19] | 谭志高, 巢志茂. 聚山梨脂80的化学稳定性研究进展[J]. 中国实验方剂学实验, 2012, 18 (1): 251–254. |
| [20] | 吴春霞. 维生素E醋酸酯的制备工艺研究[D]. 重庆: 重庆大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10611-1012047926.htm |
 2017, Vol. 34
2017, Vol. 34