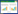文章信息
- 郑文科, 张俊华, 王辉, 刘春香
- ZHENG Wen-ke, ZHANG Jun-hua, WANG Hui, LIU Chun-xiang
- 临床“合意对照”非盲设计方法初探:患者意愿的体现
- "Conform-Willingness controlled Trial" design:respect patients' wishes
- 天津中医药, 2017, 34(11): 738-741
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(11): 738-741
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.11.06
-
文章历史
- 收稿日期: 2017-06-24
在药物临床试验设计中,为了避免对照组与试验组出现选择性偏倚,同时为了减少安慰剂效应,无论是采用安慰剂对照还是阳性药对照,设计者往往采用随机、盲法设计,即将受试者随机分配到两组中的任意一组,以示在随机分配过程中不进行人为干预,受试者被分入任何一组都是随机的,没有人为因素混杂其中,故被认为客观、严谨。随机对照试验(RCT)因采用一系列降低各种偏倚的措施而被公认为是药物临床评价的“黄金标准”。然而,RCT设计本身固有的缺陷不容忽视,如纳入、排除标准过于苛刻,受试者依从性差,研究结果的外推性值得推敲等。因此,美国食品药品监督管理局(FDA)在药物审批时亦转变思路,强调要重视来源于真实世界研究的证据[1]。
在伦理方面,RCT同样受到诸多质疑[2],比如受试者是否从研究中获得了益处,受试者是否接受随机分配等。此外,这种传统的随机盲法设计违反了临床试验中一个最基本的伦理原则:受试者知情权[3]。《赫尔辛基宣言》和《纽伦堡法典》中都规定了医学研究必须保证受试者的知情同意权和自我决定权[4]。
在现行的临床试验中,尚无法充分保证受试者的知情同意权和自我决定权。目前普遍采用的知情同意方法,即:告知受试者研究的目的、方案、药物等相关信息,但是为了保证盲法的顺利实施,又不能告知受试者所服用药物的真实信息(研究者往往也不知道)。研究者普遍接受这样一个事实:告知受试者有可能被分入任何一组,其风险效益的差别目前尚不明确,如果受试者接受这样一个安排,即表示研究人员尊重了受试者意愿,做到了保证受试者知情权。
实际上,这是基于目前无法解决这一问题而采用的无奈之举,并非充分保证了受试者的权利,笔者将此种知情同意称为“不充分知情同意”。而在“不充分知情同意”的前提下,受试者无法做到充分的自我决定。
此外,这种做法还为无法保证受试者依从性留下了隐患。部分受试者倾向于服用阳性药或试验药,其参与临床研究的动机是有可能免费获得所期望药物和免费检查,而一旦发现被分到了另外一组,便不再继续服药,或者即使未破盲,受试者因为对所服药物心存疑虑而中途退出研究或隐瞒研究者服药情况,导致数据不完整或失真,严重影响了试验质量。
针对这一问题,有研究人员设计了一种称为FCP试验方案[5],将试验药与安慰剂摆在受试者面前,由受试者自行选择服用何种药物,虽然在伦理上有一定的进步,但由于受试者无法确认自己服用的是何种药物,故仍未完全解决知情同意的问题。
由于安慰剂效应与反安慰剂效应都会对人体产生相反的影响,而且不同的人群会有不同的反应[6-8]。因此,当两者同时出现,即部分服用试验药物的受试者怀疑所服药物为对照药,从而不信任药物会起效,而部分服用对照药的受试者相信自己可能服用的是试验药物,因此产生积极的安慰剂效应,两种效应同时存在,必然影响研究结果,除非样本量足够大才可能将此影响减小到忽略不计的程度。而RCT的样本量与真实世界研究样本量存在极大差距。因此,RCT设计存在缺陷不仅是操作性、伦理的问题,还有研究结果真实性的问题。
为解决以上问题,笔者尝试设计一种“合意对照”非盲临床试验方法。
1 关键环节介绍根据纳入排除标准,研究者选择合适的受试者,除告知受试者本研究的方案,研究目的之外,还要告知本研究中所有药物的相关信息,使受试者根据研究者目前能够提供的药物确切信息,结合自身经验进行选择,在本次研究中,受试者愿意接受何种药物治疗,研究者根据其意愿,将其分入对应的组别。观察期结束后,予以结局评价,见图 1。
|
| 图 1 临床“合意对照”非盲设计方案示意图 Fig. 1 Clinical schematic diagram of the project of "CWT" open-label design |
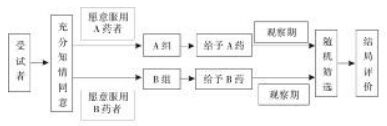
本方法与传统PCT的区别在于在随机分配环节与施盲过程不尽相同。“合意对照”非盲设计不对研究者与受试者施盲,也不采用随机法将受试者随机分配入组,而是随患者意愿进行分组。为了保证试验质量,减少偏倚,本方法需采用一系列质量控制措施,即:研究者只负责受试者的募集和分组,做到受试者充分知情同意,并根据受试者的意愿将其分至不同组别,不参与信息采集与数据分析;药师根据方案发放相应药物;在信息采集阶段,应当由第三方独立采集受试者资料,避免因利益相关而出现偏倚。在数据采集完成后,根据样本量大小,分别在试验组与对照组中采用随机方法选取相同样本量的病例,以保证其基线可比;最终由统计人员对所采集的数据进行分析。统计人员需被施盲,故受试者不同组别仍用编号表示,以保证在统计分析过程中相关人员无法识别不同药物,见图 2。
|
| 图 2 “合意对照”非盲设计方案质量控制流程图 Fig. 2 Flow diagram of quality control in the project of "CWT" open-label design |
根据研究目的不同,研究者可以选择非RCT、临床观察等不同的设计方案,而之所以认为RCT是当前最严谨的科研设计方法,是因为其混杂因素较少,在随机双盲的情况下,大大降低了各种偏倚,因此得出的结论更加可靠,证据强度更高。而恰恰是设计如此严谨的试验方法,却无法解决最基本的伦理问题。此外,又必然要面对由此带来的诸如募集困难、受试者依从性差、模拟剂制作困难等一系列问题。
本试验设计是在满足伦理要求的情况下,最大限度提高试验质量,降低偏倚风险,以增加证据强度。虽然同样不采用随机和盲法,但其与临床观察或非RCT设计有明显的不同。本试验设计方法首先尊重受试者意愿,由受试者自己选择被分入试验组或者对照组,而临床观察或非RCT则是由研究者决定受试者接受何种治疗;其次,该设计方法采用细化分工、第三方信息采集、避免利益相关、对统计人员施盲等多种质量控制措施,保证试验的客观、科学、严谨。
本设计方法虽不能剥除临床研究中药物的安慰剂效应,但并不意味着安慰剂效应影响了试验结果。普遍认为,安慰剂效应是基于患者对所服用药物既往认识和经验上的心理效应,如果受试者认为该药物对疾病有效,则产生积极的正安慰剂效应,相反,如果受试者认为药物对疾病无效或会产生不良反应,则产生消极的反安慰剂效应。
医疗的最终目的是治愈疾病,而不管治疗手段是否为单纯的药效作用,如果心理安慰能够起效,同样可以应用于临床。实际上,任何药物治疗疾病,都不可能完全脱离安慰剂效应,只要患者心理有期望值,则必定产生一定的安慰剂效应。因此,合理利用积极安慰剂效应不失为一种好的选择。当然,因安慰剂效应而掩盖药效作用,进而延误病情的情况,则需注意避免。
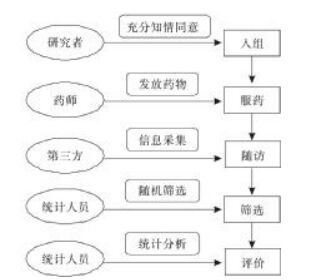
在传统的RCT中,试验组与对照组产生的药效为试验药和对照药药理效应与心理效应的综合效应;但两组心理效应中,安慰剂效应与反安慰剂效应的效应量各为多少,并不明确,在样本量不足的情况下,难以做到两者基线可比,见图 3。
|
| 图 3 传统RCT设计组间比较示意图 Fig. 3 Schematic diagram of interdass comparison of traditional RCT disign |
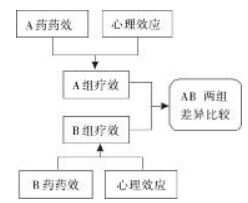
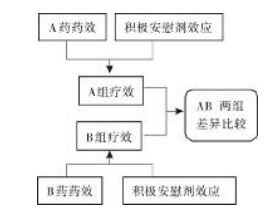
在“合意对照”设计中,因试验组与对照组完全按照受试者意愿选择治疗方案,故可认为其心理效应均为积极的安慰剂效应,均有利于疾病的治疗,由于基线可比,故安慰剂效应在两组的差异比较中并无影响。(图 4)
|
| 图 4 “合意对照”非盲设计组间比较示意图 Fig. 4 Schematic diagram of interclass comparison of "CWT" open-label design |
1)该设计方法弥补了既往临床试验中伦理的不足,充分保证了受试者的知情权,并尊重了受试者的意愿。2)在药效与积极安慰剂效应综合作用下,有效促进受试者病痛的缓解,而不影响组间差异比较。3)在一定程度上提高了受试者依从性。4)回避了安慰剂制作的难题。
3.2 局限性1)该方法不能适用于安慰剂空白对照临床试验,只能应用于阳性对照药存在的临床试验。2)需采取额外的质量控制措施,以降低试验实施过程中的各种偏倚。3)为了保证两组基线可比,纳入、排除标准需更加严谨,尽量不要设计亚组比较,减少组内分层的可能性。增加随机筛选环节,在基线可比的病例群中随机筛选部分病例,同时意味着会剔除掉一部分已经入组的病例,造成一定的资源浪费。
4 展望药物临床试验的最终目的是验证药物的有效性和安全性,科学、客观地认识药物特性,并正确应用于临床以治愈疾病。
在疾病面前,医学能做的只是“偶尔可治愈,经常能缓解,总是在安慰”,药物治疗疾病的范围相对有限,以药物为载体,其积极的安慰剂效应同样能够帮助患者缓解病痛。因此,医务工作者不应当被束缚在固有思维中,忘记治疗疾病的其他手段。如果说在临床试验中对受试者采用盲法,不告知具体服用何种药物是不符合伦理的表现,那么,研究者专注于证明特定药物的药效而忽视了受试者最真实的愿望——治愈疾病,这才是更大的违背医学伦理的行为。
本方法试图在符合医学伦理与科研要求的前提下完善临床试验设计,因仅是一种思路,尚未付诸实践证明其效用,或有不完善的地方,冀望同道指正。
| [1] | Sherman RE, Anderson SA, Dal Pan GJ, et al. Real-World Evidence-What Is It and What Can It Tell Us?[J]. N Engl J Med, 2016, 375 : 2293–2297. DOI:10.1056/NEJMsb1609216 |
| [2] | Kovács J. Some recent ethical dilemmas in randomized controlled clinical trials[J]. Orv Hetil, 2008, 149 (37): 1753–1760. DOI:10.1556/OH.2008.28431 |
| [3] | 曹永福, 沈秀芹. "安慰剂对照双盲"中的伦理分析[N]. 健康报, 2004-05-25. |
| [4] | Nijhawan LP, Janodia MD, Muddukrishna BS, et al. Informed consent:Issues and challenges[J]. J Adv Pharm Technol Res, 2013, 4 (3): 134–140. DOI:10.4103/2231-4040.116779 |
| [5] | Enck P, Grundy D, Klosterhalfen S. A novel placebo-controlled clinical study design without ethical concerns-the free choice paradigm[J]. Med Hypotheses, 2012, 79 (6): 880–882. DOI:10.1016/j.mehy.2012.09.017 |
| [6] | Annoni M, Miller FG. Placebo Effects and the Ethics of Therapeutic Communication:A Pragmatic Perspective[J]. Kennedy Inst Ethics J, 2016, 26 (1): 79–103. DOI:10.1353/ken.2016.0004 |
| [7] | Horsfall L. The Nocebo Effect[J]. SAAD Dig, 2016, 32 : 55–57. |
| [8] | Ortiz R, Chandros Hull S, Colloca L. Patient attitudes about the clinical use of placebo:qualitative perspectives from a telephone survey[J]. BMJ Open, 2016, 6 (4): e11–12. |
 2017, Vol. 34
2017, Vol. 34