文章信息
- 张继雯, 宋殿荣, 张葳, 刘三洪, 王玉华, 杜文欣, 郭洁, 王雅楠
- ZHANG Ji-wen, SONG Dian-rong, ZHANG Wei, LIU San-hong, WANG Yu-hua, DU Wen-xin, GUO Jie, WANG Ya-nan
- 活血化瘀法对子宫内膜异位症子宫内膜干细胞的影响
- Effets of promoting blood circulation and removing blood stasis for endometriosis-endometrial stem cells
- 天津中医药, 2017, 34(11): 756-759
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(11): 756-759
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.11.12
-
文章历史
- 收稿日期: 2017-04-20
2. 天津中医药大学, 天津 300193
子宫内膜异位症(EMS)是妇科常见病、多发病,发病率达10%~15%[1],且呈上升趋势,它所引起的疼痛、不孕和包块,严重影响女性的健康和生活质量。EMS病变广泛,形态多样,极具侵袭性和复发性,不仅有恶性行为且有组织学恶变倾向,已成为妇产科临床与基础研究之焦点和难点。中医认为“瘀血”是子宫内膜异位症的发病基础,活血化瘀法是本病的基本治则[2],且临床疗效显著[3]。新近研究认为EMS是一种“干细胞起源”的疾病[4]。本课题组前期从EMS患者在位子宫内膜功能层中分离出子宫内膜干细胞[5],本研究试图通过体内、外研究探讨活血化瘀代表方剂姜黄散对EMS子宫内膜干细胞的影响。
1 材料 1.1 子宫内膜标本14例经手术确诊为EMS患者的在位子宫内膜标本均为术前经阴道诊刮获得,将新鲜子宫内膜标本置于含2%青链霉素的冰浴DMEM/F-12培养基(DF12)中,立即送入实验室进行分离培养。患者年龄26~50岁,术前3个月未服用激素类药物,不合并其他内科疾病,诊刮病理证实子宫内膜无病变。所有标本的采集均经患者本人知情同意,并经医院伦理委员会批准。
1.2 实验动物经天津中医药大学第二附属医院伦理委员会审查同意,4周龄健康SPF级雌性裸鼠购于北京维通利华实验动物技术有限公司,体质量为13~16 g,饲养于中国医学科学院血液学研究所无菌净化屏障系统内饲养。
1.3 药品与试剂姜黄散:姜黄、丹参、莪术、赤芍各10 g,均来自天津中医药大学第二附属医院全成分颗粒药房。孕三烯酮标准品(中国药品生物制品检定所,CAS号:16320-04-0)。DF12、标准胎牛血清(FBS)(美国Hyclone公司),间充质干细胞培养液(MSCGM)(德国Lonza公司)。
2 方法 2.1 细胞培养EMS在位子宫内膜干细胞的分离、培养及鉴定方法参照本课题组前期实验成果[5]。
2.2 药液制备姜黄散全成分颗粒热溶后离心去沉渣,0.22 μm滤膜过滤除菌,配置母液浓度为400 mg/mL。孕三烯酮标准品以二甲基亚砜(DMSO)溶解后配置母液浓度为1×10-2 mol/L。
2.3 姜黄散在体外实验中对子宫内膜干细胞的影响 2.3.1 姜黄散对子宫内膜干细胞增殖的影响子宫内膜干细胞以1×104/孔密度接种于96孔板中,分为姜黄散实验组、孕三烯酮阳性对照组及不加药阴性对照组,每组设6个复孔。细胞贴壁融合至约60%时各组加药继续培养48 h,以0.5 mg/mL的噻唑蓝(MTT)100 μL继续与细胞共培养4 h后添加DMSO避光震荡5 min,酶标仪读取各孔490 nm处光密度(OD)值,以抑制率(IR)接近10%作为药物对子宫内膜干细胞干预的最高无毒浓度。IR=(A490阴性对照-A490加药)/A490阴性对照×100%。
同上法,将子宫内膜干细胞接种于96孔板中,待细胞贴壁融合至约60%时,实验组加入最高无毒浓度浓度姜黄散,阳性对照组加入最高无毒浓度浓度孕三烯酮,阴性对照组正常培养不加药,MTT法分别检测培养3、6、12、24、48 h各组细胞490 nm处OD值,计算实验组及阳性对照组加药后IR进行统计分析。
2.3.2 姜黄散对子宫内膜干细胞克隆形成的影响1)将子宫内膜干细胞以50个细胞/cm2接种于6孔板中,分为姜黄散实验组、孕三烯酮阳性对照组及不加药阴性对照组,每组3个复孔,待细胞贴壁后,各组换成含最高无毒浓度药物培养液继续培养12 d。以4%多聚甲醛固定细胞,以姬母萨染液1 mL/孔将细胞染色后计数克隆,按公式“克隆形成率=克隆数/接种细胞数×100%”计算克隆形成率,评价姜黄散对子宫内膜干细胞克隆形成的影响。2)同上法接种克隆,连续培养12 d后计数克隆形成并进行统计,将克隆形成细胞同上分组并加药干预48 h,将细胞固定、染色,计算克隆形成率,评价姜黄散对子宫内膜干细胞克隆形成的影响。
2.3.3 姜黄散对子宫内膜干细胞微球体形成的影响1)将子宫内膜干细胞分为姜黄散实验组、孕三烯酮阳性对照组及阴性对照组,各组分别用含最高无毒浓度药物MSCGM重悬后,以4×105/皿密度接种于直径为6 cm的超低吸附培养皿中,每2天加入1 mL含药MSCGM,4 d后倒置,显微镜下观察微球体变化,评价姜黄散对子宫内膜干细胞微球体形成的影响。2)用MSCGM重悬子宫内膜干细胞,培养4 d待微球体形成后将细胞同上分组并加药继续培养48 h,观察加药后微球体变化,评价姜黄散对子宫内膜干细胞微球体形成的影响。
2.4 姜黄散在体内实验中对子宫内膜干细胞的影响将子宫内膜干细胞以1×107个细胞/部位接种于裸鼠下腹部4个象限部位,共40个接种点。饲养2周观察裸鼠皮下异位病灶生长情况,游标卡尺测量病灶长径(b)、短径(a),并计算病灶体积[V=1/2(a×b2)]。形成病灶的裸鼠随机分为姜黄散高剂量组(254.7 mg/d),中剂量组(127.35 mg/d),低剂量组(63.675 mg/d),孕三烯酮阳性对照组(每周15.92 μg)及阴性对照组(生理盐水200 μL/d),每组8个异位病灶。姜黄散各组及阴性对照组连续灌胃14 d,阳性对照组灌胃孕三烯酮水溶液2次/周,共2周,计算各组异位病灶体积。
处死裸鼠,取裸鼠异位病灶组织以4%多聚甲醛固定后浸蜡包埋、切片,应用苏木精-伊红(HE)染色观察异位病灶组织结构,用免疫组化法(SP)检测裸鼠异位病灶表面蛋白Vimentin和CK-19的表达,以确定病灶性质,并于显微镜下计数异位病灶腺体数量。
2.5 统计学方法采用SPSS 19.0软件进行统计学处理。定量资料以均数±标准差(x±s)表示,组内自身前后比较采用配对t检验,两组均数比较采用两独立样本t检验,多组均数比较采用单因素方差分析(ANOVA),组间两两比较采用LSD法,重复测量资料采用重复测量方差分析,P<0.05认为差异有统计学意义。
3 结果 3.1 姜黄散对子宫内膜干细胞增殖的抑制作用姜黄散对子宫内膜干细胞干预的最高无毒浓度为20 mg/mL,孕三烯酮为10-6 mol/L。姜黄散和孕三烯酮对子宫内膜干细胞作用6 h后表现出抑制作用,12 h后抑制作用明显,24 h后抑制作用加快,到48 h抑制率接近10%,相同时间二者作用趋势一致(见表 1),各时间段两组抑制率均无统计学差异。
| % | ||||||
| 组别 | 复孔数 | 作用时间(h) | ||||
| 3 | 6 | 12 | 24 | 48 | ||
| 姜黄散 | 6 | 1.75±0.502 | 2.22±0.730 | 3.73±0.415 | 5.06±1.023 | 9.81±3.596 |
| 孕三烯酮 | 6 | 1.32±0.701 | 2.78±0.545 | 4.15±1.325 | 6.23±2.223 | 10.76±4.013 |
子宫内膜干细胞贴壁后即加药干预,继续培养12 d后,实验组未见克隆形成,阳性对照组克隆形成率为(2.35±1.23)%,均明显低于阴性对照组(16.20±3.05)%,差异有统计学意义(P<0.05)。
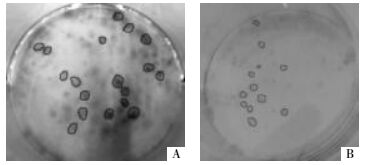
各组细胞接种12 d后计算克隆形成率无统计学差异(见表 2),加药干预48 h后,实验组和阳性对照组均可见已形成的克隆中有细胞凋亡,克隆细胞排列变稀疏,大克隆数目明显减少(见图 1);实验组和阳性对照组分别与加药前比较有统计学差异(见表 2,P<0.05)。阴性对照组较前无统计学差异。
| % | |||
| 组别 | 复孔数 | 加药前 | 加药干预48 h后 |
| 实验组 | 3 | 14.83±0.69 | 12.90±0.65* |
| 阳性对照组 | 3 | 15.21±0.52 | 13.24±1.12* |
| 阴性对照组 | 3 | 14.73±0.45 | 15.60±0.91 |
| 注:与加药前比较,*P<0.05。 | |||
|
| 图 1 药物对克隆形成的影响 Fig. 1 The influence of drugs on clone formation A:阴性对照组肉眼可见的克隆;B:克隆形成后予药物干预肉眼观克隆的变化(4×,标尺500 μm) |
在微球体形成前加药干预,实验组及阳性对照组均未见微微球体形成,阴性对照组微球体则正常形成。
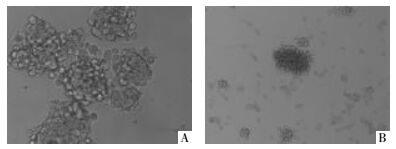
在微球体形成后加药干预,实验组微球体直径明显变小,部分较小的微球体结构松散,漂浮状态的单个细胞及贴壁细胞数量增多;阳性对照组微球体直径明显变小或贴壁,贴壁细胞数量增多明显;阴性对照组微球体则正常形成(见图 2)。
|
| 图 2 微球体形成后加药干预对球体形成的影响 Fig. 2 The influence of drugs onmammosphere formation A:阴性对照组形成的微球体(20伊);B:药物干预后微球体的变化(10伊) |
药物干预前,各组裸鼠异位病灶体积无统计学差异(见表 3,P>0.05)。药物干预后,姜黄散高、中剂量组及阳性对照组皮下均未见肉眼可见的异位病灶,姜黄散低剂量组裸鼠异位病灶体积较前减小(P<0.05),阴性对照组异位病灶体积较前无统计学差异。
| mm3 | |||
| 组别 | 病灶数 | 给药前 | 给药后 |
| 姜黄散高剂量组 | 8 | 30.13±10.13 | 0 |
| 姜黄散中剂量组 | 8 | 28.83± 8.98 | 0 |
| 姜黄散低剂量组 | 8 | 29.32±10.82 | 21.52±10.13* |
| 孕三烯酮阳性对照组 | 8 | 28.16±10.01 | 0 |
| 阴性对照组 | 8 | 27.51± 9.03 | 28.74±11.05 |
| 注:与阴性对照组比较,*P<0.05。 | |||
对各组接种部位组织进行HE染色及免疫组化病理鉴定,镜下均可见子宫内膜异位病灶样间质及腺体存在。与阴性对照组比较,姜黄散高、中剂量组及阳性对照组异位腺体数量均明显降低,结果有统计学差异(见表 4,P<0.05),但姜黄散高、中剂量组与阳性对照组比较无统计学差异。姜黄散低剂量组腺体数量与阴性对照组无统计学差异。
| 个 | ||
| 组别 | 病灶数 | 异位腺体计数 |
| 姜黄散高剂量组 | 8 | 30.83±9.13* |
| 姜黄散中剂量组 | 8 | 34.83±7.88* |
| 姜黄散低剂量组 | 8 | 49.50±10.82 |
| 阳性对照组 | 8 | 33.16±10.01* |
| 阴性对照组 | 8 | 55.50±6.03 |
| 注:与阴性对照组比较,*P<0.05。 | ||
干细胞是具有无限增殖、自我更新和多向分化潜能的细胞群,在体内和体外均有表现。在体外,干细胞的无限增殖、自我更新和多向分化的潜能可以表现在克隆形成[6],微球体形成[7]和诱导分化[8]等。在体内,干细胞可以表现为相近组织的重建或肿瘤形成[9],这是评价干细胞生物学特性的金标准。EMS被称为“不死的肿瘤”,其增殖、浸润、转移及复发等恶性生物学行为[10]与干细胞的生物学特性密切相关。
EMS起源的“干细胞学说”认为在位子宫内膜基底层的干/祖细胞异常脱落进而逆流入盆腔,在局部微环境的刺激诱导下进入增殖、分化程序最终发展为子宫内膜异位病灶,即EMS起源于在位内膜干细胞。该理论使EMS经典的“经血逆流学说”与“在位内膜决定论”得到整合与融通。而中医理论认为EMS形成的最主要原因是瘀血。妇女房劳、多产、手术等均易损伤冲任胞宫,致藏泄功能异常,经血泄而不循常道,成为离经之血。离经之血与荣养周身的正常血液不同,可随经络气血运行至周身他脏,瘀阻他处,是为“瘀血”,与周围组织粘连、纤维化,形成疤痕,瘀积日久,可于机体多部位形成癥瘕,故瘀血始终贯穿EMS病理演变的全过程。离经之血犹如“种子”一样的在位内膜干细胞,瘀血不除,血不归经,则反复发病。临床研究显示,活血化瘀法是中医治疗EMS的基本治则,且在该治则指导下取得满意临床疗效,不良反应少,被EMS患者广泛接受[11-12]。本研究前期已从EMS患者在位子宫内膜功能层中分离出子宫内膜干细胞,本研究从体、内外实验进一步观察活血化瘀法对EMS的干预作用。
本研究所用姜黄散首载于《圣济总录》,主治“妇人月水涩滞”、“脐腹刺痛”,是活血化瘀治法的代表方剂。实验所用姜黄散在原方基础上合理化裁,由姜黄、丹参、莪术、赤芍组方,提高原方活血化瘀,理气止痛之功,活血不伤正,理气不伤阴,相辅相成,使气血流利,通则不痛,癥瘕自除。研究结果显示姜黄散可有效抑制子宫内膜干细胞的增殖、克隆形成及微球体形成,予姜黄散干预后,裸鼠异位病灶体积明显减小,异位腺体数量明显减少,作用效果与孕三烯酮相当,明显高于不予药物干预的阴性对照组。以上实验结果提示活血化瘀法具有抑制子宫内膜干细胞增殖的作用,为活血化瘀法治疗EMS提供基础理论依据,有利于治疗EMS中药新药的开发与利用,为传统中医理论得到现代医学的认可奠定基础。
| [1] | Fuentes A, Escalona J, Cespedes P, et al. Prevalence of endometriosis in 287 women undergoing surgical sterilization in Santiago Chile[J]. Rev Med Chil, 2014, 142 : 16–19. |
| [2] | 王曼. 子宫内膜异位症的中西医结合研究和诊疗标准[J]. 浙江中西医结合杂志, 2002, 12 (5): 265–267. |
| [3] | 崔轶凡, 王庆国. 中药治疗子宫内膜异位症的Meta分析[J]. 中国中医药信息杂志, 2010, 17 (4): 25–27. |
| [4] | Sasson IE, Taylor HS. Stem cells and the pathogenesis of endometriosis[J]. Annals of the New York Academy of Sciences, 2008, 1127 (1): 106–115. DOI:10.1196/nyas.2008.1127.issue-1 |
| [5] | 张继雯, 宋殿荣. 人子宫内膜异位症在位子宫内膜干细胞的分离和鉴定[J]. 国际妇产科杂志, 2017, 44 (1): 113–117. |
| [6] | Stingl J, Eaves CJ, Zandieh I, et al. Characterization of bipotent mammary epithelial progenitor cells in normal adult human breast tissue[J]. Breast Cancer Res Treat, 2001, 67 : 93–109. DOI:10.1023/A:1010615124301 |
| [7] | Dontu G, Abdallah WM, Foley JM, et al. In vitro propagation and transcriptional profiling of human mammary stem/progenitor cells[J]. Genes & development, 2003, 17 (10): 1253–1270. |
| [8] | 杨新园, 王伟, 陈葳, 等. 子宫内膜基质干细胞的成骨及成软骨诱导分化研究[J]. 南方医科大学学报, 2011, 31 (9): 1488–1492. |
| [9] | Cervelló I, Mas A, Gil-Sanchis C, et al. Reconstruction of Endometrium from Human Endometrial Side Population Cell Lines[J]. Plos One, 2011, 6 (6): e21221. DOI:10.1371/journal.pone.0021221 |
| [10] | 李华军, 郎景和, 刘珠凤, 等. 子宫内膜异位症患者在位内膜细胞的异常生物学特性[J]. 中日友好医院学报, 2007, 21 (6): 323–326. |
| [11] | 张丽娜. 从瘀论治子宫内膜异位症疼痛的系统评价[D]. 哈尔滨: 黑龙江中医药大学, 2010. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hnzk201003028&dbname=CJFD&dbcode=CJFQ |
| [12] | 黄飞翔, 丛慧芳. 补肾化瘀法治疗子宫内膜异位症系统评价[J]. 吉林中医药, 2012, 32 (5): 477–480. |
2. University of Traditional Chinese Medicine, Graduated School, Tianjin 300193, China
 2017, Vol. 34
2017, Vol. 34