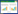文章信息
- 王红, 陈德友, 李莉, 徐晨霞, 陈明欣, 刘宝山
- WANG Hong, CHEN De-you, LI li, XV Chen-xia, CHEN Ming-xin, LIU Bao-shan
- 固肠胶囊治疗腹泻型IBS模型大鼠效应及长链非编码RNA机制研究
- Effects of Guchang capsules treatment and long chain and non coding RNA research on diarrhea-predominant of IBS in rat model
- 天津中医药, 2017, 34(11): 764-769
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(11): 764-769
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.11.14
-
文章历史
- 收稿日期: 2017-05-28
2. 天津中医药大学, 天津 300193;
3. 天津中新药业集团股份有限公司达仁堂制药厂, 天津 300142
肠易激综合征(IBS)主要是以腹痛或腹部不适,大便习惯、大便性状的改变等为主要临床表现,伴有焦虑、抑郁等植物神经功能失调症状的一组肠功能障碍性综合征[1-2]。据罗马Ⅲ诊断标准,可分为腹泻型(D-IBS)、便秘型(C-IBS)、混合型(M-IBS)和未定型(U-IBS)4个类型,其中以腹泻型最为常见。世界卫生组织(WHO)把腹泻病的控制列为全球性战略。
目前,IBS的发病机制尚不明确,在基因调控其发生和发展方面研究甚少。近年研究发现在哺乳动物基因组中mRNA只占全部转录本的2%,其余98%为非编码RNA[3]。最新研究显示长片段非编码RNA(lncRNAs)异常表达于IBS中[4-5]。传统中药已广泛应用于各种各样的疾病并已显示出良好的疗效[6-7]。固肠胶囊是从中国传统医学草本植物提取的中成药,广泛用于治疗IBS且被证实。
本实验通过复制大鼠D-IBS模型,对大鼠的肠道敏感性进行评估,分析通过不同剂量固肠胶囊治疗腹泻大鼠模型后,其降结肠组织中炎症蛋白表达的不同及lncRNA的表达谱差异,阐释固肠胶囊在治疗腹泻大鼠模型中的作用及分子机制,为腹泻的临床治疗提供新思路及可靠有效且不良反应小的新型中药制剂。
1 材料 1.1 实验动物选择清洁级成年Wistar大鼠60只,>40 d龄,体质量220~250 g,雌雄各半,此大鼠均购自上海生工生物工程有限公司。
1.2 实验分组在60只大鼠中随机选出10只大鼠,标记为正常组,除正常组外的50只大鼠随机分为以下5组:模型组、固肠胶囊低剂量组、固肠胶囊中剂量组、固肠胶囊高剂量组、匹维溴铵组,每组10只。固肠胶囊由天津中新药业集团股份有限公司达仁堂制药厂提供。自实验开始后第11天起,根据《药理实验方法学》“不同动物等效剂量折算系数表”折算出固肠胶囊低、中、高剂量组固肠胶囊煎剂给大鼠用量分别为8 g/(kg·d)、12 g/(kg·d)、16 g/(kg·d),匹维溴铵组按10.6 mL/kg匹维溴铵剂量灌胃给药,正常组、模型组按等体积0.9%生理盐水灌胃。各组灌胃每日1次,共连续14 d。饲养环境良好且不变,同样每天记录每只大鼠饮水量、进食量,观察大鼠一般情况和粪便质地等。
1.3 主要仪器与试剂主要仪器有高压蒸汽消毒器(日本TOMY KOGYO公司),外科手术器械(上海精密仪器厂),低温台式离心仪、高速冷冻离心机、微量加样器(德国Eppendorf公司),微型水平电泳槽、核酸电泳仪(美国BIO-RAD公司),NanoDrop 2000c紫外分光光度计(美国Thermo公司),LightCycler480荧光定量PCR仪(德国Roche公司),超低温冰箱(日本SANYO公司),紫外凝胶成像系统(美国WEALTEC公司),Hybridization oven、Hybridization Chamber、Agilent Microarray Scanner(美国Agilent公司)。
主要试剂有日本TaKaRa公司的PCR Master Mix、反转录试剂盒、PrimeScriptTM RT reagent Kit、SYBR premix Ex TaqTM Ⅱ PCR Kit、Gene Expression Hybridization Kit、Gene Expression Wash Buffer Kit、DNase/RNase-free distilled wate;西安沃尔森公司的磷酸盐缓冲液(PBS)。
2 实验方法 2.1 建立腹泻大鼠动物模型上述所有大鼠在造模前禁食12 h,自由饮水。对于正常组,按20 mL/kg灌服生理盐水,每日1次,连续3 d;从第4天起,禁食不禁水,乙醚麻醉下,经肛门插入连续硬膜外导管(深入8 cm)注入生理盐水0.5 mL,捏紧大鼠肛门,倒提20 s,每日1次,连续7 d;对于剩余50只大鼠,按20 mL/kg灌服生理盐水,每日1次,连续3 d;从第4天起,禁食不禁水,乙醚麻醉下,经肛门插入连续硬膜外导管(深入8 cm)注入8%醋酸溶液0.5 mL,捏紧大鼠肛门,倒提20 s,每日1次,连续7 d。每天记录每只大鼠饮水量、进食量,观察大鼠一般情况和粪便质地等。
2.2 造模评估按照下述条件进行造模后评估。腹泻率:每组动物中排稀便的动物数与该组动物总数之百分比。稀便率:每只动物所排的稀便数与总便数之比。稀便级:表示稀便的程度。以稀便污染滤纸形成污迹面积的大小定级。分为4级,标准如下:1级:污迹直径<1 cm;2级:污迹直径1~1.9 cm;3级:污迹直径2~3 cm;4级:污迹直径>3 cm。腹泻指数:稀便率与稀便级的乘积。
2.3 组织标本取材、处理及镜下观察将上述大鼠全部脱颈处死,沿腹正中线剪开皮肤,暴露腹腔,分离结肠,切取盲肠上结肠2 cm,取出肛门至盲肠末端的整个结肠和直肠段。每只小鼠肠道组织标本分两部分,一部分在液氮中保存用于生化及酶联免疫吸附法(ELISA)检测,另一部分经10%甲醛固定、石蜡包埋、切片,苏木精-伊红(HE)染色,镜下观察病理改变并记录各自特征。
2.4 ELISA法检测各组大鼠结肠TNF-α、IL-6的含量确定检测所需的已包被抗体的酶标板孔数目;将倍比稀释的标准品各0.l mL依次加入一排7孔中,1孔只加样品稀释液作为对照。每孔加入100 μL处理过的标本;酶标板盖上盖子,37 ℃反应90 min;反应后用自动洗板机吸去酶标板内的液体,或甩去酶标板内液体,再对着吸水纸拍几下,洗涤2次;每孔依次加入0.l mL已经准备好的生物素抗体工作液,37 ℃反应60 min;0.0l mol/L四甲基联苯胺(TBS)或0.01 mol/L PBS洗涤3次,每次1 min左右;每孔依次加入0.l mL准备好的ABC工作液,37 ℃反应30 min;0.011 mol/L TBS或0.01 mol/L PBS洗涤5次,每次1~2 min;按每孔0.1 mL依次加入TMB显色工作液(TMB显色液需先37 ℃平衡30 min),37 ℃避光反应,反应过程中,要经常观察,当肉眼可见标准品的前3~4孔有明显的梯度蓝色,后3~4差别不明显时,即可加入TMB终止液0.1 mL/孔(显色反应最长不要超过30 min);用酶标仪在450 nm测定OD值;根据样品的吸光值在坐标上找出对应的浓度。
2.5 总RNA提取及普通反转录将提取后完整的总RNA反转录生成对应的cDNA,按照PrimeScriptTM RT reagent Kit试剂盒说明书进行如下反应:
1)小心加入下列组分试剂:5 μL,Total RNA、4 μL,Rnase-free去离子水、1 μL,通用引物;42 ℃水浴箱中孵育2 min。
2)置于冰上孵育1 min,离心后加入下列组分试剂:1 μL逆转录酶复合物、4 μL 5×Reaction Buffer、4 μL Rnase-free去离子水、1 μL dNTP及通用引物复合物。
3)反应装置置于42 ℃水浴箱中孵育15 min。
4)反应装置置于80 ℃水浴箱中孵育5 s,使酶失活。
5)置于-20 ℃低温冰箱保存备用。
2.6 荧光标记产物纯化按如下配置标记mix:Nuclease-free water 0.75 μL;5×transcription buffer 3.2 μL;0.1 mol/L DTT 0.6 μL;NTP mix 1.0 μL;T7 RNA Polymerase Blend 0.21 μL;Cy3-CTP 0.24 μL;总体积6.0 μL。加入上述6.0 μL mix,充分混匀将其离心。聚合酶链式反应(PCR):40 ℃反应2 h;4 ℃反应5 min。将标记产物纯化,用Nano Drop测得RNA浓度。
2.7 芯片杂交、洗涤与扫描用Gene Expression Hybridization Kit进行芯片杂交。Gene Expression Wash Buffer Kit洗涤芯片,Agilent Microarray Scanner扫描芯片。此过程交由上海康成生物信息有限公司完成。
2.8 实时荧光定量PCR目前荧光定量PCR反应中最常用的DNA结合染料是SYBR Green,可以和双链DNA结合并发出荧光,SYBR Green在游离状态下发出的荧光非常微弱,一旦与双链DNA结合后,其荧光强度增强1 000倍,所以荧光信号强度与双链DNA量成正比,可根据荧光信号强度检测反应体系存在的双链DNA数量。
2.9 统计学分析采用SPSS 17.0软件进行统计分析,计量资料以均数±标准差(x±s)表示,多组样本比较采用单因素方差分析,随后采用Newman-Keuls检验,P<0.05为差异有统计学意义。所有的实验至少独立重复3次。
3 实验结果 3.1 大鼠模型评定模型组在造模24 h内,均排出含水分较多的湿软便,48 h以内腹泻率达到100%,排出淡黄色稀便,并持续至造模结束。模型组与正常组相比,腹泻率与腹泻指数均显著增加。在不同扩张容量下,AWR评分明显增加;腹外斜肌收缩次数明显增加。提示D-IBS大鼠造模较为成功。
3.2 各组大鼠肠黏膜病理组织学改变情况各组大鼠结肠HE染色均未见异常病理改变。各组大鼠结肠组织结构完整,镜下可见黏膜层、黏膜下层、肌层及浆膜层4层结构,未见明显充血、水肿、糜烂、溃疡形成及肠道肿瘤等异常病理,显微镜下观察无炎症细胞浸润等组织学改变。见图 1。
|
| 图 1 各组大鼠肠黏膜病理组织学改变 Fig. 1 Histopathological change of intestinal mucosa of rats of each group |
造模后,大鼠结肠组织中TNF-α和IL-6水平显著升高,模型组与正常组相比差异有统计学意义(P<0.05),证明大鼠在造模后的确存在着非特异性炎症改变,但在病理上没有炎症表现。经药物干预后,固肠胶囊中剂量组和固肠胶囊高剂量组可使结肠组织TNF-α和IL-6水平明显下降,趋于正常;并且两组与匹维溴胺组相比差异有统计学意义(P<0.05),两组与固肠胶囊低剂量组相比差异有统计学意义(P<0.05),固肠胶囊中剂量组与固肠胶囊高剂量组两组相比,差异无统计学意义(P>0.05)。见表 1。
| pg/mL | |||
| 组别 | 动物数 | TNF-α | IL-6 |
| 正常组 | 10 | 4.7±0.9 | 29.8±2.6 |
| 模型组 | 10 | 20.8±4.2* | 97.4±8.8* |
| 固肠胶囊低剂量组 | 10 | 17.4±2.7 | 78.6±7.5 |
| 固肠胶囊中剂量组 | 10 | 7.3±1.4#△▲ | 37.5±4.7#△▲ |
| 固肠胶囊高剂量组 | 10 | 6.8±1.2#△ | 34.3±4.4#△ |
| 匹维溴铵组 | 10 | 19.5±3.9 | 94.2±7.7 |
| 注:模型组与正常组相比,*P<0.05;与模型组相比,#P<0.05;与匹维溴铵组相比,△P<0.05;与固肠胶囊低剂量组相比,▲P<0.05。 | |||
样本RNA经纯化后,进行质控检测,样本RNA的A260/A280的比值在1.8至2.0之间,说明RNA纯度合格,未明显受DNA以及蛋白质污染,可以用于下一步芯片检测。
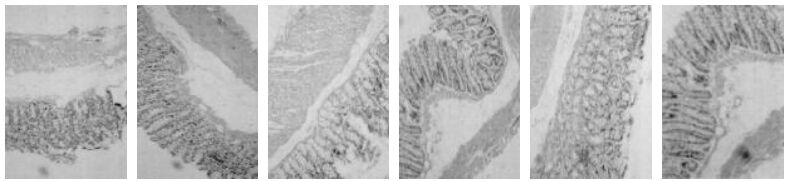
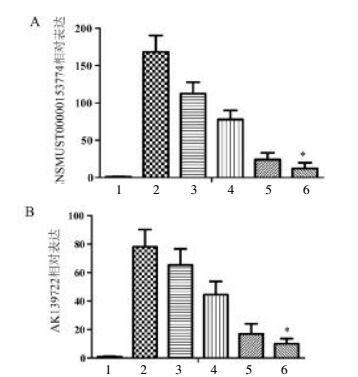
3.5 lncRNA芯片结果选取各组结肠组织样本,进行lncRNA基因芯片分析,经过芯片筛选,以表达差异2倍P<0.05为筛选标准,首次得到正常组与模型组差异表达lncRNA共8 881条,其中上调的有3 755条,下调有5 126条。其中表达差异10倍以上的上调的lncRNA有154条、下调的lncRNA有247条。表达差异排在前10位的上调lncRNA分别为:uc009uoz.1,ENSMUST00000153774,AK132130,AK139722,ENSMUST00000104922,ENSMUST00000153883,ENSMUST00000117501,ENSMUST00000164301,ENSMUST00000169452,ENSMUST00000116186。下调lncRNA分别为:ENSMUST00000122299,NR_030708,uc007qbo.1,uc.203+,uc008feg.1,ENSMUST00000148026,ENSMUST00000119233,ENSMUST00000119230,CF983472,ENSMUST00000145087。
3.6 Quantitative Real-time PCR验证芯片结果随机在差异倍数2倍以上(P<0.05)lncRNA中选取了4条(2条上调、2条下调),设计引物进行实时荧光定量PCR验证。PCR扩增曲线正常,引物溶解曲线单峰,说明产物特异性良好,定量结果可靠。
结果比较如图 2和图 3示,在正常组与模型组样本中,lncRNA ENSMUST00000153774和AK13972在模型组呈相对高表达(P<0.000 1,n=30),模型组>固肠胶囊低剂量组>固肠胶囊中剂量组>固肠胶囊高剂量组>匹维溴胺组;lncRNA ENSMUST00000145087和NR_030708在正常组呈相对高表达(P<0.000 1),正常组>模型组>固肠胶囊低剂量组>固肠胶囊中剂量组>固肠胶囊高剂量组>匹维溴铵组。除固肠胶囊高剂量组与匹维溴胺组比较无统计学差异,其他两组间比较均有统计学差异性。
|
| 图 2 lncRNA ENSMUST00000153774和AK139722在各组样本的相对表达情况 Fig. 2 Relative expression instance of lncRNA ENSMUST00000153774 and AK139722 of samples in each group 1:正常组;2:模型组;3:固肠胶囊低剂量组;4:固肠胶囊中剂量组;5:固肠胶囊高剂量组;6:匹维溴铵组。与固肠胶囊高剂量组比较,*P>0.05;其他组间两两比较均P<0.05。 |
|
| 图 3 lncRNA ENSMUST00000145087和NR_030708在各组样本的相对表达情况 Fig. 3 Relative expression instance of lncRNA ENSMUST00000145087和NR_030708 of samples in each group 1:正常组;2:模型组;3:固肠胶囊低剂量组;4:固肠胶囊中剂量组;5:固肠胶囊高剂量组;6:匹维溴铵组。与固肠胶囊高剂量组比较,*P>0.05;其他组间两两比较均P<0.05。 |
IBS是临床常见的胃肠功能紊乱性疾病,临床表现为一组包括腹痛、腹胀伴排便习惯改变,粪便性状异常等证候群,持续存在或间歇发作,但无器质性病变。中国则以腹泻型多见[8],每年有8. 36亿人次患腹泻,其中5岁以下小儿约有3亿人次[9],因此中国对腹泻的控制也非常重视。
IBS发病机制并非单一,是基因、性别、炎症、脑肠肽、肠动力和内脏敏感性等多重因素互相作用的结果[10-12]。近年来越来越多的研究证据表明IBS患者存在肠道低度炎症[13],多种肠道黏膜炎症可以改变胃肠动力和内脏感觉。IL-6、TNF-α则具有激活淋巴细胞或巨噬细胞、促进炎症反应的作用。有研究报道[14]采用番泻叶灌胃+传统束缚应激刺激复制D-IBS大鼠模型的血清TNF-α水平明显升高。Scully等[15]研究发现IBS患者血浆IL-6和IL-8升高,TNF-α的表达水平也增高。在本实验中,GC能通过降低TNF-α和IL-6表达水平,从而治疗D-IBS。
lncRNA一般是指大于200个核苷酸的RNA,位于细胞核或胞浆内[16],广泛参与机体各种生理和病理过程。Cao X等[17]研究显示哺乳动物超过1 000个lncRNA参与基因编码,且基因表达模式已经暗示这些lncRNA在不同的生物进化过程中发挥作用,包括细胞周期调控,免疫监视,胚胎干细胞多能性等。lncRNA与多种疾病(如自身免疫疾病、代谢性疾病、神经退行性疾病等)的发生与发展密切相关[18]。并发现一些lncRNA异常表达于免疫系统疾病的发生、发展过程中扮演了重要角色[19]。实验结果说明,lncRNA参与了D-IBS的基因调控,与本病发生发展有着密切联系,且固肠胶囊对特异表达的lncRNAs有一定的调节作用。
固肠胶囊由15味中药组成具有散寒清热、调和气血、涩肠止泻之功。用于D-IBS表现为寒热错杂、虚实互见之久泻者。实验研究提示,固肠胶囊的疗效机制在于促进肠吸收功能,解痉止痛,抑制小肠推进运动而止泻消炎提高机体免疫功能,改善微循环和血液流变学状态,有利于慢性结肠炎的修复与痊愈[20]。研究发现固肠胶囊可通过抑制血清TNF-α表达、促进血清白介素-10(IL-10)表达,抑制炎症进展,发挥调节免疫平衡作用,降低肠道过度免疫反应,减轻肠道损伤,促进肠黏膜修复,而治疗慢性UC[21]。陈芙蓉等[22]发现固肠胶囊能明显降低复合型慢性溃疡性结肠炎的结肠指数(CI)和疾病活动指数(DAI)、明显降低结肠IL-6、IL-8水平,明显减轻结肠黏膜病变。本实验提示固肠胶囊对D-IBS有一定的治疗作用。
综上所述,炎性因子指标TNF-α、IL-6和lncRNA与D-IBS的发生发展有着密切的相关性,固肠胶囊能通过调节TNF-α、IL-6和特异表达lncRNAs的表达水平,从而治疗D-IBS,为后续研究奠定了理论和实验基础,为中药治疗本病提供了可靠的新理论和新靶点。
| [1] | Bixquert M. Treatment of irritable bowel syndrome withprobiotics:growing evidence[J]. Indian J Med Res, 2013, 138 (2): 175–177. |
| [2] | Mykletun A, Jacka F, Williams L, et al. Prevalence of mood and anxiety disorder in self reported irritable bowel syndrome (IBS). An epidemiological population based study of women[J]. BMC Gastroenterology, 2010 (10): 87–88. |
| [3] | Birny E, Stamato yannopoulos JA, Autta A, et al. Identification and analysis of functional elements in 1% of the human genome by the ENCODE pilot project[J]. Nature, 2007 (447): 799–816. |
| [4] | Katayama S, Tomaru Y, Kasukawa T, et al. Antisense Transcription in the Mammalian Transcriptome[J]. Science, 2005, 309 (5740): 1564–1566. DOI:10.1126/science.1112009 |
| [5] | Derrien T, Johnson R, Bussotti G, et al. The Gencode V7 Catalog of Human Long Noncoding Rnas:Analysis of Their Gene Structure, Evolution, and Expression[J]. Genome Res, 2012, 22 (9): 1775–1789. DOI:10.1101/gr.132159.111 |
| [6] | Tang JL, Liu BY, and Ma KW. Traditional Chinese Medicine[J]. Lancet, 2008, 372 (9654): 1938–1940. DOI:10.1016/S0140-6736(08)61354-9 |
| [7] | Normile D. Asian Medicine. The New Face of Traditional Chinese Medicine[J]. Science, 2003, 299 (5604): 188–190. DOI:10.1126/science.299.5604.188 |
| [8] | 中华医学会消化病学分会胃肠动力学组. 肠易激综合征诊断和治疗的共识意见(2007, 长沙)[J]. 中华消化杂志, 2008, 28 (1): 38. |
| [9] | 谢立, 孙昼. 婴幼儿冬季腹泻危险因素分析[J]. 中国预防医学杂志, 2007, 8 (4): 356–359. |
| [10] | 吴淑娟, 潘建春. 肠易激综合征发病机制研究进展[J]. 温州医科大学学报, 2015, 45 (5): 389. |
| [11] | 卢璐, 袁建业, 费晓燕, 等. 肠易激综合征发病机制研究及治疗进展[J]. 中国中西医结合消化杂志, 2015, 23 (9): 661–665. |
| [12] | 诸凡凡, 叶柏. 腹泻型肠易激综合征发病机制及治疗现状[J]. 西部中医药, 2013, 26 (10): 139–141. DOI:10.3969/j.issn.1004-6852.2013.10.052 |
| [13] | 李珊, 方秀才. 肠道炎症在肠易激综合征发病中的作用[J]. 中华消化杂志, 2010, 30 (10): 788–790. DOI:10.3760/cma.j.issn.0254-1432.2010.010.026 |
| [14] | 林媚, 唐旭东, 王凤云, 等. 肠安Ⅰ号及其低浓度原药安慰剂对腹泻型IBS大鼠血清Tnf-α、IL-10的影响[J]. 上海中医药杂志, 2012, 46 (5): 82–84. |
| [15] | Scully P, McKernan DP, Keohane J, et al. Plasma cytokine profiles in females with irritable bowel syndrome and extra-intestinal comorbidity[J]. Am J Gastroenterol, 2010, 105 (10): 2235–2243. DOI:10.1038/ajg.2010.159 |
| [16] | Mercer TR, Dinger ME, Mattick JS. Long non-coding RNAs:insights into function[J]. Nat Rev Genet, 2009, 10 (3): 155–159. DOI:10.1038/nrg2521 |
| [17] | Cao X, Yeo G, Muotri AR, et al. Noncoding RNAs in the mammalian central nervous system[J]. Annu Rev Neurosci, 2006, 29 : 77–103. DOI:10.1146/annurev.neuro.29.051605.112839 |
| [18] | Sanchez Y, Huarte M. Long non-coding RNAs:Challenges fordiagnosis and therapies[J]. Nucleic Acid Ther, 2013, 23 (1): 15–20. DOI:10.1089/nat.2012.0414 |
| [19] | Song HJ, Yu XC, Xia T, et al. Associations between long non-coding RNAs and tumors, and their clinical values[J]. Chinese Journal of Cell Biology, 2012, 34 (7): 704–712. |
| [20] | 葛文津, 甘毓麟, 陈瑜., 等. 固肠胶囊治疗慢性非特异性溃疡性结肠炎临床与实验研究[J]. 中医杂志, 1994, 35 (2): 92–93. |
| [21] | 陈芙蓉, 刘彤, 商丹丹, 等. 固肠胶囊治疗动物慢性溃疡性结肠炎及其机制研究[J]. 现代药物与临床, 2014, 29 (12): 1350–1356. |
| [22] | 孙晓萍, 唐方. 固肠胶囊对慢性溃疡性结肠炎大鼠炎症介质及结肠黏膜的影响[J]. 天津中医药大学学报, 2015, 34 (1): 30–33. DOI:10.11656/j.issn.1673-9043.2015.01.09 |
2. Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China;
3. Tianjin Zhongxin Pharmaceutical Group Limited by Share Ltd., Darentang Pharmaceutical Factory, Tianjin 300142, China
 2017, Vol. 34
2017, Vol. 34