文章信息
- 陈昳冰, 崔元璐
- CHEN Yi-bing, CUI Yuan-lu
- 载槲皮素-粉防己碱纳米凝胶的制备、表征与体外评价
- Preparation and characterization of quercetin-tetrandrine nanoparticle and evaluation in vitro and in vivo
- 天津中医药, 2017, 34(11): 770-774
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(11): 770-774
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.11.15
-
文章历史
- 收稿日期: 2017-07-20
纳米药物制剂近年来在基础研究和临床应用中表现出巨大的潜力。纳米凝胶指直径小于200 nm的凝胶,与微米尺度的微粒相比,纳米凝胶具有更大的比表面积,而载药的纳米凝胶会具有更强的生物活性或药理活性[1]。海藻酸钠是一种天然多糖,具有药物制剂辅料所需的稳定性、溶解性和安全性,英国化学家E.C.Stanford首次发现其具有形成凝胶和成膜的能力,现广泛应用于制药辅料、组织工程及生物材料等领域[2]。近年来,有大量的文献报道过槲皮素及粉防己碱广泛的生理活性[3-5],如槲皮素的抗氧化性、抗肿瘤、抗炎以及抗血小板聚集等活性[6-9];粉防己碱的抗心律失常、抗心肌缺血、抗肿瘤多药耐药性等活性,特别是对肺癌及肺纤维化有明显的治疗作用[10-11]。但是,这两种药物的水溶性差,在很大程度上,限制了其临床应用。因此,本研究将槲皮素和粉防己碱制备成纳米凝胶,既可提高药物的水溶解度,还可以增强其药效,能更好地发挥其药物的治疗作用。
1 材料和方法 1.1 主要材料槲皮素(生工生物工程股份有限公司, 纯度99%, 中国); 粉防己碱(江苏永健医药科技有限公司, 纯度99%, 中国); 槲皮素标准品, 粉防己碱标准品(中国食品药品检定研究院); 无水氯化钙(纯度≥95%, 天津市风船化学试剂科技有限公司, 中国); 液体石蜡(分析纯, 天津市风船化学试剂科技有限公司, 中国); 甲醇(色谱纯, 天津康科德有限公司, 中国); 海藻酸钠, 吐温-80, 司盘-80, 罗丹明B(Sigma-Aldrich公司, 美国); 1, 1-二苯基-2-三硝基苯肼(DPPH, Alfa aesar公司, 美国); EURO-STPCV S25顶置式电子搅拌器(IKA公司, 德国); RCT basic加热型磁力搅拌器(IKA公司, 德国); Allegra-64R型高速离心机(Beckman Coulter公司, 美国); 1260型高效液相色谱仪(Agilent科技公司, 美国); Zetasizer Nano-Zs型激光粒径测定仪(Malvern公司, 英国); TENSOR 27型傅立叶转换红外光谱仪(Beckman Coulter公司, 德国); Jade差示扫描量热仪(Perkin Elemer公司, 美国); Infinite M200型多功能读板机(TECAN公司, 瑞士)。
1.2 纳米凝胶的制备 1.2.1 海藻酸钠溶液的配制精确称量海藻酸钠250 mg溶于50 mL纯水中,设置温度45 ℃,置于磁力搅拌器上,600 r/min搅拌6 h,得到浓度为0.5 %(W/V)的海藻酸钠水溶液。
1.2.2 固化剂的配制精确称量无水氯化钙15 mg,槲皮素22.5 mg,粉防己碱112.5 mg溶于15 mL 95%乙醇中,涡旋混匀,得到固化剂。空白纳米凝胶(B-NP)的固化剂中未加入槲皮素和粉防己碱。
1.2.3 空白纳米凝胶及载槲皮素-粉防己碱纳米凝胶(QU-TE-NP)的制备在圆底烧瓶中先加入150 mL液体石蜡,然后分别加入1.05 mL和0.45 mL的司盘-80、吐温-80,使HLB值为7.5。设置温度40 ℃,500 r/min搅拌30 min后,缓慢滴入45 mL海藻酸钠水溶液,控制流速为0.75 mL/min,调整转速1 000 r/min,滴加完毕后继续搅拌1 h。通入氮气,缓慢滴加固化剂15 mL,控制流速为0.15 mL/min,转速1 000 r/min,滴加完毕后继续搅拌1 h。1 h后停止搅拌,将液体转移至50 mL离心管中,3 800 r/min离心10 min,使水相和油相分层,弃去油相,收集下层水相,-80 ℃预冻后置于冷冻干燥机中冻干24 h,所得样品即为空白B-NP或QU-TE-NP。
1.3 QU-TE-NP包封率与载药率的测定 1.3.1 色谱条件色谱柱:Kromasil 100-5 C18色谱柱4.6 mm×250 mm,5 μm;流动相:甲醇:0.2%磷酸水溶液为85:15;检测波长:280 nm,360 nm;流速:1.0 mL/min;进样量:10 μL;柱温:30 ℃。
1.3.2 对照品溶液的制备精密称取于105 ℃干燥至恒重的槲皮素及粉防己碱对照品各2.0 mg。加甲醇超声溶解,定容至10 mL的容量瓶中。用甲醇稀释至不同浓度,按照上述色谱条件测定。
1.3.3 样品溶液的制备载药率样品溶液的制备:精密称取QU-TE-NP样品25 mg,放置于50 mL离心管中,分3次加入甲醇(10、7、5 mL),每次超声助溶30 min后转移至25 mL棕色容量瓶中,加甲醇定容。按照色谱条件下方法测得浓度为C1。
包封率样品溶液的制备:取同一批次的纳米凝胶10 mg,加入1 mL去离子水,完全溶解后,吸取200 μL至0.5 mL超滤离心管(分子截留量:50 000)中,3 500 r/min离心30 min,吸取套管中离心所得清液,另取一份未经离心的槲皮素纳米凝胶200 μL,去离子水稀释至400 μL。按照色谱条件下方法测得浓度分别为C2、C3。
1.3.4 线性关系考察将槲皮素和粉防己碱对照品梯度稀释,得到一系列浓度的对照品溶液,0.45 μm孔径微孔滤膜过滤,进样测定,记录峰面积。以峰面积(Y)为纵坐标,对照品溶液浓度(X)为横坐标,绘制标准曲线。槲皮素及粉防己碱的线性回归方程分别为: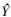
按照上述方法,分别对载药率样品溶液及包封率样品溶液进行槲皮素和粉防己碱的含量测定,按照以下公式计算:
载药率=W槲皮素/W纳米凝胶
包封率=(W槲皮素-W游离槲皮素)/W槲皮素
其中,W槲皮素表示测定得到的槲皮素总量,W纳米凝胶表示所称量的纳米凝胶总量,W游离槲皮素表示测定得到的未包封游离的槲皮素量。
1.4 QU-TE-NP的表征分析 1.4.1 QU-TE-NP的粒径及电位测定取QU-TE-NP溶液1 mL,去离子水稀释至10 mL,用激光粒径测定仪测定粒径分布及Zeta电位。
1.4.2 QU-TE-NP的透射电子显微镜(TEM)分析取QU-TE-NP溶液1mL,用去离子水稀释至适当浓度,吸取20 μL滴至覆盖碳膜的铜网上,待水分蒸发后,由透射电子显微镜观察纳米凝胶的形貌。
1.4.3 QU-TE-NP的红外光谱(FT-IR)分析将适量的海藻酸钠、槲皮素、粉防己碱、QU-TE-NP及B-NP分别与KBr混合,压片,通过傅里叶变换红外光谱仪对样品的FT-IR进行测定,波数范围为4 000~400 cm-1。
1.4.4 QU-TE-NP的差式扫描量热(DSC)分析称取海藻酸钠、槲皮素、粉防己碱、QU-TE-NP及B-NP各10 mg,密闭于铝坩埚之中,以空白铝坩埚作为对照,调节升温速度为10 ℃/min,升温范围为30~350 ℃。记录每个样品的升温曲线。
1.5 QU-TE-NP对DPPH自由基清除效率的影响 1.5.1 槲皮素原料药甲醇溶液及QU-TE-NP溶液的配制精确称量3.38 mg槲皮素原料药,溶于10 mL甲醇中,配制成浓度为1 000 μmol/L的母液,甲醇稀释至500 μmol/L、250 μmol/L。根据实验1.3所得槲皮素载药率结果,精确称量31.1 mg QU-TE-NP;溶于1 mL超纯水中,配制成浓度(以所含槲皮素计)为1 000 μmol/L的混悬液,去离子水稀释至浓度为500 μmol/L至1.5 mL离心管中,避光保存。
1.5.2 DPPH溶液的配制精确称量2.5 mg DPPH,溶于50 mL甲醇中,配制成浓度为50 μmol/L的母液,稀释成浓度为25 μmol/L的溶液至50 mL离心管中,避光保存。
1.5.3 DPPH实验将25 μL各待测样品分别与975 μL的浓度为25 μmol/L DPPH和甲醇各自混合至1 mL离心管中,吸取200 μL反应液加入96孔分析板中,每一组做3次平行实验。于多功能酶标仪上测定λ=515 nm波长处吸光度。按照公式计算DPPH消除率:
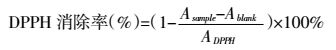 |
式中Asample表示样品与DPPH混合后的吸光度值,Ablank表示样品与甲醇混合的吸光度值,ADPPH表示DPPH的吸光度值。
2 实验结果 2.1 载药率和包封率测定结果按照1.3中所述的测定方法及色谱条件测定QU-TE-NP中的槲皮素和粉防己碱的平均载药率分别为(0.98±0.04)%、(2.75±0.07)%; 平均包封率分别为(96.80±1.10)%、(94.80±0.90)%。实验结果见表 1。
| % | ||||
| 序号 | 载药率 | 包封率 | ||
| 槲皮素 | 粉防己碱 | 槲皮素 | 粉防己碱 | |
| 1 | 0.94 | 2.69 | 96.9 | 93.8 |
| 2 | 0.98 | 2.73 | 95.7 | 95.0 |
| 3 | 1.01 | 2.83 | 97.8 | 95.6 |
| 平均值 | 0.98 | 2.75 | 96.8 | 94.8 |
实验测得QU-TE-NP的平均粒径为(38.86±1.81)nm,PdI为0.21±0.05,平均电位为(-15.90±4.10)mV。
2.3 纳米凝胶的TEM分析由图 1可以看出,载槲皮素-纳米凝胶微球粒径分布较为集中,形态完整,表面光滑平整,且大小均一,与粒径分析所得结果吻合。

|
| 图 1 QU-TE-NP透射电镜照片 Fig. 1 TEM photograph of QU-TE-NP 图中标尺长度为100 nm,放大倍数为20 000倍 |
如图 2所示,槲皮素在3 413 cm-1处有一个强而宽的吸收峰,表明其结构中含有大量的羟基;1 622 cm-1处为不饱和酮的羰基的伸缩振动峰;1 611 cm-1处的强峰以及1 562 cm-1、1 522 cm-1两处中吸收峰是苯环骨架的伸缩振动吸收峰[12]。粉防己碱在2 935 cm-1处为C-H的伸缩振动吸收峰,1 607 cm-1,1 583 cm-1,1 505 cm-1是苯环骨架的伸缩振动吸收峰,在1 025 cm-1处是C-O-C的不对称伸缩振动吸收峰;841 cm-1处是-CH的面外弯曲吸收峰;海藻酸钠在3 418 cm-1处有明显的羟基吸收峰;1 617 cm-1和1 415 cm-1处分别为羧酸根的吸收峰[13]。空白纳米粒和载药纳米粒在3 422 cm-1、3 415 cm-1处出现了羟基的吸收峰,但载药纳米粒的吸收峰较平坦,推测可能是因为粉防己碱和槲皮素之间相互作用,使峰宽和峰强都有所降低。在2 925 cm-1和2 855 cm-1处分别为-CH2的吸收峰,应该是由于残留液体石蜡的烃链引起。但载药纳米粒峰高略强于空白纳米粒,可能是由于槲皮素和粉防己碱的加入,使亚甲基丰度变大,亚甲基数目增多,峰高增强。
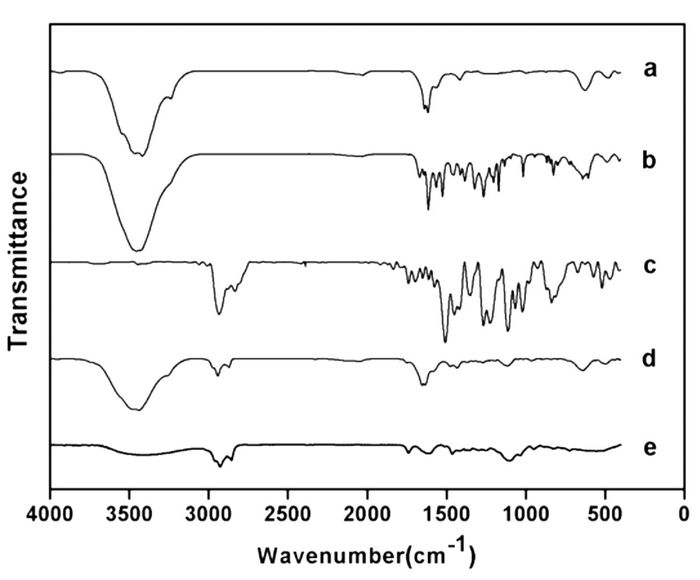
|
| 图 2 海藻酸钠(a)、槲皮素(b)、粉防己碱(c)、B-NP(d)、QU-TE-NP(e)的红外光谱图 Fig. 2 FT-IR spectroscopy of Sodium Alginate(a), Quercetin(b), Tetrandrine(c), B-NP(d), QU-TE-NP(e) |
样品DSC分析见图 3,槲皮素在318.52 ℃处的吸热峰是槲皮素熔点的吸热峰[14];粉防己碱在223.99 ℃有一明显的吸热峰,在338.03 ℃有一明显的放热峰;海藻酸钠在100.13 ℃有一较为平坦的吸热峰,是海藻酸钠内结合水失去,在246.16 ℃有一尖锐的放热峰,这一步是海藻酸钠裂解为较为稳定的中间产物,相邻羟基以水分子的形式脱去[15]。而B-NP与QU-TE-NP在上述温度下的吸热峰和放热峰均消失。
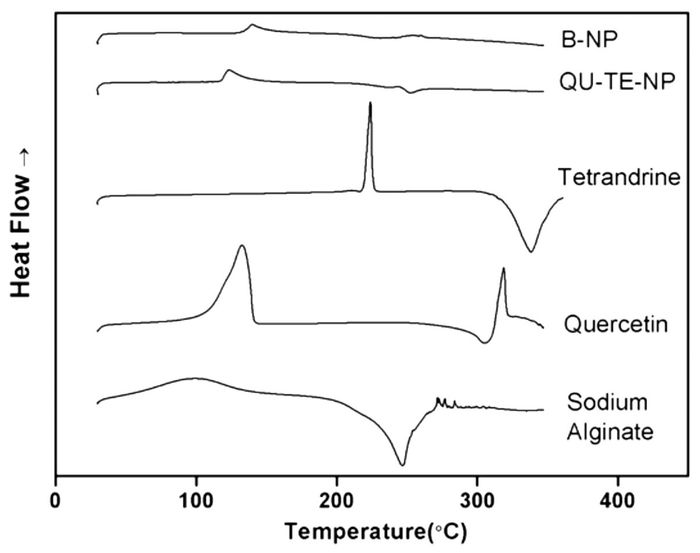
|
| 图 3 B-NP,QU-TE-NP,粉防己碱,槲皮素,海藻酸钠的DSC曲线 Fig. 3 DSC thermogram of B-NP, QU-TE-NP, tetrandrine, quercetin, Sodium Alginate |
槲皮素原料药和QU-TE-NP与DPPH还原反应实验结果如图 4所示,纳米凝胶较槲皮素原料药还原速率更快,抗氧化能力强,且在30 min内可达到稳定。纳米凝胶和槲皮素原料药均表现出了剂量依赖性,浓度越高,对DPPH自由基的消除率越高,抗氧化性越强。
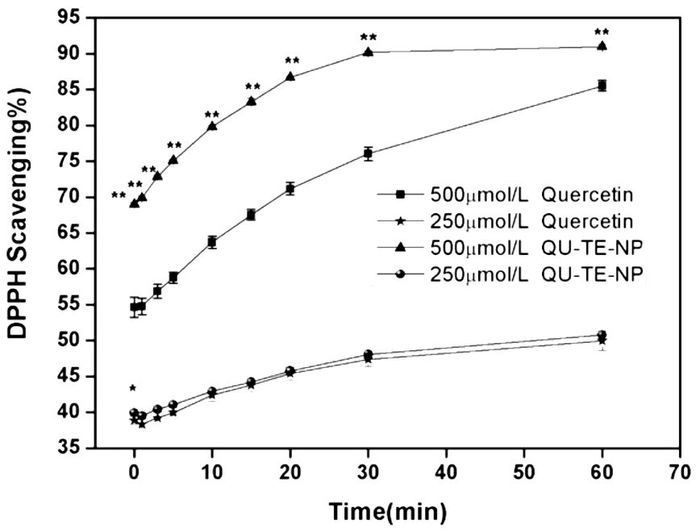
|
| 图 4 500 μmol/L和250 μmol/L槲皮素及QU-TE-NP在60 min内对DPPH自由基的清除效率 Fig. 4 DPPH scavenging by 500 μmol/L and 250 μmol/L of quercetin and QU-TE-NP in 60 minutes 与槲皮素原料药比较,*P<0.05, **P<0.01。 |
本研究将槲皮素,粉防己碱和海藻酸钠在钙离子的介导下,制备成一种纳米凝胶制剂。平均粒径为(38.86±1.81)nm,Zeta电位为(-15.90±4.10)mv。Zeta电位是表示胶体分散系稳定性的重要指标。其数值的绝对值大于60时,表示胶体的稳定性极好;30~60,表示胶体的稳定性良好;10~30,胶体的稳定性一般[16]。该纳米凝胶体系中因为同时含有显弱酸性的槲皮素和大量的碱性物质粉防己碱,所以溶液偏碱性,体系更容易失去电子,电位数值的绝对值偏高。所以将收集的湿态纳米凝胶立即冻干以得到固态纳米凝胶,第一,可以提高制剂的稳定性,第二,方便储存与后续实验的研究。
通过TEM,DSC和FT-IR表征分析,了解到纳米凝胶的形貌为比较规整的球形,槲皮素和粉防己碱与海藻酸分子相互作用参与凝胶构建。
DPPH自由基清除实验将等摩尔浓度的槲皮素或QU-TE-NP与DPPH混合,DPPH的消除率随着时间的变化而升高,两种浓度的槲皮素纳米凝胶在不同时间点时对DPPH自由基清除能力要明显高于槲皮素,且浓度越高,对DPPH自由基的消除能力越强,消除速率越快。这表明,槲皮素与海藻酸钠在钙离子的介导下制备成纳米凝胶后,其抗氧化能力提高,而且,值得注意的是,在加入了粉防己碱的前提下,凝胶体系的抗氧化性仍然明显高于槲皮素单体。
4 结论本研究制备了QU-TE-NP,所得样品粒径分布均一,透射电子显微镜下观察其形态圆整,表面光滑。通过DSC,FT-IR表征实验分析得出,槲皮素和粉防己碱和海藻酸钠在钙离子的介导下,相互作用参与凝胶构建。两种药物本身为水难溶物,制备成纳米凝胶后,增加其在水中的溶解度,同时提高了槲皮素的抗氧化性。综上所述,QU-TE-NP可作为一种新型制剂提高药物水溶性及抗氧化性。
| [1] | Raemdonck KJ, Demeester J, Smedt SD. Advanced nanogel engineering for drug delivery[J]. Soft Matter, 2009, 5 (4): 707–715. DOI:10.1039/B811923F |
| [2] | Wang L, Shelton RM, Cooper PR, et al. Evaluation of sodium alginate for bone marrow cell tissue engineering[J]. Biomaterials, 2003, 24 (20): 3475–3481. DOI:10.1016/S0142-9612(03)00167-4 |
| [3] | 翟莺莺, 周蕾, 赖永洪. 槲皮素抗肿瘤作用的研究[J]. 中华生物医学工程杂志, 2005, 11 (1): 18–20. |
| [4] | Coskun O, Kanter M, Korkmaz A, et al. Quercetin, a flavonoid antioxidant, prevents and protects streptozotocin-induced oxidative stress and beta-cell damage in rat pancreas[J]. Pharmacological Research, 2004, 51 (2): 117–123. |
| [5] | Choi HS, Kim HS, Min KR, et al. Anti-inflammatory effects of fangchinoline and tetrandrine[J]. Journal of Ethnopharmacology, 2000, 69 (2): 173–179. DOI:10.1016/S0378-8741(99)00141-5 |
| [6] | 董学艳, 姚惠芳, 任发政, 等. 牛血清白蛋白与槲皮素在不同溶剂中相互作用特征及抗氧化性的研究[J]. 光谱学与光谱分析, 2014, 34 (1): 162–166. |
| [7] | 刘小涛, 张雅雅, 许英艺, 等. 槲皮素对人小细胞肺癌H446细胞增殖和凋亡的影响[J]. 中国肿瘤生物治疗杂志, 2014, 21 (2): 169–174. DOI:10.3872/j.issn.1007-385X.2014.02.010 |
| [8] | 宋传旺, 刘佳佳, 段承刚, 等. 槲皮素对LPS延迟中性粒细胞自发性凋亡效应的抑制作用[J]. 中国免疫学杂志, 2005, 21 (1): 13–16. |
| [9] | 白建平, 肖东. 槲皮素对血小板聚集和细胞浆游离钙的影响[J]. 大同医专专报, 1996, 16 (2): 3–5. |
| [10] | Liu W, Zhang J, Ying C, et al. Tetrandrine combined with gemcitabine and Cisplatin for patients with advanced non-small cell lung cancer improve efficacy[J]. International Journal of Biomedical Science Ijbs, 2012, 8 (1): 28–35. |
| [11] | 田煦, 朱家壁, 王健松, 等. 粉防己碱静脉注射乳剂的制备及对实验性肺纤维化的治疗作用[J]. 中国药科大学学报, 2005, 36 (3): 225–229. DOI:10.11665/j.issn.1000-5048.20050308 |
| [12] | 尹文萱, 王兴涌, 王建怀, 等. 芦丁和槲皮素及其金属配合物的FTIR研究[J]. 中国矿业大学学报, 2009, 38 (6): 884–888. |
| [13] | Xiao Q, Gu X, Tan S. Drying process of sodium alginate films studied by two dimensional correlation ATR-FTIR spectroscopy[J]. Food Chemistry, 2014, 164 (3): 179–184. |
| [14] | Sinha R, Gadhwal MK, Joshi UJ, et al. Modifying effect of quercetin on model biomembranes:Studied by molecular dynamic simulation, DSC and NMR[J]. Int J Pharmacy Pharm Sci, 2012, 4 (1): 70–79. |
| [15] | 席国宴, 田圣军. 海藻酸钠的热分解研究[J]. 化学世界, 2000, 41 (5): 254–258. |
| [16] | 陈立亚, 于宝珠, 赵慧芳. Zeta电位及其在药学分散体系研究中的应用[J]. 药物分析杂志, 2006, 26 (2): 281–285. |
 2017, Vol. 34
2017, Vol. 34