文章信息
- 李晋, 杜昆泽, 罗蓉, 金华, 马琳, 常艳旭
- LI Jin, DU Kun-ze, LUO Rong, JIN Hua, MA Lin, CHANG Yan-xu
- HPLC法同时测定桑枝中6种成分的含量
- Simultaneous determination of six bioactive components for quality control of Ramulus Mori by HPLC
- 天津中医药, 2017, 34(11): 775-777
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(11): 775-777
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.11.16
-
文章历史
- 收稿日期: 2017-06-20
桑枝,为桑树的枝叶、桑枝、桑条、嫩桑枝的总称。2010年版药典记载其为桑科植物桑(Morus alba L.)的干燥嫩枝[1]。桑枝功效有祛风除湿,利水通络等。主治风湿痹痛,中风半身不遂等病症。桑枝大多数地区均有种植,方便易得。桑枝中起主要药理活性作用的成分为桑枝多糖、黄酮类和生物碱类成分。药理活性主要包括降低血脂、降血糖、抗炎作用以及多糖免疫作用等[2-5]。本实验采用高效液相色谱(HPLC)法对中药桑枝中的6种成分[6-8](桑皮苷A、绿原酸、隐绿原酸、芦丁、异槲皮苷、山奈酚)同时进行含量测定,并对不同批次桑枝药材进行测定,为桑枝的进一步研究和开发利用提供参考,同时为中药桑枝的质量控制提供方法学支持和数据参考。
1 仪器与方法 1.1 仪器高效液相色谱仪Waters2695(型号:F04BLS145C);Waters 2487检测器(型号:C04BLS014C);超纯水器(Millipore公司,Mill-QⅡ型);万分之一天平(德国Sartorius公司,BP121S);旋涡混合器(上海沪西分析仪器厂,XW-80A);超声清洗槽(宁波新芝生物科技股份有限公司,SB-1000YDTD)。
1.2 试药桑皮苷A(成都曼思特生物科技有限公司,批号:MUST-13033016,纯度:≥98%,供含量测定用);绿原酸(成都曼思特生物科技有限公司,批号:MUST-14091701,纯度:99.39%,供含量测定用);隐绿原酸(成都曼思特生物科技有限公司,批号:MUST-13013002,纯度:≥98%,供含量测定用);芦丁(成都曼思特生物科技有限公司,批号:MUST-11040302,纯度:≥98%,供含量测定用);异槲皮苷(成都曼思特生物科技有限公司,纯度:≥98%,供含量测定用);山奈酚(成都曼思特生物科技有限公司,批号:MUST-13121112,纯度:≥98%,供含量测定用);乙腈(天津市康科德科技有限公司,色谱纯);甲醇(天津市康科德科技有限公司,色谱纯);甲酸(Tedia,色谱纯)。桑枝饮片购自于各药店,经天津中医药大学常艳旭研究员鉴定为桑科植物的干燥嫩枝,样品保存于天津中医药大学中医药研究院。桑枝样品粉碎,过60目筛,备用。
1.3 色谱条件Agilent C18色谱柱(4.6 mm×250 mm,5 μm);流动相A为水(含0.1%甲酸),流动相B为乙腈,按表 1程序进行梯度洗脱;柱温:(25±2)℃;流速:1 mL/min;进样体积:20 μL;吸收波长:360 nm。
| 时间(min) | A% | B% |
| 0 | 91 | 9 |
| 16 | 90 | 10 |
| 17 | 90 | 10 |
| 20 | 83 | 17 |
| 30 | 83 | 17 |
| 40 | 81 | 19 |
| 44 | 80 | 20 |
| 48 | 72 | 28 |
| 58 | 71 | 29 |
| 60 | 70 | 30 |
| 75 | 55 | 45 |
| 80 | 44 | 56 |
| 85 | 38 | 62 |
| 93 | 10 | 90 |
| 94 | 91 | 9 |
精密称取桑枝样品0.250 g,置5 mL容量瓶中,加70%甲醇至刻度线,超声提取30 min,静置放冷,加70%甲醇补足至刻度线,摇匀,14 000 rpm离心10 min 2次,取上清液作为样品溶液,于4 ℃冰箱中保存备用。
1.5 对照品溶液的制备分别精密称取桑皮苷A对照品、绿原酸对照品、隐绿原酸对照品、芦丁对照品、异槲皮苷对照品和山奈酚对照品,加纯甲醇配成浓度分别为0.9、0.25、0.12、0.003、0.004、0.002 mg/mL的混合对照品储备液,置4 ℃冰箱中保存备用。
2 结果 2.1 方法学验证 2.1.1 线性关系的考察精密移取各标准品储备液,用甲醇稀释成一系列浓度,以对照品质量浓度(X,mg/L)为横坐标,峰面积(
| 化合物 | 标准曲线 | 线性范围(滋g/mL) | 相关系数(r2) |
| 桑皮苷A |  =4 007.5X+713.17 =4 007.5X+713.17 | 22.50~900.00 | 0.9991 |
| 绿原酸 |  =9 966X-9 311 =9 966X-9 311 | 6.25~250.00 | 0.9996 |
| 隐绿原酸 |  =8 559.7X-5 503 =8 559.7X-5 503 | 3.00~120.00 | 0.9996 |
| 芦丁 |  =32 003X+177.85 =32 003X+177.85 | 0.08~3.00 | 0.9997 |
| 异槲皮苷 |  =36 956X+18.66 =36 956X+18.66 | 0.10~4.00 | 0.9990 |
| 山奈酚 |  =84 819X-24.072 =84 819X-24.072 | 0.05~2.00 | 0.9996 |
取同一批次的样品溶液,对样品进行日内、日间精密度的考察。日内精密度为同一份样品溶液在1 d内连续进样6次;日间精密度为连续3 d内,每天连续进样6次。计算各自峰面积的RSD值。结果发现6种成分日内、日间精密度RSD值为1.34%~4.90%。
2.1.3 重复性实验平行制备6份同一批次桑枝供试品溶液,按色谱条件进样20 μL,记录峰面积,计算桑枝中桑皮苷A、绿原酸、隐绿原酸、芦丁、异槲皮苷、山奈酚峰面积的RSD值分别为2.69%、4.09%、2.22%、4.70%、2.24%和2.57%。
2.1.4 稳定性实验取同一批次的供试品溶液分别在0、2、4、6、8、12、24 h进样分析,记录峰面积,计算峰面积的RSD值。结果表明6种成分RSD值为1.04%~3.07%。
2.1.5 加样回收率实验精密称取已知含量的桑枝药材0.125 g,分别精密加入桑枝中各个化合物含量的50%,按照“2.2”项下方法处理,以(测得量-原有量)/加标量×100%计算回收率。结果表明6种成分回收率为97.7%~104.0%,RSD值均小于2%。
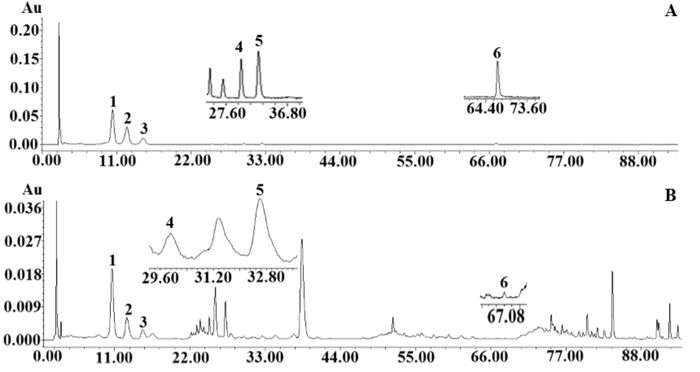
2.2 样品含量测定精密称取不同产地的桑枝样品,制备供试品溶液,利用所建立的分析方法对不同产地的桑枝样品进行了分析记录峰面积,代入回归方程计算得药桑枝中桑皮苷A、绿原酸、隐绿原酸、芦丁、异槲皮苷、山奈酚的含量,见表 3,典型色谱图如图 1所示。
| 样品 批次 | 购买地 (产地) | 桑皮 苷A | 绿原酸 | 隐绿 原酸 | 芦丁 | 异槲 皮苷 | 山奈酚 |
| 1 | 天津(湖北) | 3.400 9 | 0.459 3 | 0.205 9 | 0.006 0 | 0.007 6 | 0.001 4 |
| 2 | 天津(湖南) | 5.349 7 | 0.629 4 | 0.324 8 | 0.004 0 | 0.006 6 | 0.001 1 |
| 3 | 四川(四川) | 3.153 5 | 0.446 0 | 0.288 5 | 0.004 8 | 0.001 3 | 0.001 4 |
| 4 | 天津(广西) | 4.694 2 | 0.749 3 | 0.351 1 | 0.007 3 | 0.006 8 | 0.001 1 |
| 5 | 天津(江苏) | 9.949 2 | 0.643 9 | 0.326 7 | 0.006 4 | 0.002 9 | 0.001 9 |
| 6 | 天津(河北) | 6.652 4 | 0.933 2 | 0.480 3 | 0.009 5 | 0.011 5 | 0.001 0 |
| 7 | 天津(河北) | 6.474 0 | 0.948 3 | 0.440 6 | 0.007 2 | 0.010 8 | 0.000 7 |
| 8 | 天津(河北) | 3.694 5 | 0.533 5 | 0.284 5 | 0.005 8 | 0.007 1 | 0.002 1 |
| 9 | 天津 | 7.844 3 | 0.997 7 | 0.529 2 | 0.006 4 | 0.004 9 | 0.001 2 |
| 10 | 天津 | 5.250 3 | 0.736 5 | 0.349 5 | 0.006 9 | 0.005 8 | 0.001 3 |
| 11 | 天津 | 2.684 7 | 0.401 4 | 0.159 5 | 0.006 6 | 0.005 6 | 0.001 4 |
| 12 | 天津 | 3.868 0 | 0.638 5 | 0.396 9 | 0.003 7 | 0.003 6 | 0.000 8 |
| 13 | 天津 | 2.562 4 | 0.507 6 | 0.194 3 | 0.003 2 | 0.006 1 | 0.001 3 |
| 14 | 天津 | 1.375 4 | 0.226 0 | 0.210 2 | 0.004 5 | 0.005 3 | 0.001 2 |
| 15 | 天津 | 0.966 2 | 0.572 9 | 0.238 0 | 0.004 0 | 0.006 5 | 0.000 9 |
| 16 | 天津 | 2.750 1 | 0.420 9 | 0.188 7 | 0.006 3 | 0.009 3 | 0.000 8 |
| 17 | 天津 | 3.987 4 | 0.815 1 | 0.328 0 | 0.006 8 | 0.016 4 | 0.001 6 |
|
| 图 1 典型液相色谱图 Fig. 1 Typical HPLC chromatograms (A)标准品;(B)桑枝样品;1=桑皮苷A;2=绿原酸;3=隐绿原酸;4=芦丁;5=异槲皮苷;6=山奈酚 |
本研究考察了不同流动相组成[0.1%甲酸水-乙腈、0.1%磷酸水-乙腈、0.1%甲酸水-0.1%甲酸乙腈、0.1%甲酸水-甲醇:乙腈(1:1)]对化合物分离的影响,发现0.1%甲酸水-甲醇:乙腈(1:1)和0.1%甲酸水-乙腈(含0.1%甲酸)作为流动相时,出峰较慢、分析时间较长。0.1%甲酸水-乙腈作为流动相时,分离效果较好,故选用了0.1%甲酸水-乙腈作为流动相,进行梯度洗脱。考察了不同柱温(25、30、35、40 ℃)对分离的影响,确定柱温为25 ℃左右时所需化合物分离较好。
3.1 提取条件的选择本研究考察不同浓度甲醇(40%、60%、80%、100%)作为提取溶剂,对6种化合物总含量的影响,发现超声提取法提取45 min,80%甲醇超声提取效率最高。同时也考察了不同的提取时间(10、20、30、40 min)和料液比(1:10、1:20、1:30、1:50)对6种化合物提取率的影响,最终确定采用超声提取法,物料比(1g/mL)为1:20,用80%甲醇超声提取效率最高30 min为最佳提取方法。
3.2 不同批次桑枝化合物含量测定结果分析根据表 3可知不同产地桑枝中各化合物含量差异较大。对于产地相同的不同批次桑枝样品,其相同化合物的含量也存在差异,这可能与药材在其运输、储存等过程有关。根据桑皮苷A、绿原酸、隐绿原酸、芦丁、异槲皮苷及山奈酚6种化合物含量结果,发现桑枝中桑皮苷A的含量最高,其次为绿原酸、隐绿原酸,芦丁、异槲皮苷、山奈酚的含量相对较低。在所测桑枝中,江苏产地的桑皮苷A含量最高,河北产地的芦丁含量最高,其他4种化合物含量较高的产地尚不明确。所建立HPLC法同时测定桑枝中6种成分的含量,为桑枝药材的质量控制提供新方法。
| [1] | 国家药典委员会. 中华人民共和国药典(一部)[S]. 北京: 中国医药科技出版社, 2010: 280. |
| [2] | 洪德志, 时连根. 桑枝多糖对糖尿病模型小鼠的降血糖作用[J]. 中国药理学与毒理学杂志, 2012, 26 (6): 806–809. |
| [3] | 邬灏, 卢笑丛, 王有为. 桑枝多糖分离纯化及其免疫作用的初步研究[J]. 武汉植物学, 2005, 23 (1): 81–84. |
| [4] | 吴志平, 顾振纶, 谈建中, 等. 桑枝总黄酮的降血糖作用[J]. 中草药, 2005, 36 (增刊): 239–241. |
| [5] | 章丹丹, 高月红, JessicaTL, 等. 桑枝总黄酮的抗氧化活性研究[J]. 中成药, 2011, 33 (6): 943–946. |
| [6] | 方婧, 高霏, 吴宏伟, 等. 桑枝中桑皮苷A的含量测定[J]. 中国实验方剂学杂志, 2013, 19 (5): 80–82. |
| [7] | Zhou L. Extraction, separation and study of antioxidant acticity of flacones in Mulcerry wigs[D]. Chongqing:Southwestern University, 2011. |
| [8] | CHI JD, HE XF, LIU AR. HPLC determination of 6 flaconouds in Ginkgo leaves[J]. Acta Pharm Sin, 1997, 32 (8): 625. |
| [9] | SU X, Lu J. Comparation study on determination of total favonol glycoaides in the preparation of Cinkgo leaves by HPLC[J]. Chin J Pharm Anal, 1998, 18 (3): 186. |
 2017, Vol. 34
2017, Vol. 34