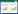文章信息
- 张嘉琰, 刘洋, 袁文玲, 高艺格, 张立平
- ZHANG Jia-yan, LIU Yang, YUAN Wen-ling, GAO Yi-ge, ZHANG Li-ping
- 柴芪汤对代谢综合征大鼠肠道损伤的干预作用研究
- Study on Chaiqi decoction on intestinal injury in rats with metabolic syndrome
- 天津中医药, 2017, 34(12): 830-835
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(12): 830-835
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.12.12
-
文章历史
- 收稿日期: 2017-07-12
2. 北京中医药大学研究生院, 北京 100029
代谢综合征(MS)是一组代谢异常性疾病,存在糖脂代谢异常、高血压、高尿酸血症等,其中肥胖是MS的启动因素,而胰岛素抵抗(IR)是其中心环节,MS目前已成为威胁全世界公共健康的“隐形杀手”之一[1]。肠道是机体营养物质消化吸收的主要场所,与外界相通,最容易受到氧自由基、炎性因子等的攻击。MS进程中的糖脂代谢紊乱、氧化应激炎性反应均可引起肠神经系统功能紊乱、胃肠激素分泌异常、胃肠动力障碍、肠黏膜屏障受损、通透性增加,内毒素入血以及肠道菌群改变等[2-3]。肠道内毒素入血诱发机体炎症反应,又可加速MS的进展。本研究拟采用高盐高脂高糖饮食诱导MS大鼠模型,探讨MS大鼠存在的肠道动力及病理学改变,观察柴芪汤对MS大鼠肠道损害的干预作用。
1 材料与方法 1.1 实验动物及饲料SPF级SD雄性大鼠40只,6~8周龄,体质量(180±20)g,购于北京维通利华实验动物技术有限公司。高盐高脂高糖饲料组成为52.5%基础饲料,20%熟猪油,2%胆固醇,10%奶粉,10%果糖,5%食用盐,0.5%胆盐,由北京科澳协力饲料有限公司提供。
1.2 药物、主要试剂及仪器药物:中药柴芪汤颗粒(黄芪30 g,柴胡10 g,白术10 g,枳实10 g,三七粉3 g)购自北京康仁堂药业有限公司,西药盐酸吡格列酮(生产厂家:北京太洋药业股份有限公司,批号:H20063525)。试剂盒:空腹血糖(FBG)、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)测试盒购自上海科华生物工程股份有限公司,空腹胰岛素(FINS)放免检测试剂盒购自北京北方生物技术研究所有限公司,批号:20170101。肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)及酶联免疫吸附实验(ELISA)检测试剂盒购自武汉伊莱瑞特生物科技有限公司。仪器:全自动生化分析仪(型号科华ZY KHB-1280),GC-1200全自动放免计数仪,Softron BP-98A智能无创血压计。
1.3 实验方法 1.3.1 分组、造模及给药 1.3.1.1 分组将40只大鼠适应性喂养1周后,按随机数字表法随机分为4组:正常组、模型组、中药组、西药组,每组10只。
1.3.1.2 造模除正常组给予普通饲料外,其余3组均给予高盐高脂高糖饲料喂养,共16周,建立MS模型。
1.3.1.3 给药自造模第1天起持续灌胃16周,大鼠给药量按照“人和动物体表面积折算的等效剂量比值表”计算,中药柴芪汤颗粒按照1.142 g/mL的浓度配制成中药汤剂,每只5.71 g/(kg·d)灌胃;西药盐酸吡格列酮按照0.54 mg/mL浓度配制成混悬液,每只2.7 mg/(kg·d)灌胃;同期正常组与模型组大鼠给予5 mL/(kg·d)生理盐水灌胃对照。
1.3.2 血压测量、取材及小肠推进率 1.3.2.1 血压检测使用Softron BP-98A智能无创血压计测量并记录大鼠收缩压(SBP),舒张压(DBP),平均动脉压(MBP)。
1.3.2.2 取材第16周末禁食不禁水12 h,称质量后以10%水合氯醛溶液(4 mL/kg)腹腔注射麻醉,于腹主动脉取血,静置1 h,置于离心机4 ℃,4 000 r/min离心15 min,分离上层血清,分装冻存待测。以盲肠为起点,往前5 cm取回肠远端肠段,共4 cm,2 cm用冰生理盐水冲洗,置于4%多聚甲醛溶液中,2 cm用冰生理盐水冲洗,置于冻存管中,-80 ℃冰箱冻存待用。
1.3.2.3 小肠推进率检测大鼠处死前20 min给予12%碳末混悬液0.02 mL/g灌胃,取肠管,量取幽门至碳末推进前沿的长度以及小肠总长度,按照公式:(从幽门部到碳末推进前沿的推进距离/大鼠小肠总长)×100%,计算小肠碳末推进百分率。
1.3.3 指标检测及计算使用全自动生化分析仪测定大鼠血清TC、TG、HDL-C、LDL-C、FBG,ELISA法检测血清IL-6、TNF-α,使用GC-1200全自动放免计数仪测定FINS,操作步骤严格按试剂盒说明进行。使用稳态模型HOMA,计算IRI,IRI=(FBG×FINS)/22.5。
1.3.4 小肠苏木精-伊红(HE)染色石蜡切片:将固定好的回肠组织从多聚甲醛中取出,流水过夜后脱水机梯度脱水,常规石蜡包埋,以4 μm连续切片行HE染色,光镜下观察大鼠小肠病变情况,并于采集图像后测量肠绒毛高度与隐窝深度,计算绒腺比=绒毛高度/隐窝深度。
1.3.5 Western blot法检测大鼠小肠NF-κB p65蛋白表达小肠组织匀浆,提取上清液,BCA法测总蛋白含量。之后将蛋白高温变性,行聚丙酰胺凝胶电泳,转移至PVDF膜,5%脱脂奶粉室温封闭1 h。NF-κB p65抗体孵育过夜,次日洗涤后加山羊抗兔二抗孵育1 h,再次洗膜后滴加ECL发光试剂,曝光显影,对条带进行半定量分析,利用软件读取积分光密度值(OD),以目的蛋白的OD值除以内参(β-actin)条带的OD值作为最终结果进行统计。
1.4 统计学处理应用SPSS 20.0统计学软件进行处理,计量资料用均数±标准差(x±s)表示,符合正态分布的计量资料组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用LSD法,偏态分布的计量资料组间比较采用非参数检验,P<0.05表示差异有统计学意义。
2 结果在造模及药物干预过程中,大鼠存在一定死亡率,至第16周末,模型组样本为10只,正常组为8只,中药、西药组样本数均为7只。经模型评价,第16周末,模型组大鼠血糖、血脂、IR、血压均明显高于正常组,体质量明显高于正常组,MS模型造模成功。
2.1 各组大鼠体质量、血压比较第16周末,模型组大鼠体质量显著高于正常组(P<0.05),中、西药组大鼠体质量明显低于模型组,高于正常组,差异均有统计学意义(P<0.05)。模型组大鼠SBP、DBP、MBP均明显高于正常组(P<0.05),中、西药组SBP、MBP较模型组显著降低,仍高于正常组,差异有统计性(P<0.05)。中、西药组DBP明显低于模型组,但与正常组相比无统计学差异(P>0.05)。见表 1。
| 组别 | 动物数 | 体质量(g) | SBP(mmHg) | DBP(mmHg) | MBP(mmHg) |
| 正常组 | 8 | 523.44± 9.89 | 110.63±13.16 | 84.63±11.59 | 93.50±11.90 |
| 模型组 | 10 | 664.2±38.42* | 155.30±12.17* | 118.30±12.51* | 130.70±10.93* |
| 中药组 | 7 | 587.86±27.26*# | 136.86± 7.36*# | 102.71±13.59# | 114.14±10.57*# |
| 西药组 | 7 | 579.12±55.75*# | 129.57± 7.30*# | 98.86± 5.73# | 109.29± 4.31*# |
| 注:与正常组比较,*P<0.05;与模型组比较,#P<0.05。1 mmHg=0.133 kPa。 | |||||
第16周末,模型组大鼠血清FBG、FINS水平显著高于正常组(P<0.05),中、西药组FBG、FINS水平较模型组显著为低,高于正常组(P<0.05)。模型组IRI明显高于正常组(P<0.05),中、西药组IRI较模型组显著降低,高于正常组(P<0.05),且中药组IRI更加低于西药组,差异均有统计学意义(P<0.05)。见表 2。
| 组别 | 动物数 | FBG(mmol/L) | FINS(μU/mL) | IRI |
| 正常组 | 8 | 6.35±0.45 | 7.88±1.13 | 2.21±0.28 |
| 模型组 | 10 | 10.51±0.73* | 12.86±1.01* | 6.00±0.59* |
| 中药组 | 7 | 8.2±1.34*# | 9.64±1.09*# | 3.54±0.77*#※ |
| 西药组 | 7 | 9.56±0.51*# | 10.41±1.08*# | 4.42±0.52*# |
| 注:与正常组比较,*P<0.05;与模型组比较,#P<0.05;与西药组比较,※P<0.05。 | ||||
模型组大鼠血清TG、TC、LDL-C水平显著高于正常组,中、西药组上述指标明显低于模型组,高于正常组(P<0.05)。模型组HDL-C水平明显低于正常组,中、西药组HDL-C高于模型组,低于正常组,差异有统计学意义(P<0.05)。见表 3。
| mmol/L | |||||
| 组别 | 动物数 | TG | TC | HDL-C | LDL-C |
| 正常组 | 8 | 0.47±0.21 | 1.48±0.20 | 1.11±0.21 | 0.78±0.14 |
| 模型组 | 10 | 2.02±0.76* | 3.18±0.67* | 0.55±0.07* | 1.63±0.58* |
| 中药组 | 7 | 0.48±0.13# | 2.42±0.55*# | 0.77±0.16*# | 1.10±0.26*# |
| 西药组 | 7 | 0.75±0.80# | 2.10±0.47*# | 0.72±0.20*# | 1.07±0.16*# |
| 注:与正常组比较,*P<0.05;与模型组比较,#P<0.05。 | |||||
第16周末模型组大鼠血清IL-6、TNF-α含量明显高于正常组(P<0.05),中、西药组IL-6、TNF-α含量显著低于模型组,高于正常组,差异有统计学意义(P<0.05)。见表 4。
| ng/L | |||
| 组别 | 动物数 | IL-6 | TNF-a |
| 正常组 | 8 | 81.33±4.90 | 173.16±8.12 |
| 模型组 | 10 | 114.51±4.25* | 248.01±22.76* |
| 中药组 | 7 | 103.38±6.24*# | 214.68±17.27*# |
| 西药组 | 7 | 103.78±6.59*# | 217.38±11.05*# |
| 注:与正常组比较,*P<0.05;与模型组比较,#P<0.05。 | |||
模型组大鼠小肠推进率明显低于正常组(P<0.05),中、西药组大鼠小肠推进率显著高于模型组,但低于正常组,差异有统计学意义(P<0.05)。见表 5。
| 组别 | 动物数 | 小肠推进率(%) |
| 正常组 | 8 | 72.62±10.24 |
| 模型组 | 10 | 48.00± 9.67# |
| 中药组 | 7 | 58.50± 7.41*# |
| 西药组 | 7 | 59.88± 0.09*# |
| 注:与正常组比较,*P<0.05;与模型组比较,#P<0.05。 | ||
模型组大鼠小肠绒毛高度、绒腺比均明显小于正常组(P<0.05),中、西药组小肠绒毛高度、绒腺比显著大于模型组,小于正常组,差异均有统计学意义(P<0.05)。模型组大鼠小肠隐窝深度显著大于正常组(P<0.05),中、西药组隐窝深度较模型组有所减小,仍大于正常组(P<0.05)。见表 6。
| 组别 | 动物数 | 绒毛高度(μm) | 隐窝深度(μm) | 绒腺比 |
| 正常组 | 8 | 479.12±72.24 | 111.17±7.76 | 4.32±0.69 |
| 模型组 | 10 | 257.78±21.88* | 139.57±1.46* | 1.85±0.17* |
| 中药组 | 7 | 352.49±33.40*# | 123.62±7.21*# | 2.85±0.28*# |
| 西药组 | 7 | 369.49±21.79*# | 124.80±8.25*# | 2.96±0.18*# |
| 注:与正常组比较,*P<0.05;与模型组比较,#P<0.05。 | ||||
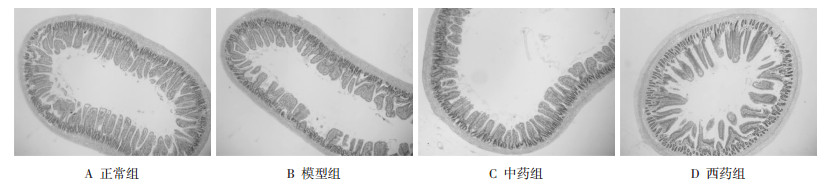
40倍放大及100倍放大可见,正常组小肠肌层完整,厚薄较均匀,无黏膜充血水肿,上皮隐窝及绒毛排列较整齐、致密,刷状缘较整齐,黏膜上皮细胞与杯状细胞相间排列,排列较整齐。模型组小肠局部肌层较薄,绒毛变短,高低不齐,相邻绒毛融合,间隙变宽,排列疏松有缺失。隐窝数量减少,排列疏松有缺失,局部隐窝加深,上皮细胞脱落,部分腺体碎裂。中药组小肠绒毛排列较模型组紧密且规则,绒毛高度略高于模型组,相邻绒毛融合,间隙变宽,隐窝排列较紧密,肌层较模型组略厚,上皮细胞与杯状细胞相间排列,黏膜有轻微充血,局部腺体破裂。西药组相邻绒毛相融变宽,排列疏松有缺失,间隙增大,隐窝排列较模型组紧密,仍有缺失,部分腺体碎裂。见图 1及图 2。
|
| 图 1 小肠HE染色图片(×40倍) Fig. 1 Small intestine HE staining picture(×40 times enlarge) |
|
| 图 2 小肠HE染色图片(×100倍) Fig. 2 Small intestine HE staining picture(×100 times enlarge) |
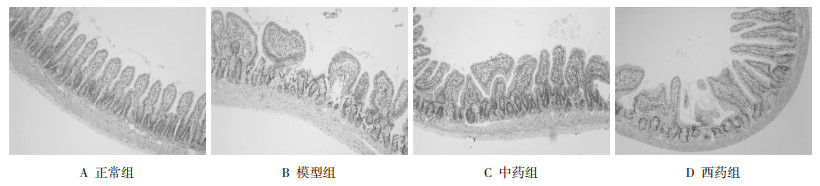
第16周末,模型组大鼠小肠NF-κB p65的表达显著强于正常组,中、西药组NF-κB p65的表达较模型组明显减弱,仍强于正常组,差异均有统计学意义(P<0.05)。见表 7及图 3。
| 组别 | 动物数 | NF-κB p65 |
| 正常组 | 8 | 0.31±0.03 |
| 模型组 | 10 | 0.61±0.10* |
| 中药组 | 7 | 0.44±0.03*# |
| 西药组 | 7 | 0.38±0.13*# |
| 注:与正常组比较,*P<0.05;与模型组比较,#P<0.05。 | ||
|
| 图 3 各组小肠NF-κB p65蛋白表达 Fig. 3 Expression of NF-κB p65 protein in small intestine 1 模型组;2 模型组;3 西药组;4 西药组;5 正常组;6 正常组;7 中药组;8 中药组。 |
MS存在的糖脂代谢紊乱与肠道损伤互相作用,互为因果。高脂摄入过多诱发的氧化应激反应使得肠黏膜细胞脂质过氧化,损伤肠黏膜组织,影响肠神经系统、迷走神经,改变胃肠道神经信号,导致胃肠激素分泌紊乱,抑制性神经递质分泌增多,导致肠蠕动减慢[4]。还可影响肠上皮紧密连接蛋白的表达,导致肠道通透性增加,诱发炎症反应[5]。同样,血糖代谢紊乱也可造成大鼠兴奋性神经递质释放减少,肠蠕动减慢,肠道平滑肌松弛[6]。肠道蠕动减慢、通透性增加,导致肠源性内毒素入血,诱发机体炎症反应,导致肥胖、MS等病变。小肠是机体营养物质消化吸收的主要场所,小肠绒毛高度、隐窝深度等都是反映消化吸收功能的重要指标。绒毛高度增加可以使小肠吸收面积增大,利于营养物质的吸收。隐窝深度减小说明绒毛上皮成熟细胞率上升,分泌功能增强。绒毛高度与隐窝深度的比值(绒腺比)能反映小肠上皮细胞的更新代谢程度[7]。食物的消化吸收需要小肠的收缩和舒张来完成,肌层厚度与小肠动力呈正比,小肠黏膜层分布着数量不等的多种细胞,在消化吸收过程中发挥着各自的不同作用[8]。
本课题组长期致力于脾胃运化功能和慢性代谢性疾病的相关性研究,通过前期动物实验及大样本临床观察发现,具有健脾功效的柴芪汤对MS及其血管、肝、肾损害均有一定的干预作用,对代谢性疾病出现的腹胀、腹痛、腹泻等有确切的疗效。脾主运化,脾虚则胃肠推动无力。肝主疏泄,调畅气机,若肝失疏泄,横逆克脾,则不能疏泄水谷,渗泄中满之症在所不免,故胃肠动力改变出现的腹胀、腹痛、腹泻等多以肝脾不和,土虚木乘为基本病机[9]。柴芪汤以黄芪补中益气,柴胡疏肝解郁、调畅气机,合为君药;白术补脾益气,燥湿利水,配合黄芪行补脾燥湿之力,为臣药;枳实行气化痰,消积导滞,三七活血化瘀,共为佐使,共奏活血化瘀,理气导滞之功。现代药理研究显示,黄芪主要生物活性成分黄芪多糖、黄芪甲苷可降低大鼠血糖[10-11]、改善胰岛素抵抗[12]、降血脂[13]、降压等,有增强小肠运动和平滑肌紧张度的效应[14],参类有兴奋神经作用,可调节胃肠运动,白术具有抗炎、抗氧化的作用,可双向调节肠管运动,柴胡具有显著的抗炎作用,抑制炎症介质释放、白细胞游走和结缔组织的增生,可促进胃排空[15]。枳实具有抑制脂质过氧化、降血糖、兴奋胃肠道平滑肌,促进胃肠蠕动的作用[16]。三七主要活性成分三七皂苷有抗凝、抑制血小板聚集、改善微循环、降血脂等功能[17]。
本研究结果显示,柴芪汤可显著改善MS大鼠糖脂代谢紊乱,加快小肠推进率,减轻高脂高糖饮食对胃肠动力的影响,抑制肠道炎性反应。在本实验中,模型组大鼠小肠绒毛高度较模型组明显变短,排列疏松有缺失,高低不齐,隐窝深度变大,局部肌层变薄,说明模型组大鼠发生了严重的肠道损伤。柴芪汤组肠道病理损害较模型组显著为轻,说明柴芪汤可显著改善MS大鼠肠道病理损害。
IL-6、TNF-α是与炎症反应密切相关的炎性介质,正常情况下,体液中TNF-α和IL-6处于较低水平,当机体发生病理性改变后,两种炎性因子分泌量显著增加,同时引起其他炎症因子瀑布式释放[18]。NF-κB p65是真核细胞转录因子,可诱导TNF-α、IL-6的基因表达,同时TNF-α又能诱导IL-6的合成。本实验表明,柴芪汤可通过抑制NF-κB p65炎性信号通路,调控IL-6、TNF-α的表达,减轻机体及肠道的炎性损伤。研究表明,炎性因子对胃肠动力有重要影响[19],可能机制为炎性介质可损害肠黏膜的上皮屏障功能、免疫系统调节作用,导致肠道炎性细胞及免疫细胞浸润,进而增加炎性介质的释放,引发胃肠道平滑肌功能紊乱,胃肠动力改变[20]。本研究表明,柴芪汤可通过调节炎性信号通路,抑制炎性因子的产生和释放,显著减轻肠道炎性反应,改善肠道动力的损伤。
从本研究可看出,盐酸吡格列酮对MS大鼠糖脂代谢紊乱、血压、肠道动力及病理损害的干预作用与柴芪汤相似,两者的干预效果无明显差异性。盐酸吡格列酮为噻唑烷二酮类胰岛素增敏剂,激活过氧化体增殖子活化受体(PPAR),增加肝脏及肌肉PPAR-γ的表达,调节与糖、脂质及脂蛋白代谢相关的多种基因、蛋白的表达以及酶活性,改善胰岛素抵抗,增加对血脂、血糖的清除能力,起到降糖、降脂的作用[21]。但是,长期服用盐酸吡格列酮会产生上呼吸道感染、腹泻、水肿、头痛等不良反应,考虑其可能与噻唑烷二酮类药物具有轻度的血管扩张作用和体液潴留有关[22]。
综上所述,具有健脾疏肝功效的柴芪汤可抗炎,改善胰岛素抵抗,调节MS大鼠糖、脂代谢紊乱,从而减轻机体及肠道炎性反应,提高胃肠动力,改善MS大鼠的肠道病理损害。中药具有毒副作用小、成本低、多靶点作用等优势,研究柴芪汤防治代谢综合征性肠道损害,可为临床健脾疏肝法治疗代谢综合征患者肠道功能紊乱等提供可靠的理论依据及借鉴。
| [1] | Jaspinder Kaur. A comprehensive review on metabolic syndrome[J]. J Cardiology Research and Practice, 2014, 4 (7): 21. |
| [2] | 乔艺. 高脂诱导的氧化应激对小鼠肠道菌群改变与炎症反应的影响[D]. 无锡: 江南大学, 2014: 1-109. http://cdmd.cnki.com.cn/Article/CDMD-10295-1014370654.htm |
| [3] | 季洪赞, 吴晓尉, 许小兵, 等. 老年功能性肠病与高血压缺血性肠病的相关性[J]. 中国老年学杂志, 2012, 32 (13): 2701–2703. DOI:10.3969/j.issn.1005-9202.2012.13.010 |
| [4] | 孙艳艳. 有氧运动和高脂饮食对大鼠肠神经功能的影响[D]. 广州: 华南师范大学, 2013: 1-59. http://d.wanfangdata.com.cn/Thesis_Y2341718.aspx |
| [5] | 邬应龙, 王文婷. RS4型抗性淀粉对高脂饮食C57BL/6J小鼠肠绒毛形态及肠道菌群的影响[J]. 营养卫生, 2013, 34 (21): 333–338. |
| [6] | 雷亚宁, 丁友梅, 钱旭, 等. 糖尿病大鼠胃肠动力及肌间神经丛形态学改变[J]. 中华消化杂志, 2006, 2 (10): 666–669. DOI:10.3760/j.issn:0254-1432.2006.10.005 |
| [7] | Cani PD, Bibiloni R, Knauf C, et al. Changes in gut microbiota control metabolic endotoxemia-induced inflammation in high-fat diet-induced obesity and diabetes in mice J[J]. Diabetes, 2008, 57 (6): 1470–1481. DOI:10.2337/db07-1403 |
| [8] | 周艳华, 张晓. 运动后大鼠小肠壁形态学变化的研究[J]. 山西师范大学学报, 2005, 19 (1): 88–90. |
| [9] | 舒健, 董筠. 健脾疏肝温清并用治疗腹泻型肠易激综合征探讨[J]. 山东中医药大学学报, 2017, 41 (1): 27–28. |
| [10] | 熊凡, 熊伟, 孙静. 黄芪对糖尿病大鼠血糖及脂质过氧化物作用的影响[J]. 湖北中医学院学报, 2003, 5 (2): 20–21. |
| [11] | 谢春英. 黄芪甲苷降血糖作用的实验研究[J]. 中药材, 2010, 33 (8): 1319–1320. |
| [12] | 刘洪凤, 郭新民, 王桂云, 等. 黄芪多糖对2-DM胰岛素抵抗大鼠血糖及血脂的影响[J]. 牡丹江医学院学报, 2007, 28 (5): 28–20. |
| [13] | 童红莉, 田亚平, 汪德清, 等. 黄芪多糖对高脂血症大鼠血脂的调节[J]. 中国临床康复, 2006, 10 (11): 68–70. DOI:10.3321/j.issn:1673-8225.2006.11.029 |
| [14] | 杨德志, 毕庆和, 丁霭玲, 等. 黄芪对小肠电活动的影响[J]. 中国中西医结合杂志, 1993, 13 (10): 616–617. DOI:10.3321/j.issn:1003-5370.1993.10.015 |
| [15] | 滑永志. 健脾疏肝行气降逆法治疗反流性食管炎的临床和实验研究[D]. 南京: 南京中医药, 2007: 1-57. http://cdmd.cnki.com.cn/Article/CDMD-10315-2007223392.htm |
| [16] | 刘敏, 丁雷, 丁霞. 重用枳实白术治疗胃下垂[J]. 中国中医药信息杂志, 2007, 14 (5): 81. |
| [17] | 王喜福, 曲华清, 王鑫, 等. 三七总皂苷联合银杏黄酮对高脂血症大鼠血液流变性的影响[J]. 中国血液流变学杂志, 2010, 20 (1): 13–16. |
| [18] | Choileain NN, Redmond HP. J Cell response to surgery[J]. Arch surg, 2006, 141 (11): 113–115. |
| [19] | Bercik P, Verdu EF, Collins SM. Is irritable bowel syndrome a low-grade inflammatory bowel disease[J]. J Gastroenterol Clin North Am, 2005, 34 (2): 235–245. |
| [20] | Friedrich M, Grady SE, Wall GC. Effects of antidepressants in patients with irritable bowel syndrome and comorbid depression[J]. J Clin Ther, 2010, 32 (7): 1221–1233. DOI:10.1016/j.clinthera.2010.07.002 |
| [21] | 刘辉文. 噻唑烷二酮类药物改善2型糖尿病患者血脂谱的作用及其意义[J]. 医药导报, 2006, 9 (9): 879–881. |
| [22] | 汪艳芳, 马书平, 赵志刚, 等. 罗格列酮治疗2型糖尿病多项目临床观察[J]. 实用诊断与治疗杂志, 2004, 18 (3): 166–167. |
2. Graduate School, Beijing University of Chinese Medicine, Beijing 100029, China
 2017, Vol. 34
2017, Vol. 34