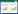文章信息
- 李虎虎, 魏冰, 曾文赟, 索艳荣, 高青, 王一婧, 孙英新, 张云莎, 范英昌, 杨琳
- LI Hu-hu, WEI Bing, ZENG Wen-yun, SUO Yan-rong, GAO Qing, WANG Yi-jing, SUN Ying-xin, ZHANG Yun-sha, FAN Ying-chang, YANG Lin
- 黄芪注射液抑制糖尿病大鼠海马神经元凋亡的机制研究
- Study on the mechanism of the inhibitory action of Huangqi injection on apoptosis of hippocampal neurons in diabetic encephalopathy rats
- 天津中医药, 2017, 34(12): 836-840
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(12): 836-840
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.12.13
-
文章历史
- 收稿日期: 2017-06-25
2. 赣州市人民医院, 赣州 341000
糖尿病是一种以血糖升高为主要特征的代谢障碍综合征。越来越多的研究[1]显示长期慢性高血糖状态可对中枢神经系统(CNS)造成损害,进而发展为糖尿病脑病,主要临床表现以认知障碍、学习和记忆能力下降为主。最近研究表明[2-3],神经细胞凋亡和海马组织细胞的增殖、迁移、分化紊乱在糖尿病的发生中起到了重要作用,其中胆碱能神经元的退化被认为是造成糖尿病认知障碍的重要病理因素。本课题组前期工作证实黄芪注射液可以抑制链脲佐菌素(STZ)诱导的Ⅰ型糖尿病大鼠海马神经元的凋亡。故本实验基于前期研究,进一步探讨黄芪注射液是否通过抑制海马神经元的凋亡以改善糖尿病大鼠的认知功能。
1 材料与方法 1.1 材料 1.1.1 实验动物SPF级Wistar大鼠40只,雄性,体质量(220±20)g,购自北京华阜康生物科技股份有限公司,动物许可证号:SCXK(京)2014-003。全程普通饲料喂养,自由摄食、饮水。动物房室温20~25 ℃,相对湿度50%~70%,12 h光照维持,昼夜循环。
1.1.2 实验试剂与药品黄芪注射液(Huangqi Injection, HI),河北神威药业(国药准字:Z13020999);链脲佐菌素(STZ),美国Sigma-Aldrich公司(Cat#:S0130);葡萄糖测定试剂盒,上海荣盛生物技术有限公司(Cat#:CAT361500);胰岛素ELISA检测试剂盒,美国Cloud-Clone Corp(Cat#:CEA448Ra);乙酰胆碱酯酶(AchE),南京建成生物工程研究所(Cat#:A024);SYBR Green试剂盒,北京天根生化科技有限公司(Cat#:FP205-02);AchE兔抗大鼠多克隆抗体,武汉博士德生物工程有限公司(Cat#:PB0382);Caspase-3兔抗大鼠多克隆抗体,武汉博士德生物工程有限公司(Cat#:PB0183);羊抗兔IgG-Biotin, 武汉博士德生物工程有限公司(Cat#:BA1003)。
1.1.3 实验仪器Morris水迷宫及水迷宫记录分析系统(安徽正华生物仪器设备有限公司);实时荧光定量PCR仪,美国ABI公司(7500fast);PowerPac Basic基础电泳仪,美国Bio-Rad公司(164-5050);凝胶成像系统,美国Bio-Rad公司(ChemiDoc XRS)。
1.2 方法 1.2.1 模型制备40只雄性Wistar大鼠适应性喂养1周后,从中随机选出10只作为空白组,其余作为糖尿病模型组。隔夜禁食不禁水12 h,模型组一次性腹腔注射1% STZ溶液60 mg/kg体质量,对照组则给予等体积柠檬酸-柠檬酸钠缓冲液。72 h后观察大鼠一般状态(饮食、饮水、排泄、毛色及精神状态等),经目内眦取血,离心取血清测空腹血糖(FBG)含量。大鼠FBG大于16.7 mmol/L为造模成功,未成模大鼠则淘汰出组。
1.2.2 实验分组将存活的20只模型组大鼠再随机分为2组:模型组,黄芪注射液组(1.6 mL/kg)。在STZ干预后2周开始给药,给药组每日上午按剂量腹腔注射黄芪注射液,空白组和模型组则给予等体积生理盐水,连续给药10周。
1.2.3 血糖和体质量测定分别于造模后第0、4、10周末测定大鼠FBG值。每周测定体质量变化。
1.2.4 Morris水迷宫实验建模干预第10周后,所有大鼠在Morris水迷宫中进行4 d训练,考察逃避潜伏期大鼠学习能力,第5天撤去平台,系统自动记录90 s内各组大鼠在目标象限的平均时间及穿越跳台的次数,以此测试大鼠空间记忆能力。
1.2.5 样本制备行为学实验结束后,水合氯醛麻醉大鼠,打开腹腔,腹主动脉取血,分离血清保存,待检备用。然后断头取海马细胞。
1.2.6 血清乙酰胆碱酯酶检测乙酰胆碱酯酶水解乙酰胆碱生成胆碱及乙酸,胆碱可以与巯基显色剂反应生成三硝基苯黄色化合物,根据颜色深浅在波长412 nm处进行比色定量,从而反映胆碱酯酶的活力。
1.2.7 Real-time PCR检测大鼠海马中Bcl-2和Bax的mRNA表达RNA提取:新鲜海马组织称质量后使用Trizol Reagent试剂盒提取总RNA,超微量紫外分光光度计测定A260/A280的比值及RNA浓度;cDNA合成:按照反转录试剂盒说明冰上操作,合成cDNA于-80 ℃保存备用;荧光定量PCR实验:引物设计与合成引物序列检索自Primer-Bank,引物序列见表 1,按照实时荧光定量PCR试剂盒说明冰上操作,进行基因的扩增。实验重复3次以确保结果可靠性。
| 名称 | 引物序列(5’-to-3’) | 引物 |
| Bcl-2 | forward, 5’-GAGCGTCAACAGGGAGATGT-3' reverse, 5’-CAGCCAGGAGAAATCAAACAG-3’ |
166 bp |
| Bax | forward, 5’-ACGCATCCACCAAGAAGC-3’ reverse, 5’-GCCACACGGAAGAAGACCT-3’ |
130 bp |
| GAPDH | forward, 5’-GTTACCAGGGCTGCCTTCTC-3’ reverse, 5’-GATGGTGATGGGTTTCCCGT-3’ |
177 bp |
新鲜海马称质量,加入装有适量裂解液的匀浆管中,组织经匀浆破碎后,用BCA法进行蛋白定量。根据目的蛋白分子量配制SDS-PAGE分离胶,蛋白上样后电泳,恒流湿转,免疫印迹,蛋白免疫印迹(Western blot)条带经凝胶成像分析系统扫描处理,用FUSION软件分析各组与内参(β-actin)条带灰度值,计算相对表达量。
1.2.9 免疫组织化学法检测海马Caspase-3的表达采用抗生物素蛋白-生物素-过氧化物酶复合物法进行免疫组织化学染色,对糖尿病大鼠凋亡相关蛋白Caspase-3表达进行测定。脑片用兔抗Caspase-3(1:100稀释)4 ℃孵育24 h后用生物素化的抗兔IgG孵育1 h,再用辣根酶标记的链霉卵白素室温孵育2 h,最后DAB显色,光镜下观察,自来水冲洗终止,苏木素复染核,中性树脂胶封片。采用Image-Proplus软件,在40×10倍光镜下计数每张切片海马CA1、CA3及DG区5个视野细胞数并进行统计。
1.2.10 统计分析所有实验数据用均数±标准差(x±s)表示,对于正态分布且方差齐的计量资料的组间差异比较使用单因素方差分析法,非正态分布或方差不齐的计量资料的组间差异比较使用非参数检验法,用SPSS 18.0软件进行统计分析。
2 结果 2.1 黄芪注射液对糖尿病大鼠体质量、血糖和胰岛素的影响 2.1.1 体质量造模干预前,各组间大鼠体质量无明显差异(P>0.05)。干预后,对照组大鼠体质量升高,毛色光亮,摄食,饮水、尿量正常,而模型组和黄芪注射液组体质量随病程延长均有所降低,出现明显的“三多一少”症状,与空白组比较均有统计学差异(P<0.01)。黄芪注射液组与模型病组比较,体质量虽有所改善,但差异无统计学意义(P>0.05)。见表 2。
| 组别 | 体质量(g) | 血糖(mg/dL) | 膀岛素(pg/mL) | |||||
| 实验前 | 实验后 | 实验前 | 实验后 | 实验前 | 实验后 | |||
| 空白组 | 210.68±18.56 | 348.54±40.77 | 6.47±0.95 | 6.25±1.02 | 961.67±84.26 | 1 088.36±184.42 | ||
| 模型组 | 213.43±12.16 | 153.24±24.44## | 6.29±0.81 | 18.53±2.51## | 199.28±53.65## | 201.66± 55.36## | ||
| 黄芪注射液组 | 217.14±17.77 | 162.87±20.19 | 6.56±0.82 | 12.96±1.31** | 198.42±52.61 | 672.72± 86.75** | ||
| 注:与正常组比较,##P<0.01;与模型组比较,**P<0.01。 | ||||||||
造模干预前,大鼠的FBG在(6.4±0.8)mmol/L,无自发性高血糖表现,各组间比较无差异(P>0.05)。在STZ干预后,可见空白组大鼠较之初始血糖无变化,而模型组和黄芪注射液组血糖均显著升高,与空白组比较均有统计学差异(P<0.01);黄芪注射液干预后,血糖水平明显降低,较之模型组有明显差异(P<0.01)。见表 2。
2.1.3 胰岛素造模干预前,大鼠空腹胰岛素水平在(891±71)pg/mL,各组间比较无统计学差异(P>0.05)。在STZ干预后,空白组大鼠胰岛素水平较实验前无统计学差异(P>0.05),而模型组和黄芪注射液组均显著下调,与空白组比较均有统计学差异(P<0.01)。在黄芪注射液干预后,其胰岛素水平显著升高,较模型组有统计学差异(P<0.01)。见表 2。
以上结果表明黄芪注射液有降低糖尿病大鼠的FBG,并升高胰岛素水平的作用。
2.2 Morris水迷宫测试结果与空白组进行比较,模型组大鼠穿越平台的位置次数及在目标象限的平均时间百分比均明显下降,具有统计学差异(P<0.01);黄芪注射液干预后,黄芪注射液组与模型组大鼠相比较,穿越平台的位置次数及在目标象限的平均时间百分比均明显升高,具有统计学差异(P<0.01)。见表 3。
| 组别 | 穿越平台的次数 | 在目标象限的平均时间百分比(%) |
| 空白组 | 2.81±0.65 | 28.37±4.17 |
| 模型组 | 0.75±0.08## | 22.37±0.76# |
| 黄芪注射液组 | 2.16±0.47** | 37.23±3.65** |
| 注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,**P<0.01。 | ||
与空白组进行比较,模型组大鼠血清AchE活力明显升高,具有统计学差异(P<0.01);黄芪注射液干预后,黄芪注射液组与模型组大鼠相比较,AchE活力明显下降,差异有统计学意义(P<0.05)。
2.4 黄芪注射液对糖尿病大鼠海马区域Bax和Bcl-2 mRNA表达情况的影响与空白组相比,模型组大鼠海马Bax mRNA的表达明显升高(P<0.01),而Bcl-2 mRNA的表达明显降低(P<0.01);黄芪注射液干预后,黄芪注射液组与模型组大鼠相比较,Bax mRNA的表达明显下降,差异有统计学意义(P<0.05),而且Bcl-2 mRNA的表达明显升高,差异有统计学意义(P<0.05)。见表 4。
| 组别 | Bax | Bcl-2 |
| 空白组 | 1.01±0.09 | 1.01±0.16 |
| 模型组 | 2.29±0.46## | 0.52±0.196## |
| 黄芪注射液组 | 1.84±0.17** | 0.81±0.19** |
| 注:与空白组比较,##P<0.01;与模型组比较,**P<0.01。 | ||
与空白组比较,模型组大鼠海马Ache及Caspase-3的蛋白表达均明显升高,差异具有统计学意义(P<0.05);黄芪注射液组与模型组相比较,Ache及Caspase-3的表达均明显下降,差异具有统计学意义(P<0.05),其中,Caspase-3蛋白的下降趋势更为明显。见图 1。
|
| 图 1 各组大鼠海马Ache及Caspase-3的蛋白表达情况 Fig. 1 Expression of the protein of Ache and Caspase-3 in hippocampal area of rats in each group 与空白组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01 |
光镜下观察,Caspase-3免疫组化阳性细胞表现为大量神经细胞胞浆和细胞膜内表达棕黄色颗粒,阳性神经细胞胞体大,可见较长突起,着色深浅不一。与空白组比较,模型大鼠海马CA1、CA3及DG区Caspase-3的蛋白表达均明显升高,差异具有统计学意义(P<0.05),其中以CA3及DG区Caspase-3蛋白表达的升高趋势更为明显(P<0.01);黄芪注射液干预后,黄芪注射液组与模型组相比较,CA1及CA3区的Caspase-3蛋白表达明显下降,差异具有统计学意义(P<0.05),而DG区无差异(P>0.05),但是具有下降趋势。见表 5、图 2。
| 组别 | CA1 | CA3 | DG |
| 正常组 | 0.15±0.03 | 0.13±0.04 | 0.16±0.04 |
| 模型组 | 0.19±0.02# | 0.21±0.05## | 0.24±0.04## |
| 黄芪注射液 | 0.16±0.02* | 0.16±0.02* | 0.19±0.03 |
| 注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05。 | |||
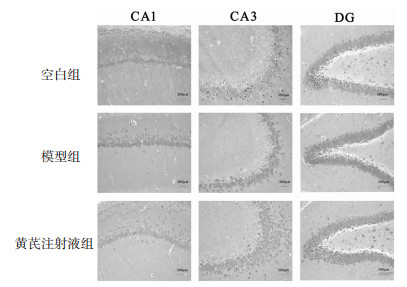
|
| 图 2 各组大鼠海马各区域的Caspase-3阳性细胞表达情况(×200) Fig. 2 Expression of nerve cells of Caspase-3 in each hippocampal area of rats in each group (×200) |
目前的研究证实由STZ诱导的Ⅰ型糖尿病大鼠存在明显的认知功能障碍,海马神经元凋亡被认为是糖尿病出现脑功能异常的主要原因[4]。临床观察发现黄芪注射液的主要有效成分黄芪甲苷可改善糖尿病认知功能障碍,本实验进一步证实了其作用机制与抑制海马胆碱能神经元的凋亡有关。
本研究采用经典的腹腔注射STZ诱导Ⅰ型糖尿病大鼠模型,造模后大鼠呈现持续的高血糖、低胰岛素状态,10周后行Morris水迷宫实验,发现糖尿病大鼠存在明显学习与记忆功能障碍。大量研究已经明确人和大鼠的学习、记忆功能与脑组织中的海马结构与功能的正常密切相关[5]。
细胞凋亡的发生主要受凋亡相关基因和酶的调控,这些基因和酶包括起诱导作用的如Caspase家族和Bax及起抑制作用的如Bcl-2等[6],其中Caspase-3为天冬氨酸特异性半胱氨酸蛋白酶家族成员,被认为是凋亡的总开关,活化的Caspase-3作用于一些其他Caspase成员而产生瀑布式级联反应,使凋亡最终得以完成[7]。Bcl-2和Bax是一对正负调节凋亡的基因,Bax基因具有促进细胞凋亡的作用,Bcl-2基因则能阻遏损伤引起的细胞凋亡。Bcl-2蛋白和Bax蛋白通常形成异源二聚体,导致Bcl-2蛋白失活,降低Bcl-2蛋白对凋亡的抑制作用,从而促进凋亡的发生[8]。因此,Bcl-2和Bax两者表达的相对水平是影响细胞凋亡的重要因素。
AchE的经典功能是水解神经递质乙酰胆碱,从而终止神经冲动。此外,AchE还存在与水解乙酰胆碱无关的非经典功能,如参与神经元的凋亡。研究显示[9]AchE的活性与神经元凋亡呈明显的正相关,而AchE反义核酸则可以部分抑制细胞神经元凋亡,提示AchE参与神经元凋亡的发生。研究发现AchE的促凋亡效应可能与激活Caspase家族有关[10],其深入机制尚待进一步研究,而下调AchE活性为抗凋亡提供了新思路。
黄芪具有益气养元、扶正祛邪等作用,现代临床常将黄芪做成黄芪注射液用于治疗糖尿病[11]、脑血管[12]等疾病。万明等[13]研究显示黄芪可以通过影响阿尔茨海默病大鼠海马组织中的胆碱酯酶含量而改善其学习记忆能力。近来越来越多的研究证实[14-17]黄芪注射液通过抑制缺氧缺糖/复氧复糖诱导的大鼠海马神经元凋亡,从而抗神经元的损伤。本实验通过干预STZ诱导的Ⅰ型糖尿病大鼠发现,黄芪注射液可有效增加其穿越平台位置的次数及在目标象限的平均时间百分比,降低其血清和海马组织中AchE的活力,升高抗凋亡基因Bcl-2水平而降低促凋亡基因Bax水平,且能显著减少糖尿病大鼠海马区Caspase-3蛋白的表达。因而从本实验结果可以证实,黄芪注射液能够改善糖尿病大鼠的学习记忆功能,其作用机制可能与抑制海马区神经细胞的凋亡有关,而下调Bax及Caspase-3水平、抑制AchE活性、上调Bcl-2水平可能是黄芪注射液抗凋亡的潜在机制,为黄芪注射液临床防治糖尿病脑病提供了实验依据。
| [1] | Cukierman T, Gerstein HC, Williamson JD, et al. Cognitive decline and dementia in diabetes-systematic overview of prospective observational studies[J]. Diabetologia, 2005, 48 (12): 2460–2469. DOI:10.1007/s00125-005-0023-4 |
| [2] | Rawal N, Corti O, Sacchetti P, et al. Parkin protects dopaminergic neurons from excessive Wnt/β-catenin signaling[J]. Biochem Biophys Res Commun, 2009, 23, 388 (3): 473–478. |
| [3] | Caricasole A, Copani A, Caraci F, et al. Induction of Dickkopf-1, a negative modulator of the wnt pathway, is Associated with neuronal degeneration in alzheimer's brain[J]. J Neurosci, 2004, 24 (26): 6021–6027. DOI:10.1523/JNEUROSCI.1381-04.2004 |
| [4] | Sadeghi A, Hami J, Razavi S, et al. The effect of diabetes mellitus on apoptosis in hippocampus:cellular and molecular aspects[J]. Int J Prev Med, 2016, 7 : 57. DOI:10.4103/2008-7802.178531 |
| [5] | 罗焕敏. 海马结构——从形态、功能到可塑性、衰老性变化[J]. 神经解剖学杂志, 1996, 12 (2): 177–184. |
| [6] | Zhan Y, van de Water B, Wang Y, et al. The roles of caspase-3 and bcl-2 in chemically-induced apoptosis but not necrosis of renal epithelial cells[J]. Oncogene, 1999, 11, 18 (47): 6505–6512. |
| [7] | Venero JL, Burguillos MA, Joseph B, et al. Caspases Playing in the Field of Neuroinflammation:Old and New Players[J]. Dev Neurosci, 2013, 35 (2-3): 88–101. DOI:10.1159/000346155 |
| [8] | Dorszewska J. Cell biology of normal brain aging:synaptic plasticity-cell death[J]. Aging Clin Exp Res, 2013, 25 (1): 25–34. DOI:10.1007/s40520-013-0004-2 |
| [9] | 杨磊. 乙酰胆碱酯酶与细胞凋亡的相关性的研究[D]. 上海: 中国科学院研究生院(上海生命科学研究院), 2003. http://cdmd.cnki.com.cn/article/cdmd-80100-2004042060.htm |
| [10] | 胡涛, 刘希伟. 脑缺血对免疫系统乙酰胆碱酯酶及Caspase-3表达的影响[J]. 中国免疫学杂志, 2008, 24 (5): 425–429. |
| [11] | 王晓华, 何杏容, 华红艳, 等. 丹参联合黄芪对糖尿病肾病大鼠肾脏线粒体呼吸及能量代谢的影响[J]. 临床与病理杂志, 2015, 35 (2): 243–247. |
| [12] | 赵胜利, 高建玲, 翟丽娜. 丹参及黄芪注射液对心脑血管病患者血液流变学的影响[J]. 实用中医药杂志, 2002, 18 (6): 5. |
| [13] | 万朋, 王师, 郎茂林, 等. 黄芪对阿尔茨海默病模型大鼠学习记忆能力的影响[J]. 吉林医药学院学报, 2011, 32 (2): 69–73. |
| [14] | 张雅丽, 高维娟, 闫凤霞, 等. 黄芪注射液抑制缺氧缺糖后复氧复糖大鼠海马神经细胞凋亡的研究[J]. 中国老年学杂志, 2009, 29 (7): 793–796. |
| [15] | 闫凤霞, 高维娟, 钱涛, 等. 黄芪注射液对缺氧缺糖/复氧复糖大鼠海马神经元caspase-3表达的作用[J]. 中国药理学通报, 2011, 27 (1): 85–90. |
| [16] | 焦俊霞, 高维娟, 钱涛, 等. 黄芪注射液对缺氧缺糖/复氧复糖大鼠海马神经元bcl-2、bax及cyt-c蛋白形态学表达的影响[J]. 中国老年学杂志, 2011, 31 (3): 445–448. |
| [17] | 闫凤霞, 高维娟, 钱涛, 等. 黄芪注射液抑制缺氧缺糖/复氧复糖大鼠海马神经元凋亡的自由基机制[J]. 中国老年学杂志, 2011, 31 (8): 1347–1351. |
2. Ganzhou People's Hospital, Ganzhou 341000, China
 2017, Vol. 34
2017, Vol. 34