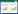文章信息
- 王欢, 王庆甫, 唐学章, 丁海涛, 张美丽, 张栋, 郭玉茹, 刘思婷, 樊小燕, 许晶, 王伟利, 丁昊彬
- WANG Huan, WANG Qing-fu, TANG Xue-zhang, DING Hai-tao, ZHANG Mei-li, ZHANG Dong, GUO Yu-ru, LIU Si-ting, FAN Xiao-yan, XU Jing, WANG Wei-li, DING Hao-bin
- 白芍总苷对滑膜成纤维细胞增殖、凋亡及周期影响的实验研究
- Experimental research on the influence of total glucosides of paeonia on the proliferation, apoptosis and cell cycle of fibroblast-like synovial cells
- 天津中医药, 2017, 34(12): 841-844
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(12): 841-844
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.12.14
-
文章历史
- 收稿日期: 2017-05-21
2. 北京中医药大学第三附属医院, 北京 100029;
3. 北京中医药大学, 北京 100029
骨关节炎(OA)是严重危害全球公众健康的三大疾病之一,以软骨降解和滑膜炎症为基本的病理变化。最新的研究显示,滑膜炎症是导致软骨降解、关节退变和加速OA病情进展的重要环节[1]。组织学研究表明,滑膜炎症的主要表现为异常增生的滑膜组织和滑膜细胞的间充质水肿及炎性浸润。随着病程进展,滑膜衬里层细胞可由正常组织的一至两层增加至十几甚至二十层。可见滑膜成纤维细胞(FLS)增殖的异常,是最突出的病理学特征,对其生长的有效控制手段是调控滑膜炎症的关键。白芍作为临床常用的传统中草药,是通络止痛外治方的君药之一,入肝经,具有养血柔肝、缓急止痛等功效。白芍总苷(TGP)是白芍的主要有效成分,有抗炎、止痛等作用,可用于OA的治疗[2]。而TGP是否可以通过调节FLS的异常增殖,进而对滑膜炎症起到一定的抑制作用是治疗OA的新思路。本研究利用噻唑兰(MTT)比色法和流式细胞术(FCM)等实验技术,对TGP调控FLS增殖、凋亡和周期情况进行检测,剖析TGP影响FLS生长和滑膜炎症的内在联系,为OA的治疗开辟新的途径。
1 材料 1.1 试剂白芍总苷(纯度≥98%)(泽朗医药科技有限公司,中国南京);DMEM标准培养基、特级胎牛血清(FBS)、0.25%蛋白质水解酶(Gibco,美国);胶原蛋白酶Ⅱ、脂多糖、噻唑兰、多聚甲醛、PI/RNase染色液(Sigma,美国);Annexin V-FITC/PI Apoptosis Detection Kit(BD,美国)。
1.2 仪器酶联免疫反应检测仪(ELX800,BioTek);流式细胞仪(FACSCantoTMⅡ,BD);冷冻高速离心机(5804R,Eppendorf);漩涡混匀器(Vortex5,齐林贝尔);移液枪(KE0003087/KA0056573,Dragon)。
1.3 组织来源及细胞分离望京医院骨伤科收入的患者在行全膝人工关节置换手术的过程中,将从膝关节剔除的废弃滑膜组织用无菌止血钳移入预冷的培养液中,采用胶原酶法对其进行分离和培养。传代后,取生长状态良好的FLS用于实验。
2 方法 2.1 MTT比色法对TGP对FLS增殖的检测之前的研究中,笔者对TGP对细胞活力的影响做了多时间和浓度的筛选[3]。本研究从中选取以250 μg/mL初始浓度,依次4倍稀释成62.5、15.63、3.91和0.98 μg/mL,共5个浓度的TGP稀释液,对在96孔培养板中接种的细胞进行时长为48 h的干预后,加入MTT进行细胞增殖活性的检测。在酶联免疫反应检测仪490 nm波长下用A表示各孔的吸光值。细胞生长抑制率(IR)和存活分数(SF)被用作反映在各浓度梯度TGP干预下细胞的增殖活性,分别用公式IR(%)=(A对照-A药液)/A对照×100和SF(%)= A药液/A对照×100计算。将各组计算所得结果输入SPSS 17.0统计学软件分析,选择合适的干预浓度用于后续实验。
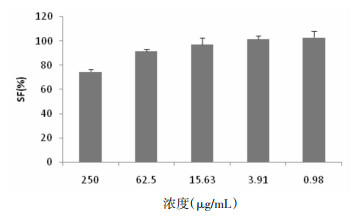
2.2 流式细胞术受试FLS的制备将用于实验的FLS经脂多糖激动24 h后分为3组:TGP高浓度组(1 μg/mL脂多糖+50 μg/mL TGP);TGP低浓度组(1 μg/mL脂多糖+5 μg/mL TGP);对照组(1 μg/mL脂多糖),另设空白组,用常规培养基培育而不做激活。
2.3 FLS凋亡的检测收集各组细胞清洗后用Annexin V-FITC/PI Apoptosis Detection Kit中提供的Binding Buffer重新悬浮。同时加入PI和FITC-Annexin V,漩涡混匀器多次、短时震荡,待死细胞和PS染色充分时上机检测即可(约15 min)。
2.4 FLS周期的检测收集各组细胞清洗后用多聚甲醛对其进行固定后,以冰乙醇为冷冻介质对其进行保存,上样前洗涤干净即可。按试剂说明书根据细胞数量加入适量PI/RNase染色液,漩涡混匀器多次、短时震荡,待DNA染色充分及RNA消化完全时上机检测即可(约15 min)。
2.5 数据处理及统计分析回归分析用于TGP浓度的计算,流式细胞仪对FLS周期和凋亡的检测数据分别采用ModFit LT V3.3.11和FACSDiva Version 6.1.3软件进行处理。实验数据用SPSS 17.0软件进行分析,数据以均数±标准差(x±s)形式表示,多组间比较采用单因素方差分析,以P<0.05为有统计学差异。
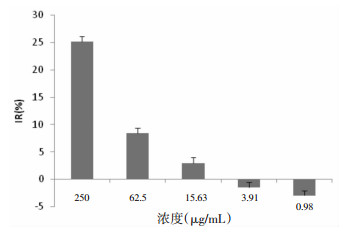
3 结果 3.1 TGP对细胞增殖活性的影响随着TGP浓度的减低,对FLS生长的抑制作用也见逐渐减弱,当TGP浓度较低时,将不再抑制FLS的生长,反而对其有一定的促进作用。相应地,存活分数则随着浓度减低而上升。经统计软件分析,当TGP的浓度在6.89 μg/mL时,对FLS的抑制率接近0。TGP对FLS的抑制率及存活分数均呈显著的浓度依赖性。见图 1、2。
|
| 图 1 不同浓度的TGP对FLS抑制率的影响 Fig. 1 Influence of different concentration of TGP for the IR of FLS |
|
| 图 2 不同浓度的TGP对FLS存活分数的影响 Fig. 2 Influence of different concentration of TGP for the SF of FLS |
将Annexin V-FITC /PI荧光双标记参数图(见图 3)结合统计分析结果可见,各浓度的TGP对Q2区显示的FLS晚期凋亡的诱导性比较显著(P<0.05),与对照组相比,TGP高浓度组通过增加FLS的总凋亡率来控制其浸润性增长(P<0.05),而TGP低浓度组对FLS诱导凋亡的作用则不甚明显(P>0.05)。与之前对CA的研究相比,TGP对FLS凋亡的诱导性相对较弱,TGP基本无CA对早期凋亡的显著诱导作用,而更集中在对晚期凋亡和细胞坏死的诱导。相似的是,绝大多数位于Q3区的细胞说明了适宜浓度的TGP基本无细胞毒性,这也是这种中药活性成分临床应用的优势之一。见表 1。
|
| 图 3 TGP对FLS凋亡的影响 Fig. 3 Influence of TGP for the apoptosis of FLS |
| % | |||
| 组别 | 早期调亡率 | 晚期调亡率 | 总调亡率 |
| 空白组 | 5.6±0.78 | 3.0±0.66 | 8.6±1.44 |
| 对照组 | 3.9±1.54 | 1.7±0.94 | 5.6±2.48 |
| TGP高浓度组 | 6.0±2.91 | 7.9±2.86* | 13.9±5.77* |
| TGP低浓度组 | 5.8±1.47 | 5.5±2.02* | 11.3 ±3.49 |
| 注:与对照组比较,*P<0.05。 | |||
结合细胞周期分布图(见图 4)和统计分析所得的数据可见,对照组的脂多糖主要是通过增加细胞分裂的S期而对FLS的活性起到诱导作用的(P<0.05)。在G2期,在各浓度TGP的作用下显著增加了在这个有丝分裂准备期的FLS比例(P<0.05);而在S期,TGP则对DNA的复制都起到了明显的阻滞作用(P<0.05)。由此,对OA增殖的FLS起到一定的抑制作用。见表 2。
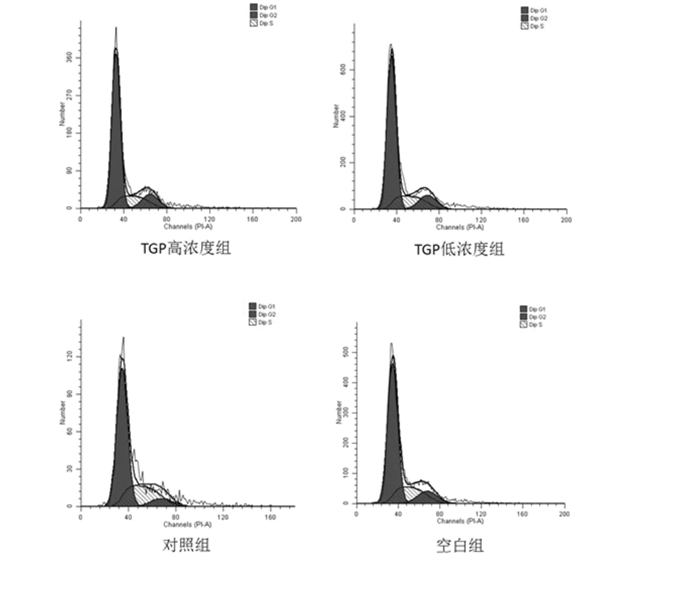
|
| 图 4 TGP对FLS周期的影响 Fig. 4 Influence of TGP for the cell cycle of FLS |
| % | |||
| 组别 | G1 | G2 | S |
| 空白组 | 66.44±6.29 | 11.10±3.74 | 22.46±2.19 |
| 对照组 | 64.31±4.58 | 7.32±1.27 | 28.37±2.44*# |
| TGP高浓度组 | 69.65±6.63 | 12.05±2.05* | 18.03±3.17* |
| TGP低浓度组 | 68.77±4.51 | 11.91±1.37* | 19.31±4.06* |
| 注:与对照组比较,*P<0.05,与空白组比较,#P<0.05。 | |||
目前,临床上对于OA仍没有一种有效的治疗方法。以关节置换术为主的手术治疗模式的推广,使OA的控制率有了显著的提高,是一种临床上常用的公认有效的治疗方法也是重度OA患者的最佳选择。但手术本身带给患者身心的不适、手术相关的并发症和后续假体使用中的问题等均是需要从事医疗行业的工作者和研究人员应该考虑的因素[4-6]。常用的镇痛剂、类固醇、非甾体类抗炎类药物对疼痛的缓解和关节功能的恢复均针对性不强、疗效欠佳且不良反应明显。
在之前的研究中,课题组把握肝血不足、筋脉失养为OA发病的关键,用中医学理论结合“肝藏血主筋”的生理特点从肝论治OA,开展了用通络止痛外治法治疗OA的相关临床和基础研究[7-8]。通络止痛外治法方剂的主要君药组成白芍,性凉,味苦酸,微寒,具有养血柔肝、缓急止痛敛阴收汗等功效[9]。白芍总苷(TGP)是从毫白芍干燥根中提取的主要活性成分,是一种具有双向免疫调节作用的治疗OA具有确切疗效的传统中药。现代的药理学研究证明,TGP在抑制自身免疫反应、抗炎、止痛等方面均发挥着重要作用[10],这些都是临床应用其治疗OA的基础。
在之前的研究中,已经证明了TGP和通络止痛外治方中的另一味具有温阳通络功效的君药桂枝的主要活性成分桂皮醛(CA)对炎性介质NO和TNF-α释放的抑制作用[11]。接下来在中药有效成分对OA滑膜炎症的作用机制的一系列研究中发现,CA能通过诱导FLS早衰来抑制FLS的增生[12]。
而对于TGP对OA滑膜炎性反应调节的详细药理作用机制仍不十分明确。所以,在本研究中,以FLS为作用对象,探讨TGP对其生长的调控机制。结果显示,TGP对FLS活力的调控呈显著的浓度依赖性,主要通过诱导FLS晚期凋亡和延长有丝分裂的准备期G2同时阻滞分裂期S来抑制OA滑膜炎症中FLS的过度增殖。这个研究结果也为中药活性成分在滑膜炎症中的调控机制和疗效肯定奠定了基础。
| [1] | Jan B, Blom AB, Shane W, et al. The role of synovial macrophages and macrophage-produced mediators in driving inflammatory and destructive responses in osteoarthritis[J]. Arthritis Rheum, 2010, 62 (3): 647–657. DOI:10.1002/art.27290 |
| [2] | 杜旭召, 杨豪, 邓素玲, 等. 白芍总苷对骨关节炎软骨细胞增殖及分泌表达的影响[J]. 中国骨质疏松杂志, 2016, 22 (11): 1375–1379+1385. DOI:10.3969/j.issn.1006-7108.2016.11.003 |
| [3] | 王欢, 王庆甫, 杨黎黎, 等. 白芍总苷对人膝骨关节炎滑膜成纤维细胞增殖的影响[J]. 中华中医药杂志, 2016, 31 (11): 4853–4856. |
| [4] | Mchugh GA, Campbell M, and Luker KA. GP referral of patients with osteoarthritis consideration of a total joint replacement:a longitudinal study[J]. Advanced Materials, 2015, 27 (21): 3273–3277. |
| [5] | Villadsen A. Neuromuscular exercise prior to joint arthroplasty in patients with osteoarthritis of the hip or knee[J]. Danish Medical Journal, 2016, 63 (4). |
| [6] | Mercuri LG. Temporomandibular joint replacement periprosthetic joint infections:a review of early diagnostic testing options[J]. International Journal of Oral & Maxillofacial Surgery, 2014, 43 (10): 1236–1242. |
| [7] | 王庆甫, 马玉峰, 殷岳衫, 等. 低频超声促透中药对兔膝关节炎细胞因子的影响[J]. 北京中医药大学学报, 2013, 55 (2): 108–112, 146. |
| [8] | 王庆甫, 祁印泽, 陈兆军, 等. 超声电导透射通络止痛中药外治膝骨性关节炎的临床观察[J]. 北京中医药大学学报, 2010, 52 (4): 283–285. |
| [9] | 彭润兰. 白芍临床应用一揽[J]. 中国中医药现代远程教育, 2012, 10 (21): 132–133. |
| [10] | Burt ES. Hallucinatory History:Hugo's Révolution[J]. Frontiers in Pharmacology, 2011, 2 (2): 10. |
| [11] | 王欢, 王庆甫, 杨黎黎, 等. 基于体外细胞模型的建立探讨通络止痛方对滑膜炎症反应的影响[J]. 长春中医药大学学报, 2016, 32 (4): 684–687. |
| [12] | 王欢, 王庆甫, 杨黎黎, 等. 桂皮醛对滑膜成纤维细胞增殖、凋亡及周期影响的实验研究[J]. 天津中医药, 2017, 34 (1): 54–58. DOI:10.11656/j.issn.1673-9043.2017.01.13 |
2. The Third Affiliated Hospital of Beijing University of Chinese Medicine, Beijing 100029, China;
3. Beijing University of Chinese Medicine, Beijing 100029, China
 2017, Vol. 34
2017, Vol. 34