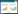文章信息
- 张欣张欣, 贾英杰贾英杰, 杨佩颖杨佩颖, 张蕴超张蕴超
- ZHANG Xin, JIA Ying-jie, YANG Pei-ying, ZHANG Yun-chao
- 消岩汤含药血清介导下Survivin siRNA对人肺腺癌A549细胞增殖及凋亡的影响
- Effect of Survivin siRNA on human lung adenocarcinoma A549 cell proliferation and apoptosis mediated by drug-containing serum of Xiaoyan decoction
- 天津中医药, 2017, 34(2): 113-116
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(2): 113-116
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.02.12
-
文章历史
- 收稿日期: 2016-10-09
2. 天津中医药大学第一附属医院肿瘤科, 天津 300193
肺癌是当今世界上发生率和病死率最高的恶性肿瘤之一,且呈上升趋势[1]。另有国外资料显示肺癌的病理学类型发生了明显变化,肺腺癌发病率迅速增加,目前已取代肺鳞癌的发生率,成为最常见的肺癌病理类型[2]。与其他恶性肿瘤一样,非小细胞肺癌的侵袭、转移是多基因参与、多步骤发生的过程,与一系列的基因表达失衡相关[3]。探讨临床应用最为广泛的中药复方的抗肿瘤机制,是目前研究的热点之一。Survivin是新近发现的凋亡抑制蛋白[4],它选择性地表达于恶性肿瘤组织中。RNA干扰是一种新的基因阻断技术[5],有类似于基因敲除的效果。靶向Survivin的RNA干扰可以阻断Survivin表达,显著抑制肿瘤细胞的生长[6]。本研究应用RNA干扰技术,设计靶向Survivin基因的小干扰RNA(siRNA)干扰序列转染人源肺腺癌A549细胞,旨在探索、明确中药复方消岩汤药液可能的抑瘤机制。
1 研究材料 1.1 消岩汤及消岩汤含药血清的制备消岩汤是天津中医药大学第一附属医院院内制剂,制剂号40019,由黄芪、太子参、夏枯草、姜黄、郁金、白花蛇舌草组成。严格按照院内制剂标准进行制备。取健康BalB/C小鼠,体质量18~22 g,分为2组,每组20只,分为空白对照组和中药组,中药水煎剂的剂量均以生药量计,根据前期急性毒性实验证明,消岩汤的最大给药剂量为304 g/kg,相当于成人临床推荐日用量的130倍,未出现明显毒副作用[7]。前期研究证明[8],消岩汤按40 g/kg(为临床成人日用量的20倍)灌胃给药对顺铂诱导的A549/DDP耐药细胞的凋亡具有显著增强作用。故本研究以消岩汤复方提取物按40 g/kg(为临床成人日用量的20倍)灌胃给药,空白对照组为0.4 mL生理盐水灌胃。每次灌胃间隔24 h,连续14 d。给药14 d后,末次灌胃禁食水、12 h后,眼眶取血法采血,无菌分离血清,经56 ℃,30 min灭活处理后,用0.22 μm微孔滤膜过滤除菌,置-20 ℃保存备用药物血清。
1.2 细胞人源肺腺癌A549细胞株购自中国医学科学院上海生物化学与细胞生物学研究所细胞库。
1.3 主要试剂RPMI1640细胞培养液、胰蛋白酶、小牛血清购自Hyclone公司,lipofectamine 2000转染试剂购自Promega公司,siRNA片段由上海生工生物工程股份有限公司合成提供。
1.4 主要仪器细胞培养箱、无菌操作台(HB 2448K)、恒温水浴锅、低温离心机(SK18)、流式细胞仪、全自动酶标仪、倒置显微镜等。
2 研究方法 2.1 A549细胞的常规培养及分组人源肺腺癌A549细胞使用含10%小牛血清的RPMI1640细胞培养液,在37 ℃,5%CO2的细胞培养箱中培养,胰蛋白酶溶液消化,按照1:4传代,实验采用对数生长期的细胞。A549细胞接种于6孔培养板,分组如下。
设置空白对照组、转染对照组、非转染中药组(使用含消岩汤含药血清的1640完全培养液处理细胞)、转染中药组(转染靶向Survivin基因的重组质粒,联合使用含消岩汤含药血清的1640完全培养液处理细胞)。转染对照组及转染中药组接种第一部分实验转染后48 h细胞,非转染中药组接种常规培养的A549细胞,每组设置3个复孔。
2.2 siRNA转染A549细胞在Invitrogen公司的网上设计系统中设计的靶向Survivin基因的siRNA序列:sense:CTGAGAACGAGCCAGACTT,antisense:AAGTCTGGCTCGTTCTCAG。按照说明书稀释退火形成双链dsRNA,所涉及序列经BLAST查询,排除其他基因同源性[9]。
把对数生长期的A549细胞接种于6孔板中,待细胞贴壁生长至融合80%左右时,磷酸盐缓冲溶液(PBS)清洗1次,更换无血清培养基,按照lipofectamine 2000转染试剂说明书进行转染。转染后放入细胞培养箱中计时。转染24、48 h后观察各组细胞生长状态。
2.3 噻唑蓝(MTT)法检测消岩汤对A549细胞的生长抑制率空白对照组加入不含中药的完全培养液100 μL,转染对照组加入终浓度为100 nmol/L的siRNA转染24 h,非转染中药组加入消岩汤含药血清刺激24 h,转染中药组加入终浓度为100 nmol/L的siRNA转染24 h后,加入消岩汤含药血清刺激24 h。首先检测非转染中药组经1640完全培养液处理A549细胞0、12、24、36、48 h,对A549细胞的生长抑制率,观察药液对A549生长抑制作用于时间的关系。继而于24、48 h后观察各组A549细胞的生长状态。48 h后,弃掉每孔的培养液,并用PBS清洗细胞3次,每孔加入100 μL 1640培养液+20 μL MTT溶液,继续培养。4 h后弃掉全部培养液,每孔避光加入100 μL二甲基亚砜(DMSO),使结晶物充分溶解,使用酶联免疫检测仪检测各孔在OD 490 nm处的吸光值。各不同处理组作用于A549细胞后抑制率的计算:抑制率=1-加药组OD值/对照组OD值,每样本做3个重复孔,结果取各组均值。
2.4 免疫组化法观察A549细胞Survivin蛋白的表达情况采用细胞盖玻片爬片法,Survivin蛋白检测采用SABC法,按试剂盒说明书操作,一抗为兔抗人Survivin单克隆抗体,工作浓度为1:100。免疫组化结果判定以阳性细胞百分率及着色强度综合计分进行半定量分析,并以HPIAS21000彩色病理图文报告系统测定IOD值进行蛋白表达强度定量分析。
2.5 流式细胞术检测消岩汤及转染重组质粒后A549细胞的凋亡情况各组细胞常规培养24 h后,转染对照组更换含血清及双抗的常规1640培养液,转染中药组及非转染中药组更换含消岩汤含药血清的完全培养液,处理细胞48 h后,使用不含乙二胺四乙酸(EDTA)的胰蛋白酶溶液消化各组细胞,加入冰PBS洗涤细胞2次,制备溶于PBS的细胞悬液。采用Annexin V-FITC/PI双染细胞凋亡检测方法,上流式细胞仪检测,测定各组细胞凋亡情况。
2.6 数据分析数据均采用SPSS 18.0软件对实验数据进行统计处理,之间差异运用单因素方差分析进行分析,P < 0.05为差异具有统计学意义。
3 研究结果 3.1 A549细胞转染48 h后状态A549细胞转染48 h后,生长状态符合实验要求。见图 1。

|
| 图 1 细胞转染48 h后生长状态(200×) Fig. 1 Growth state of cell transfection after 48 hours (200×) |
结果可见,将非转染中药组用含消岩汤含药血清的1640完全培养液处理A549细胞0、12、24、36、48 h,检测不同时间内药液对A549细胞的生长抑制率,结果显示,12 h内对A549细胞生长抑制作用不明显,在24、36、48 h时,细胞生长情况较空白对照组受到明显抑制,差异有统计学意义(P<0.05)。见表 1。
| 处理时间(h) | n | A值 | 抑制率(%) |
| 0 | 3 | 0.695±0.021 | 0 |
| 12 | 3 | 0.662±0.037 | 4.6* |
| 24 | 3 | 0.632±0.019 | 12.5* |
| 36 | 3 | 0.543±0.014 | 23.9* |
| 48 | 3 | 0.346±0.006 | 50.0* |
| 注:与空白对照组(药物浓度为0)比较,*P<0.05。 | |||
作用24 h各组细胞的药物毒性不明显,作用48 h后各组细胞的药物毒性作用比较明显。转染对照组与非转染中药组两者的抑制率无明显差异,但转染中药组的抑制率显著高于转染对照组及非转染中药组。见表 2。
| 组别 | n | OD值均值 | 抑制率(%) |
| 空白对照组 | 3 | 0.695±0.185 | 0 |
| 转染对照组 | 3 | 0.226±0.087 | 67.50±10.83* |
| 非转染中药组 | 3 | 0.212±0.025 | 69.50±12.35* |
| 转染中药组 | 3 | 0.074±0.008 | 89.40±15.82 |
| 注:与转染中药组比较,*P<0.05。 | |||
结果可见转染对照组对Survivin蛋白表达的抑制率明显高于非转染中药组,但显著低于转染中药组。见表 3。
| 组别 | n | IOD值均值 | 蛋白表达抑制率(%) |
| 空白对照组 | 3 | 0.389±0.089 | 0 |
| 转染对照组 | 3 | 0.142±0.034 | 63.51±12.85 |
| 非转染中药组 | 3 | 0.217±0.015 | 44.22±12.35* |
| 转染中药组 | 3 | 0.101±0.007 | 74.10±20.15* |
| 注:与转染对照组比较,*P<0.05。 | |||
采用Annexin V-FITC/PI双染法检测A549细胞凋亡情况结果显示,消岩汤含药血清及重组质粒以诱导细胞晚期凋亡为主,各组早期凋亡率差异无统计学意义,转染中药组细胞凋亡率与转染对照组A549细胞凋亡率、非转染中药组细胞凋亡率比较,差异有统计学意义(P<0.05)。见表 4。
| % | ||||
| 组别 | n | 早期凋亡率 | 晚期凋亡率 | 细胞凋亡率 |
| 转染对照组 | 3 | 0.020±0.007 | 0.059±0.014 | 0.095±0.021 |
| 非转染中药组 | 3 | 0.024±0.010 | 0.368±0.047 | 0.398±0.041* |
| 转染中药组 | 3 | 0.020±0.010 | 0.544±0.073 | 0.567±0.065# |
| 注:与转染对照组比较,*P<0.05;与转染对照组、非转染中药组比较,#P<0.05。 | ||||
结果表明,消岩汤含药血清及重组质粒以诱导细胞晚期凋亡为主,各组早期凋亡率差异无统计学意义,转染中药组A549细胞凋亡率高于转染对照组以及非转染中药组,非转染中药组细胞凋亡率高于转染对照组,提示消岩汤可诱导A549细胞的凋亡,联合应用转染靶向Survivin基因的重组质粒可增强其体外诱导A549细胞的凋亡作用。
4 讨论近年来,肺腺癌发病率迅速增加,已成为最常见的肺癌病理类型,严重威胁人类健康,尽管采用了手术、放疗和化疗等综合治疗措施,但由于转移和多药耐药等原因,非小细胞肺癌5 a生存率仍低于10%。肺癌发生发展过程中存在细胞增殖和凋亡的失衡,新兴的肿瘤分子靶向治疗意在针对肿瘤内特异的分子治疗靶点,利用一定的分子技术阻断分子的生物学功能,进而从分子水平逆转肿瘤细胞的恶性生物学行为,达到抑制肿瘤生长的目的。RNA干扰技术是基因沉默的有力手段,宿主通过RNA干扰抑制病毒等外源核苷酸的表达,从而维护自身基因组的稳定性,通过人工导入一段与目的基因同源的双链RNA序列使其mRNA降解,表达缺失,实现基因敲除[10]。Survivin是近年新发现的凋亡抑制蛋白(IAP)家族成员,是该家族中迄今为止发现的分子量最小、抗凋亡作用最强者,它选择性地表达于恶性肿瘤组织中,这种特点使其成为目前恶性肿瘤诊断和治疗的新靶点[11]。本课题根据对肿瘤治疗的临床经验总结并结合现代医学理论概况中肿瘤发病病机,正气内虚,邪留毒聚,瘀毒并存,久病入络,并且将这一病机贯穿肿瘤的发生发展,直至死亡的整个过程,从而提出“扶正、解毒、祛瘀”的肿瘤治疗原则,在此基础上拟定消岩汤。其中,黄芪、太子参滋阴益气,扶正抗肿瘤;夏枯草、白花蛇舌草清热解毒,软坚散结;姜黄、郁金行气散结,活血解瘀。全方祛邪而不伤正,全面调节身体内环境的平衡[12-13]。
大量前期研究成功地证实了以扶正解毒祛瘀法为治疗原则的中药具有良好的抗肺癌新生血管作用,能够提高化疗的非小细胞肺癌(NSCLC)患者的近期疗效,改善生活质量[14-15]。在肺癌组织中,Survivin蛋白的过度表达与肿瘤的发生、发展,以及放化疗耐药等关系极为密切[16]。本课题以RNA干扰技术为切入点,从基因角度探讨以扶正解毒祛瘀法为治疗原则的中药复方消岩汤的抗肿瘤作用靶点及作用机制,结果显示消岩汤能使肺腺癌A549细胞中Survivin的mRNA和蛋白表达量减少,并可协同Survivin siRNA使肺癌细胞凋亡率增加,为扶正解毒祛瘀法在临床抗肿瘤治疗中提供有力的理论依据。
| [1] | Jemal A, Siegel R, Ward E, et al. Cancer Statistics[J]. CA Cancer J Clin, 2009, 59 (4): 225–249. DOI:10.3322/caac.20006 |
| [2] | Deonarain MP, Kousparou CA, Epenetos AA. Antibodies targeting cancer stem cells:a new paradigm in immunotherapy?[J]. MAbs, 2009, 1 (1): 12–25. DOI:10.4161/mabs.1.1.7347 |
| [3] | 张志平, 姜冠潮, 杨帆, 等. 靶向突变K-ras基因的小干扰RNA体内外抑制肺癌细胞生长的研究[J]. 中华外科杂志, 2007, 45 (18): 1267–1270. |
| [4] | Kanwar JR, Kamalapuam SK, Kanwar RK, et al. Survivin signaling in clinical oncology:A multifaceted dragon[J]. Med Res Rev, 2013, 33 (4): 765–789. DOI:10.1002/med.2013.33.issue-4 |
| [5] | 徐俊, 毛颖, 苗荻, 等. RNA干扰技术的研究进展[J]. 医药生物技术, 2012 (3): 15–17. |
| [6] | Pennati M, Millo E, Gandellini P, et al. RNA interference-mediated validation of survivin and apollon/BRUCE as new therapeutic targets for cancer therapy[J]. Curr Top Med Chem, 2012, 12 (2): 69–78. DOI:10.2174/156802612798919169 |
| [7] | 杨佩颖, 贾英杰, 陈军, 等. 消岩汤不同时段给药联合化疗对气虚毒瘀证非小细胞肺癌免疫功能影响的临床研究[J]. 新中医, 2011, 43 (4): 64–66. |
| [8] | 张莹, 贾英杰, 杨洁, 等. 消岩汤药物血清对A549/DDP细胞凋亡的诱导作用[J]. 中医研究, 2011, 24 (5): 19–22. |
| [9] | 王霞莉, 赵岐刚, 司磊. Survivin基因靶向RNAi慢病毒载体的构建及意义[J]. 山东医药, 2008, 48 (20): 5–25. |
| [10] | Valentino JD, Elliott VA, Zaytseva YY, et al. Novel small interfering RNA cotargeting strategy as treatment for colorectal cancer[J]. Surgery, 2012 Aug; 152(2):277-285. |
| [11] | Tanaka T, Delong PA, Amin K, et al. Treatment of lung cancer using clinically relevant oral doses of the cyclooxygenase-2 inhibitor rofecoxib:potential value as adjuvant therapy after surgery[J]. Ann Surg, 2005, 241 (1): 168–178. |
| [12] | 彭卫卫, 贾英杰. NP方案联合解毒祛瘀法治疗中晚期非小细胞肺癌的临床观察[J]. 辽宁中医杂志, 2010, 37 (7): 1303–1304. |
| [13] | 贾英杰, 张蕴超, 李小江, 等. 消岩汤联合125I粒子及热疗治疗中晚期肺癌疗效观察[J]. 中医杂志, 2011, 52 (9): 755–760. |
| [14] | 贾英杰. 扶正解毒祛瘀法治疗恶性肿瘤探析[J]. 中医杂志, 2013, 54 (24): 2145–2146. |
| [15] | 李小江, 贾英杰, 于建春, 等. 消岩汤剂拆方配伍对肺腺癌A549细胞survivin和caspase-3表达的影响[J]. 中草药, 2014, 45 (12): 3436–3439. |
| [16] | 赵岐刚, 司磊, 田小侠, 等. Survivin siRNA对人肺腺癌A549细胞增殖影响实验研究[J]. 中国病理生理杂志, 2008, 24 (9): 1699–1703. |
2. First Teaching Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
 2017, Vol. 34
2017, Vol. 34