文章信息
- 赵晨翔赵晨翔, 张雅敏张雅敏, 刘宏胜刘宏胜, 刘子荣刘子荣
- ZHAO Chen-xiang, ZHANG Ya-min, LIU Hong-sheng, LIU Zi-rong
- 山茱萸总苷对小鼠免疫性肝损伤治疗作用的初步研究
- Preliminary study on the effect of total glycosides from Cornus Officinalis on treatment of acute immunologic liver injury induced by ConA in mice
- 天津中医药, 2017, 34(2): 120-124
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(2): 120-124
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.02.14
-
文章历史
- 收稿日期: 2016-11-12
2. 天津市第一中心医院肝胆外科, 天津 300192;
3. 天津市第一中心医院卫生部危重病急救医学重点实验室, 天津 300192;
4. 天津医科大学一中心临床学院, 天津 300192
山茱萸为山茱萸科植物山茱萸(Cornus of ficinalis Sieb.et Zucc.)的干燥成熟果肉,是中国传统名贵中药。《本草纲目》列山茱萸为滋补上品,云:“久服,明目强力长年,治脑骨痛、疗耳鸣、补肾气、添精髓、止老人尿不节。”有较高的药用食用价值。其味酸、涩,性微温,具有补肝肾,涩精气,固虚脱的功效[1]。山茱萸总苷(TGCO)是山茱萸中提取的有效成分。大量研究表明TGCO有抗炎、免疫抑制作用,可以延长抑制小鼠心脏移植的存活时长及降低大鼠对角膜移植的排斥反应[2-7]。TGCO对小鼠的最大耐受量相当于人日用量的250倍[8],提示山茱萸总苷的的毒性很小,安全性较高,便于将来临床应用及进一步药物的开发。本课题组研究TGCO对刀豆蛋白A(ConA)所致急性免疫性肝损伤的治疗作用。
1 材料 1.1 药物和试剂TGCO由卫生部危重病急救医学重点实验室提取。联苯双酯滴丸(批号A213003),浙江医药股份有限公司新昌制药厂;羧甲基纤维素钠、甲醛,烟台市双双化工有限公司;天门冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)、超氧化物歧化酶(SOD)、鸟氨酸氨基甲酰转移酶(OCT)检测试剂盒(赖氏法),丙二醛(MDA)、小鼠白介素-1(IL-1)、小鼠白介素-(IL-6)ELISA试剂盒,南京建成生物工程研究所;肿瘤坏死因子-α(TNF-α)酶联免疫分析试剂盒、小鼠γ干扰素(IFN-γ)酶联免疫分析试剂盒,郑州鼎国生物技术有限公司进口分装;刀豆蛋白A(ConA)Ⅳ型,美国Sigma公司,使用前溶解于磷酸盐缓冲液(PBS)溶液。
1.2 动物C57BL小鼠60只,雄性,SPF级,7~8周龄,体质量18~20 g(由中国医学科学院医学实验动物研究所提供,许可证号:SCXK(京)2014-0004)。实验动物在光照周期12 h/12 h环境中,标准饲料,自由饮水。饲养室温度控制在18~22 ℃, 湿度45%~55%, 每周换垫料4次。适应性饲养3 d后进行实验。
1.3 仪器Model 450自动酶标仪(美国Bio-Rad公司);AE-240型电子天平(梅特勒公司);UV-2550型分光光度仪(日本岛津公司);Motic BA 300显微镜;电热恒温水浴箱(北京医疗设备厂意成公司);RXL全自动生化仪(西门子有限公司);
Anke TGL-16GB型离心机(美国Anke公司),普通光学显微镜(CX21BIM -SET5,日本Olympus公司)。
2 方法 2.1 模型建立与分组C57BL小鼠按随机数字表法随机分为:正常对照组、模型组、联苯双酯组(100 mg/kg)、TGCO低(62.5 mg/kg)、中(125 mg/kg)和高(250 mg/kg)剂量组,将联苯双酯配置成2.5 mg/mL的溶液,每组10只。第1天,正常组小鼠尾静脉注射0.9%的生理盐水0.4 mL,其余各组小鼠均1次性按20 mg/kg体质量尾静脉注射ConA。造模后1 h,各组动物每6 h灌胃给药1次,治疗组分别按照0.04 mL/g灌胃给予山茱萸总苷(62.5、125、250 mg/kg),联苯双酯组按照0.04 mL/g灌胃给予TGCO正常组、模型组以等容量1% CMC-Na混悬液(含20%丙二醇和1% DMSO)灌胃,共给药5次。
2.2 肝脏、脾脏指数末次灌胃给药2 h后,用10%水合氯醛麻醉,摘眼球取血后脱颈处死小鼠,迅速解剖,称取肝脏及脾脏的质量,以小鼠肝质量/体质量(0.1 mg/g)和脾质量/体质量(0.1 mg/g)作为肝脏、脾脏指数。
2.3 肝脏组织学检查在每一组小鼠的肝右叶相同位置,取大小约0.3 cm×0.3 cm×0.3 cm的肝组织,用10%的甲醛溶液固定,苏木精-伊红(HE)染色,在光镜下观察肝组织的病理变化,并按照病理组织学损伤程度进行分级:“-”未见明显病理损伤;“+”肝组织浊肿伴有散在的点状坏死,会管区少量炎性细胞浸润;“++”肝细胞浊肿有点状坏死及小灶状坏死,肝细胞间质少量充血,会管区有大量炎性细胞浸润;“+++”肝细胞浊肿并伴有片状坏死,肝细胞间质大量充血,会管区及周围有大量炎性细胞浸润。
2.4 血清中ALT、AST含量的测定摘眼球取血,常温静置60 min,3 000 r/min离心20 min,分离血清,然后按照ALT、AST检测试剂盒说明进行操作进行含量测定。
2.5 肝组织匀浆中IFN-γ、TNF-α、IL-1、IL-6含量的测定将小鼠肝脏用生理盐水冲洗干净并用滤纸吸干,于各组小鼠左前叶取肝组织精确称量后,置于冰浴中剪碎,匀浆,加适量的生理盐水制成质量分数10%的肝匀浆,离心后,取上清液,按照试剂盒标准操作规程测定肝组织匀浆中SOD、IFN-γ、TNF-α、IL-1、IL-6和OCT的水平。
2.7 统计学分析应用SPSS 18.0统计软件进行统计分析,各组数据结果以均数±标准差(x±s)表示;计量资料多组比较采用方差分析,组间两两比较若方差齐采用LSD法,若方差不齐采用Dunnett’s T3法,等级资料采用Ridit分析,P < 0.05为差异有统计学意义。
3 结果 3.1 TGCO对免疫性肝损伤小鼠脏器指数的影响免疫性肝损伤小鼠用药5次后,山茱萸总苷对免疫性肝损伤小鼠脏器系数的影响见表 1。结果表明,与模型组相比,山茱萸总苷组能抑制肝脏、脾脏的增大,且呈一定的剂量相关性,其中高剂量组抑制肝、脾脏指数增大的效果与联苯双酯组相似。
| 组别 | 动物数 | 剂量(mg/kg) | 肝脏系数(%) | 脾脏系数(%) |
| 正常组 | 10 | - | 4.48±0.13 | 0.42±0.02 |
| 模型组 | 10 | - | 5.19±0.23* | 0.71±0.09* |
| TGCO低剂量组 | 10 | 230 | 5.07±0.22# | 0.66±0.04# |
| TGCO中剂量组 | 10 | 460 | 4.93±0.17# | 0.61±0.03# |
| TGCO高剂量组 | 10 | 920 | 4.81±0.19# | 0.57±0.05# |
| 联苯双酯组 | 10 | 100 | 4.87±0.19# | 0.44±0.03# |
| 注:与正常组比较,*P < 0.01;与模型组比较,#P < 0.01。 | ||||
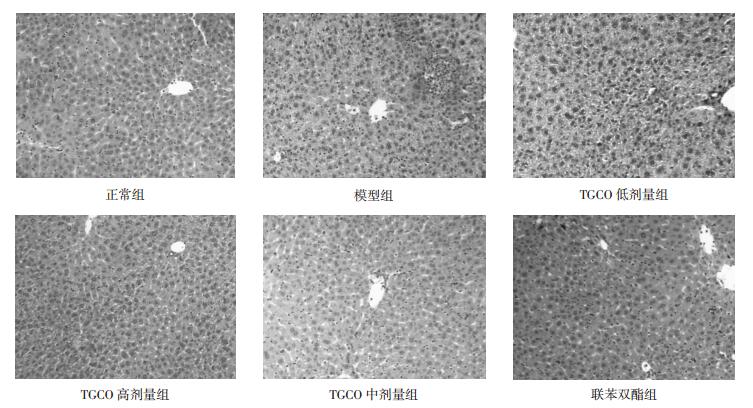
正常组小鼠肝组织未见炎性细胞浸润、纤维组织增生和假小叶的形成及坏死组织,肝细胞索围绕中央静脉整齐排列。模型组小鼠超过2/3肝组织可见肝细胞气球样变、坏死、炎性细胞浸润,细胞间质充血,肝索结构消失。TGCO低剂量组肝索排列紊乱,肝窦及血管周围炎性细胞浸润、肝细胞气球样变性较模型组减少;TGCO中、高剂量组肝索基本呈放射状排列,肝细胞肿胀及炎性细胞浸润较模型组得到较明显改善。肝脏组织病理切片见图 1。
|
| 图 1 TGCO对免疫性肝损伤小鼠肝组织病理学的影响(×100) Fig. 1 Influnence of CP on pathology of hepatic injure in mice caused by ConA (×100) |
与正常组比较,模型组肝脏病理变化显著(P < 0.01)。TGCO高、中剂量组与模型组比较,肝脏病理变化明显改善(P < 0.01),低剂量组与模型组相比肝脏病理变化差异无统计学意义。见表 2。
| 组别 | 剂量 (mg/kg) |
病理分级 | |||
| 0 | Ⅰ | Ⅱ | Ⅲ | ||
| 正常组 | - | 10 | 0 | 0 | 0 |
| 模型组 | - | 0 | 0 | 6 | 4** |
| TGCO低剂量组 | 230 | 0 | 2 | 6 | 2 |
| TGCO中剂量组 | 460 | 1 | 5 | 3 | 1## |
| TGCO高剂量组 | 920 | 2 | 4 | 4 | 0## |
| 联苯双酯组 | 100 | 2 | 6 | 2 | 0 |
| 注:与正常组比较,**P < 0.01;与模型组比较,##P < 0.01。 | |||||
与正常组相比,模型组血清ALT、AST、OCT水平显著升高(P<0.01)。与模型组比较,TGCO各剂量组小鼠血清中的ALT、AST、OCT含量不同程度的降低(P<0.01,P<0.05)。见表 3。
| 组别 | 剂量 (mg/kg) |
ALT (U/L) |
AST (U/L) |
OCT (pg/mL) |
| 正常组 | - | 25.10±2.62 | 93.56±14.52 | 43.02±3.86 |
| 模型组 | - | 72.72±15.48** | 179.50±46.71** | 98.28±20.17** |
| TGCO低剂量组 | 230 | 63.56±14.52 | 159.93±52.88 | 86.87±16.31 |
| TGCO中剂量组 | 460 | 52.91±17.48 | 144.74±47.84 | 75.34±23.50 |
| TGCO高剂量组 | 920 | 42.13±21.31# | 127.32±46.08 | 54.01±34.80# |
| 联苯双酯组 | 100 | 37.13±17.31## | 118.61±39.86# | 63.51±22.93# |
| 注:与正常组比较,**P < 0.01;与模型组比较,#P < 0.05,##P < 0.01。 | ||||
模型组小鼠IFN-γ、TNF-α均出现明显升高。与模型组相比,TGCO组能降低急性免疫性小鼠肝匀浆IFN-γ、TNF-α水平,且呈一定的剂量依赖性趋势,见表 4。
| pg/mL | ||||||
| 组别 | 剂量(mg/kg) | IFN-r | SOD | IL-1 | IL-6 | TNF-α |
| 正常组 | - | 11.36±1.74 | 132.57±8.21 | 91.59±9.45 | 113.47±8.06 | 53.79±15.30 |
| 模型组 | - | 29.38±2.97** | 85.50±12.08** | 153.94±11.14** | 232.96±18.17** | 121.33±19.29** |
| TGCO低剂量组 | 230 | 26.07±3.29 | 89.74±16.82 | 132.38±13.40# | 188.70±23.82# | 106.34±22.69 |
| TGCO中剂量组 | 460 | 19.83±3.75## | 96.69±17.69 | 116.24±15.34## | 165.74±26.33## | 89.46±25.37# |
| TGCO高剂量组 | 920 | 14.18±3.97## | 112.46±21.15# | 104.08±19.74## | 131.04±28.51## | 72.92±29.72# |
| 联苯双酯组 | 100 | 9.24±4.75## | 116.00±18.95## | 111.07±15.64## | 147.93±19.20## | 64.35±28.70## |
| 注:与正常组比较,**P < 0.01;与模型组比较,#P < 0.05,##P < 0.01。 | ||||||
与正常组比较,模型组肝组织中SOD的活性显著降低(P<0.01);与模型组比较,TGCO中、低剂量组无显著性差异(P>0.05),高剂量组具有统计学差异(P<0.05)。而山茱萸总苷各剂量组均能显著降低急性免疫性小鼠肝匀浆中IL-1、IL-6的含量水平。见表 4。
4 讨论ConA诱发的小鼠急性免疫性肝损伤模型机制为:刀豆与肝窦内的巨噬细胞结合,使循环T淋巴细胞汇入肝窦并增殖,释放出大量炎性介质如TNF-α、IFN-γ,对肝细胞造成损伤。此外,脾脏中存在大量活化的T淋巴细胞也产生大量细胞因子,随血液到达肝脏后激活巨噬细胞,进一步加重了肝脏损伤[9]。同时,对肝脏、脾脏产生明显影响,使肝脏、脾脏系数增大[10-11]。该模型的致病特点与临床上自身免疫性肝病、病毒性肝炎等疾病的发病机制相似,因此该实验模型适合研究自身免疫性肝病、人类病毒性肝炎等疾病,可以作为筛选急性肝损伤相关的治疗药物的动物模型[12]。
肝脏中含有大量的酶类,当肝组织受到损伤时,酶即从细胞进入血液中,血清中各类酶含量的升高,是肝损伤的重要标志[13-14]。ALT的水平反映肝细胞的受损程度,AST可反映线粒体的受损情况,而OCT的水平是急性肝损伤的早期灵敏指标,因此,血清中ALT、AST、OCT的水平是肝损伤的重要标志。本实验结果表明,不同剂量的TGCO均可降低血清中ALT、AST以及OCT,还可以减轻炎症浸润及坏死,改善肝脏的组织形态。此外,脾脏是体内的主要免疫器官,其指数的变化可以初步反映出机体的免疫功能,在一定程度上可以反映出免疫器官内淋巴细胞的数量从而反映脏器的损伤及炎症程度[15]。本实验结果显示应用不同剂量组TGCO给小鼠灌胃治疗后,均能降低小鼠肝脏、脾脏指数。
TNF-α作为肝脏炎症过程中的一个重要细胞因子, 可以诱导许多与肝损伤有关的细胞因子如IL-1、IL-6及IFN-γ的产生。IL-1、IL-6能与其他细胞因子共同促进B、T细胞的活化,诱导其他炎性介质产生,加重肝损伤[16-18]。此外,活化的IFN-γ聚集到肝脏后, 与肝细胞接触从而进一步加重肝细胞的损伤。本实验证明TGCO各剂量组能明显降低小鼠血清中IL-1、IL-6、TNF-α和IFN-γ水平。肝脏受到损伤时,肝细胞内会产生大量氧自由基作用于细胞膜脂质,从而产生脂质过氧化反应[19]。体内SOD是一种重要的抗氧化物质,可以清除自由基,减轻细胞膜在自由基等的攻击下的损伤程度,因此SOD的水平可反映出机体清除自由基的能力。而TGCO高剂量组能显著提高SOD的水平,增强机体清除氧自由基的能力,有效的阻止或减轻体内自由基所导致过氧化损伤。
本实验ConA所致肝损伤小鼠血清ALT、AST及OCT含量的增高以及肝脏、脾脏系数的增大,TNF-α和IL-1、IL-6及IFN-γ的增加,SOD的减少,共同证明了模型的建立成功。TGCO高、中、低剂量组给予小鼠灌胃治疗后,均能抑制小鼠血清中ALT、AST及OCT的增高,抑制小鼠肝脏、脾脏系数的增大。不同程度的降低TNF-α和IL-1、IL-6及IFN-γ的水平,提高SOD的含量。提示TGCO的保肝作用与其抑制炎性介质的释放、增强机体对自由基的清除能力的作用相关, 说明其保肝作用是多环节、多靶点的,疗效是值得期待的。体现了中药学“单味即复方”以及中医学“整体治疗”的观念,但是其具体机制还需要进一步研究。
| [1] | 国家药典委员会.中华人民共和国药典[S].北京:化学工业出版社, 2010:21. |
| [2] | 付桂香, 李建民, 周勇, 等. 山茱萸总苷抗炎免疫抑制作用及其机理的大鼠实验研究[J]. 中华微生物学和免疫学杂志, 2007, 27 (4): 316–320. |
| [3] | 赵武述, 李洁, 赵世萍, 等. 山茱英总苷抑制免疫的体内效应及其对移植心脏存活时间的延长[J]. 中华微生物学和免疫学杂志, 1995, 15 (5): 325–327. |
| [4] | 张兰桐, 袁志芳, 杜英峰, 等. 山茱萸的研究近况及开发前景[J]. 中草药, 2004, 35 (8): 952–955. |
| [5] | 严红梅, 张振海, 孙娥, 等. 中药治疗骨质疏松症的研究进展[J]. 中草药, 2014, 45 (8): 1174–1178. |
| [6] | 李平, 李静, 王惠明. 山茱萸总苷对去势大鼠骨代谢和骨密度影响的实验研究[J]. 天津中医药, 2007, 24 (4): 315–317. |
| [7] | 孟晶, 唐仕波, 李辰. 山茱萸总甙对大鼠角膜移植排斥反应免疫抑制作用机制研究[J]. 中国病理生理杂志, 2005, 21 (5): 927. |
| [8] | 来丽娜, 刘芳, 韦茴, 等. 山茱萸不同有效部位抗肝损伤作用的比较及急性毒性试验研究[J]. 长治医学院学报, 2014, 28 (5): 328–332. |
| [9] | Kaneko Y, Harada M, Kawano T, et al. Augmentation of Valpha14 NKT cell-mediated cytotoxicity by interleukin 4 in an autocrine mechanism resulting in the development of concanavalin A-induced hepatitis[J]. J Exp Med, 2000, 191 (5): 105–114. |
| [10] | Zhou RR, Liu HB, Peng JP, et al. High mobility group box chromosomal protein 1 in acute-on-chronic liver failure patients and mice with ConA-induced acute liver injury[J]. Exp Mol Pathol, 2010, 93 (2): 213–219. |
| [11] | Xu X, Hu Y, Zhai X, et al. Salvianolic acid A preconditioning confers protection against concanavalin A-induced liver injury through SIRT1-mediated repression of p66shc in mice[J]. Toxicol Appl Pharmacol, 2013, 273 (1): 68–76. DOI:10.1016/j.taap.2013.08.021 |
| [12] | 邓利娟, 李湛军, 罗楹, 等. Caspase抑制剂F1013对刀豆蛋白A诱导小鼠急性肝损伤的治疗作用[J]. 中国药理学通报, 2010, 28 (1): 136–139. |
| [13] | Kem MC. Serum aminotransferase concentration as evidence of hepatocellular damage[J]. Lancet, 2000, 355 (9204): 591–592. DOI:10.1016/S0140-6736(99)00219-6 |
| [14] | 马龙, 刘涛, 丁玉松, 等. 葡萄籽提取物对免疫性肝损伤的保护作用[J]. 毒理学杂志, 2009, 23 (3): 181–184. |
| [15] | 瞿俊勇, 田梦, 贺建华, 等. 白花蛇舌草多糖对免疫抑制小鼠的免疫调节作用研究[J]. 中药材, 2015, 38 (9): 1943–1946. |
| [16] | Zhao Y, Liu J, Wang J, et al. Fumigaclavine C improves concanavalin-A induced liver injury in mice mainly via inhibiting TNF-alpha production and lymphocyte adhesion to extracellular matrices[J]. J Pharmpharmacol, 2004, 56 (6): 775–782. |
| [17] | Liu DF, Wei W, Song LH, et al. Upregulation of TNF-alpha and IL-6 mRNA in mouse liver induced by bacille calmette-guerin plus lipopolysaccharide[J]. Acta Pharmacol Sin, 2006, 27 (4): 460. DOI:10.1111/aphs.2006.27.issue-4 |
| [18] | Tukov FF, Luyendyk JP, Ganey PE, et al. The role of tumor necrosis factor alpha in lipopolysaccharide/ranitidine-induced inflammatory liverinjury[J]. Toxicol Sci, 2007, 100 (1): 267. DOI:10.1093/toxsci/kfm209 |
| [19] | 李国栋, 陈园园, 王盼, 等. 野菊花中萜类和黄酮类化合物保肝作用研究[J]. 中草药, 2013, 44 (24): 3510–3514. |
2. Department of Hepatobiliary Surgery in First Central Hospital, Tianjin 300192, China;
3. Key Laboratory of Emergency Medicine of Critical Disease of Healthful Ministry in First Central Hospital, Tianjin 300192, China;
4. The First Central Clinical College, Tianjin Medical University, Tianjin 300192, China
 2017, Vol. 34
2017, Vol. 34