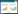文章信息
- 王静王静, 王绪霖王绪霖
- WANG Jing, WANG Xu-lin
- 软肝煎对高脂饮食肝纤维化大鼠HA、LN、PCⅢ、CⅣ及病理的影响
- Effects of Ruanganjian on the expression of HA、LN、PCⅢ、CⅣ and pathologic changes in hepatic fibrosis rats induced by high fat diet
- 天津中医药, 2017, 34(2): 128-131
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(2): 128-131
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.02.16
-
文章历史
- 收稿日期: 2016-09-11
2. 天津医科大学总医院, 天津 300052
肝纤维化是指由各种致病因子所致肝内结缔组织异常增生,导致肝内弥漫性细胞外基质(ECM)过度沉积的病理过程,是多种慢性肝病发展的共同病理基础,其包括肝内纤维生成与降解失衡、肝内过多胶原沉积、肝纤维结缔组织异常增生等,进一步恶化将会演变为肝硬化、肝癌等,逆转肝纤维化是防治肝硬化和肝癌的有效途径。软肝煎经临床多年证实对治疗脂肪肝有良好疗效,本研究采用高脂饮食诱导的大鼠肝纤维化模型,检测大鼠血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总胆固醇(TC)、甘油三酯(TG)、透明质酸(HA)、层连蛋白(LN)、Ⅲ型前胶原(PCⅢ)、Ⅳ型胶原(CⅣ)水平,探讨软肝煎对肝纤维化的治疗作用,为其临床应用与进一步研发提供实验依据。
1 材料与方法 1.1 实验材料 1.1.1 实验动物及分组SD大鼠,清洁级,42只,体质量150~180 g,由天津医科大学公共卫生学院毒理教研室提供。随机分为4组:正常组8只,模型组18只,中药高剂量组8只,中药低剂量组8只。
1.1.2 药品软肝煎,其主要组成为:海藻、夏枯草、金钱草、何首乌、牡蛎。
中药煎煮方法:将中药倒入煎药器(中药砂锅)中,加足量清水漫过中药(高出约3 cm),浸泡90 min后开始煎煮,水沸后文火煎煮30 min,倒出药液。再加入适量清水按上法再煎煮30 min倒出药液,并压挤出中药渣中剩余药液,将两次药液混合,放入电热恒温水浴箱中浓缩至50 mL(相当于每mL药液含3 g生药剂量)。
1.1.3 主要试剂VG特殊染色试剂盒,广州市俪科贸易有限公司;HA、LN、PCⅢ、CⅣ放免试剂盒,上海海研医学生物技术中心;胆固醇,北京鼎国生物技术发展公司;其他试剂均为市售分析纯。
1.1.4 主要仪器台式低速离心机、微波炉、日立7170A型生化自动分析仪、光学显微镜等。
1.2 方法 1.2.1 模型制备正常组饲以普通饲料,其余3组均饲以高脂饲料,实验动物自由进食和饮水。饲养24周后随机抽取模型组中4只大鼠处死,取肝组织,10%福尔马林固定,Van Giesson苦味酸酸性复红染色,光镜下观察,确定肝纤维化模型成立。普通饲料由天津医科大学公共卫生学院提供。高脂饲料:普通饲料88%+胆固醇2%+猪油10%。
1.2.2 用药给药量按等效量换算法换算,将成人每日所需生药量换算成大鼠每日所需药量:成人每日全方量为155 g,每200 g大鼠所需生药量每日为:155 g×0.018=2.79 g(0.018是根据中药药理实验方法学人与大鼠按体表面积转换系数)。为了方便计算和缩短灌胃时间,将药量近似处理,分别对中药低剂量组和中药高剂量组以每日生药12.8 g/kg体质量和每日生药25.6 g/kg体质量行中药灌胃,模型组、正常组以生理盐水灌胃,每天晨起1次灌胃,持续8周。
1.2.3 标本留取新鲜血2 000 r/min离心15 min,吸取上清液血清分置于2个Eppendorf管中,一管立即送检测ALT、AST、TC、TG,另一管保存于-20 ℃中待测HA、LN、PCⅢ和CⅣ。
1.2.4 指标检测生化自动分析仪测血清ALT、AST、TC、TG。放射免疫分析法测HA、LN、PCⅢ、C Ⅳ。常规石蜡切片,苏木精-伊红(HE)染色和胶原染色,光镜观察肝脏脂肪变性及炎症活动度。
1.2.5 统计分析应用SPSS18.0统计软件包处理。计量资料采用均数±标准差(x±s)表示,同一指标的组间比较采用单因素方差分析,分析前行方差齐性检验。方差齐时用LSD法,若方差不齐则用Tamhane's法。等级资料的比较采用Kruskal-Wallis法进行秩和检验,并用Nemenyi法进行两两比较。
2 结果 2.1 血中TG、TC、ALT、AST测定结果两治疗组血清TC、ALT、AST明显低于模型组,有统计学差异(P < 0.05);高剂量组血清TG低于模型组,有统计学差异(P < 0.05)。本实验结果提示软肝煎可降低大鼠血清TG、TC、ALT、AST, 中药高剂量疗效优于低剂量。见表 1、表 2。
| 组别 | 动物数 | TG(mmol/L) | TC(mmol/L) |
| 正常组 | 8 | 0.59±0.13# | 1.08±0.14# |
| 模型组 | 8 | 1.92±0.39* | 7.70±1.83* |
| 中药低剂量组 | 8 | 1.45±0.52* | 4.30±1.13*# |
| 中药高剂量组 | 8 | 1.14±0.27*# | 2.65±0.82*# |
| 注:与正常组比较,*P < 0.05;与模型组比较,#P < 0.05。 | |||
| 组别 | 动物数 | ALT(U/L) | AST(U/L) |
| 正常组 | 8 | 68.13±5.64# | 131.00±10.01# |
| 模型组 | 8 | 269.63±61.36* | 357.00±51.60* |
| 中药低剂量组 | 8 | 144.38±86.40*# | 240.13±40.63*# |
| 中药高剂量组 | 8 | 99.13±20.19*# | 218.63±27.11*# |
| 注:与正常组比较,*P < 0.05;与模型组比较,#P < 0.05。 | |||
模型组大鼠血清HA、LN、PCⅢ、CⅣ明显高于正常组、两治疗组,有统计学差异(P < 0.05)。本实验结果提示软肝煎可明显降低大鼠血清HA、LN、PCⅢ、CⅣ,中药高剂量疗效优于低剂量。见表 3。
| 组别 | 动物数 | HA(μg/L) | LN(μg/L) | PCⅢ(μg/L) | CⅣ(μg/L) |
| 正常组 | 8 | 451.57±24.97# | 23.23±1.71# | 15.14±2.53# | 42.38±5.06# |
| 模型组 | 8 | 627.40±51.51* | 40.71±1.15* | 37.28±2.80* | 64.58±2.86* |
| 低剂量组 | 8 | 551.36±44.21*# | 33.18±2.51*# | 29.45±1.67*# | 49.16±2.85*# |
| 高剂量组 | 8 | 469.84±58.29# | 25.00±1.78# | 20.14±4.19*# | 42.43±3.30# |
| 注:与正常组比较,*P < 0.05;与模型组比较,#P < 0.05。 | |||||
采用Kruskal-Wallis法进行多样本比较秩和检验,P < 0.05说明各组脂变率有差别。经Nemenyi法两两比较,与正常组相比,模型组和低剂量组脂肪变性明显并有统计学差异(P<0.05),高剂量组和正常组之间无统计学差异(P>0.05)。与模型组比较,低剂量组无统计学差异(P>0.05),高剂量组脂肪变性明显减轻并有统计学差异(P<0.05)。本实验结果提示软肝煎可减轻大鼠肝脏脂肪变性,且高剂量组疗效优于低剂量组。见表 4。
| 组别 | 动物数 | 肝脏脂变性程度 | ||||
| -- | + | ++ | +++ | ++++ | ||
| 正常组# | 8 | 8 | ||||
| 模型组* | 8 | 1 | 7 | |||
| 中药低剂量组* | 8 | 2 | 6 | |||
| 中药高剂量组# | 8 | 3 | 5 | |||
| 注:与正常组比较,*P < 0.05;与模型组比较,#P < 0.05。 | ||||||
中药低剂量组与模型组之间无统计学差异(P>0.05),中药高剂量组低于模型组,有统计学差异(P<0.05)。本实验结果提示软肝煎可减轻大鼠肝脏炎症,且高剂量组疗效优于低剂量组。见表 5。
| 组别 | 动物数 | 炎症活动度计分 (分) |
| 正常组 | 8 | 1.50±0.53# |
| 模型组 | 8 | 22.13±2.90* |
| 中药低剂量组 | 8 | 13.00±2.00* |
| 中药高剂量组 | 8 | 9.63±2.13 |
| 注:与正常组比较,*P<0.05; 与模型组比较,#P<0.05。 | ||
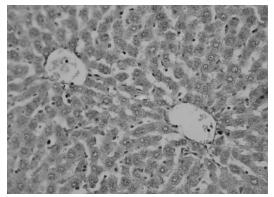
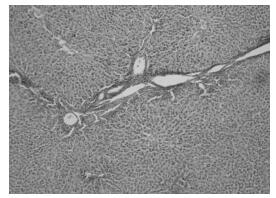
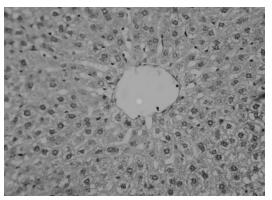
正常组胶原纤维只在汇管区内有少量表达。模型组可见中央静脉周围、窦周及汇管区内纤维结缔组织增生明显,汇管区扩大,并见增生的纤维组织自汇管区向小叶内延伸,不完全分割肝小叶,肝窦内连续性环状胶原纤维沉积。高剂量组汇管区纤维组织增生较模型组明显减少,纤维间隔细薄且不连续,仍可见汇管区扩大。低剂量组介于模型组和高剂量组之间。见图 1-4。
|
| 图 1 正常组病理改变(VG染色×400) Fig. 1 Pathological changes of normal group (VG staining×400) |
|
| 图 2 模型组病理改变(VG染色×100) Fig. 2 Pathological changes of model group (VG staining×100) |
|
| 图 3 中药低剂量组病理改变(VG染色×400) Fig. 3 Pathological changes of low dose TCM group (VG staining×400) |
|
| 图 4 中药高剂量组病理改变(VG染色×400) Fig. 4 Pathological changes of high dose TCM group (VG staining×400) |
肝组织纤维化计分(SSS)中药低剂量组与模型组之间无统计学差异(P>0.05),中药高剂量组低于模型组,有统计学差异(P<0.05)。本实验结果提示软肝煎可减轻大鼠肝脏纤维化程度,且高剂量组疗效优于低剂量组。见表 6。
| 组别 | 动物数 | 纤维化计分 (分) |
| 正常组 | 8 | 1.75±0.46# |
| 模型组 | 8 | 15.38±4.69* |
| 中药低剂量组 | 8 | 6.63±1.41* |
| 中药高剂量组 | 8 | 5.00±1.31# |
| 注;与正常组比较,*P<0.05;与模型组比较,#P<0.05。 | ||
随着人们生活方式和饮食结构的改变,脂肪性肝病发病逐年增多,并趋于年轻化[1]。肝纤维化在单纯脂肪肝向脂肪性肝硬化的病理发展中起关键作用。预防或逆转脂肪性肝纤维化在脂肪肝尤其是重度脂肪肝患者的治疗中有重要意义[2]。制备与各种原因所致人类慢性肝病相似的肝纤维化动物模型不仅是研究肝纤维化发病机制的重要基础,也是临床评价诊断和预防治疗方法的有效手段[3-4]。本研究采用高脂饮食成功复制了大鼠肝纤维化模型。
目前肝纤维化的血清标志物主要有HA、LN、CⅣ、PCⅢ[5-6]。HA是一种糖胺多糖,由间质细胞合成、分泌,肝纤维化时合成增加, 而肝内皮细胞对HA降解能力下降, 导致血清中HA水平明显增高, 其增高程度与肝组织炎症和纤维化程度呈正相关, 可作为抗肝纤维化药物治疗动态观察指标[7],是反映肝纤维化最具价值的临床诊断血清学标志物[8]。CⅣ主要在肝内合成及代谢,是基底膜的重要组成成分,反映基底膜胶原的更新率,被认为是反映胶原蛋白生成出现最早的重要指标[9]。LN是一种非胶原结构糖蛋白,分布于基底膜的透明层,其在体内水平的高低与肝脏组织纤维化的程度和门静脉-肝脏静脉压力梯度的大小有关,肝纤维化时肝窦中的LN合成大量增加并过度沉积,血清升高一定程度反映肝窦毛细血管化的程度及门脉区纤维化范围,与肝组织的病理程度显著相关[10],是肝纤维化早期改变的敏感指标。PCⅢ反映肝内Ⅲ型胶原的合成情况,其水平与肝纤维化病变程度密切相关,可以反映肝纤维合成的状况和炎症状况,其含量会随损伤程度而逐渐增加[11]。软肝煎其主要药物中夏枯草清热散结。海藻消痰结散瘿瘤,清燥热之痰火,且能软坚。何首乌补肝肾,益精血,有阻止胆固醇在肝内沉积及减轻动脉硬化之作用。金钱草有良好的利胆功能。牡蛎益阴潜阳有良好的软坚作用。
本研究采用高脂饮食诱导大鼠肝纤维化模型,观察到软肝煎可降低肝纤维化大鼠血清ALT、AST、TC、TG、HA、LN、PCⅢ、CⅣ含量,保护肝细胞,改善肝功能,减轻肝脏炎症,抑制胶原合成,促进胶原降解,减少了肝星状细胞活化,抑制了肝纤维化的发生、发展,为其临床应用与进一步研发提供实验依据。
| [1] | 南月敏, 李文聪. 中药治疗非酒精性脂肪性肝纤维化的研究现状[J]. 临床肝胆病杂志, 2013, 29 (4): 249–252. |
| [2] | 孙保木, 刘成海. 脂肪性肝纤维化研究进展[J]. 中西医结合肝病杂志, 2003, 13 (2): 126–128. |
| [3] | Wang XJ, Liu L, Sun H, et al. Studies on the metabonomics of rat liver injury induced by ethanol and interfering effects of Yin Chen Hao Tang[J]. Chin Pharmacol Bull, 2008, 24 (4): 452–457. |
| [4] | Guo JJ, Yang XF. Research progress of the protective effect of flava-noids on experimental liver injury of animals[J]. Chin Pharmacol Bull, 2008, 24 (1): 5–10. |
| [5] | 王颖, 陈立宇, 冯萍. 肝纤维化的无创诊断技术研究进展[J]. 华西医学, 2014, 29 (9): 1783–1786. |
| [6] | Sebastiani G, Castera L, Halfon P, et al. The impact of liver disease aetiology and the stages of hepatic fibrosis on the performance of non-invasive fibrosis biomarkers:an international study of 2411 cases[J]. Aliment Pharmacol Ther, 2011 (34): 1202–1216. |
| [7] | Qu W, Huang H, Li K, et al. Danshensumediated protective effect against hepatic fibrosis induced by carbon tetrachloride in rats[J]. Pathol Biol (Paris), 2014, 62 : 348–353. DOI:10.1016/j.patbio.2014.07.008 |
| [8] | Caviglia GP, Ciancio A, Rosso C, et al. Noninvasive methods for the assessment of hepatic fibrosis:transient elastography, hyaluronic acid, 13C-aminopyrine breath test and cytokeratin 18 fragment[J]. Ann Hepatol, 2013, 13 (1): 91. |
| [9] | 程红春. 血清Ⅳ-C水平检测对肝病患者肝纤维化的诊断价值[J]. 实用医药杂志, 2014, 31 (7): 618. |
| [10] | 赵治凤, 贾秋龙. 肝纤维化四项联合检测对410例慢性肝炎诊断的临床意义[J]. 中国民康医学, 2012, 24 (7): 798–799. |
| [11] | Karna E, Szoka L, Palka JA. The mechanism of hydralazine induced collagen biosynthesis in cultured fibroblasts[J]. Naunyn Schmiedebergs Arch Pharmacol, 2013, 386 (4): 303. DOI:10.1007/s00210-013-0836-5 |
2. General Hospital of Tianjin Medical University, Tianjin 300052, China
 2017, Vol. 34
2017, Vol. 34