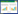文章信息
- 张耀丹, 陈书, 苏冷高娃, 白颖慧, 杨坤宝, 鲁碧楠, 庞宗然
- ZHANG Yao-dan, CHEN Shu, SU Leng-gao-wa, BAI Ying-hui, YANG Kun-bao, LU Bi-nan, PANG Zong-ran
- 菩人丹对ob/ob小鼠糖脂代谢及胰岛素抵抗的影响
- Effect of Purendan on glucolipid metabolism and insulin resistance in ob/ob mice
- 天津中医药, 2017, 34(3): 175-180
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(3): 175-180
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.03.10
-
文章历史
- 收稿日期: 2016-12-26
近年来,以胰岛素抵抗 (IR) 为特征的2型糖尿病 (T2DM) 发病率明显增加,肥胖作为IR及T2DM的重要危险因素,已成为一个全球关注的医学问题[1-3]。肥胖引发的血脂紊乱与IR联系紧密,而IR是肥胖与T2DM发生过程中共同的病理生理机制[4-5]。因此,有效控制肥胖、改善糖脂代谢紊乱、增强外周组织对胰岛素的敏感性,可以有效改善IR并从根本上预防T2DM及其并发症的发生。中药复方菩人丹主要包括苦瓜、人参、丹参等药物,在调节机体脂代谢紊乱、提高胰岛素敏感性等方面有明显的作用和优势,可以有效预防及减缓T2DM进程[6-7]。
本研究以瘦素基因遗传缺陷ob/ob小鼠为研究对象,考察菩人丹对其糖脂代谢及胰岛素抵抗的影响,为菩人丹改善机体糖脂代谢紊乱及IR提供临床应用的实验证据。
1 材料 1.1 实验动物SPF级C57BL/6J小鼠10只,雄性,3周龄,体质量 (9.70±0.76) g;SPF级ob/ob小鼠20只,雄性,3周龄,体质量 (9.88±2.40) g,北京华阜康生物科技股份有限公司提供,许可证号:SCXK (京)2014-0004。所有实验小鼠均饲养于中国人民解放军总医院第一附属医院SPF级动物房,12 h/12 h光暗周期下,自由摄取食物和水。
1.2 主要药品及试剂人参购自北京同仁堂 (批号:20150524);鲜苦瓜购自北京天地生有机食品有限公司;丹参 (批号:140601)、制何首乌 (批号:140701) 和葛根 (批号:140801) 均购自北京亚威中药饮片有限公司;制水蛭 (批号:14051001) 购自金香中药饮片有限公司;总胆固醇 (TC)、甘油三酯 (TG)、高密度脂蛋白 (HDL)、低密度脂蛋白 (LDL)、葡萄糖 (GLU) 等试剂均购于世纪沃德生物制剂科技股份有限公司;小鼠胰岛素酶联免疫吸附实验 (ELISA) 检测试剂盒,购于R & D Systems公司。
1.3 主要仪器旋转蒸发器,RE-52A,上海亚荣生化仪器厂;冷冻干燥机LYO-100FS,北京开元永盛冻干技术有限公司);血糖试纸与血糖仪 (强生稳豪型),强生 (中国) 医疗器材有限公司;多功能酶标仪,Synergy系列,美国伯腾仪器有限公司;荧光倒置显微镜,奥林巴斯 (中国) 有限公司;日立7020全自动生化分析仪,日立 (中国) 有限公司。
2 方法 2.1 菩人丹制备方法菩人丹 (由人参、鲜苦瓜、丹参、葛根、制何首乌、制水蛭组成),鲜苦瓜去籽切片,平铺于冻干机物料盘中,开机预冻,隔板降温至-45 ℃保持2 h预冻结束,设置冻干曲线:-30 ℃ 2 h,-10 ℃ 3 h,0 ℃ 3 h,10 ℃ 3 h,20 ℃ 3 h,35 ℃ 4 h。打开真空泵,真空干燥,按照编程步骤,直至干燥结束,即得冻干苦瓜片 (100 g鲜苦瓜可得3 g冻干苦瓜),打粉,过100目筛。人参单独以冷水浸泡过夜,用10倍水回流提取2次,每次1.5 h,过滤后收集提取液;丹参、葛根、制何首乌和制水蛭混合后以冷水浸泡过夜,用10倍水回流提取2次,每次1.5 h,过滤后收集提取液,将2次提取液混合,滤去残渣,于旋转蒸发仪中浓缩,加入之前的苦瓜冻干粉,蒸馏水补齐,制得菩人丹溶液 (相当于生药量0.90 g/mL)[8]。
2.2 动物分组及给药方法实验小鼠适应性饲养1周,于4周龄时分组,以C57BL/6J小鼠为空白组,ob/ob小鼠随机分为模型组和菩人丹组,每组10只,均饲以SPF级普通饲料。菩人丹组选取前期摸索最佳给药量[6, 9-12],即生药量9.00 g/kg给药,空白组和模型组给予同体积蒸馏水,每天1次,连续灌胃15周。
2.3 动态监测空腹体质量每周末次给药后,小鼠禁食不禁水12 h,测量空腹体质量。
2.4 口服葡萄糖耐量实验 (OGTT)于菩人丹干预第14周末次给药后,小鼠禁食不禁水12 h,测量空腹体重并计算葡萄糖灌胃剂量 (给药剂量:2 g/kg),于空腹及糖负荷后15、30、60、90、120、150、180 min以剪尾法取血,测量血糖值;绘制血糖随时间变化曲线并计算曲线下面积。
2.5 取材并计算内脏脂肪指数于菩人丹干预第15周末次给药后,小鼠禁食不禁水12 h,眶静脉取血,室温静置2 h,3 500 r/min离心10 min后制备血清;处死后解剖,分离双侧肾周脂肪及睾周脂肪,分别称量记录其湿质量,相加为内脏脂肪质量并计算内脏脂肪指数 (内脏脂肪质量/小鼠空腹体质量×100);4%多聚甲醛固定睾周脂肪组织,以备相关检测。
2.6 脂肪细胞形态观察苏木精-伊红 (HE) 染色观察睾周脂肪细胞形态。
2.7 血脂及空腹血胰岛素 (FINS) 水平测定全自动生化仪检测血清中FPG、TC、TG、HDL和LDL的水平;小鼠胰岛素ELISA试剂盒测定血清中FINS的水平。
2.8 胰岛素抵抗 (HOMA-IR) 评价指标稳态模式评估法评价HOMA-IR。HOMA-IR=FPG (mmoL)×FINS (mIU/L)/22.5;胰岛素敏感指数 (ISI) 评价胰岛素敏感性,ISI=ln[1/(FPG×FINS)]。
2.9 统计学分析SPSS 20.0软件分析处理实验数据,计量资料以均数±标准差 (x±s) 表示,多组间均数比较采用单因素方差分析 (one-way ANOVA),组间两两比较采用若方差齐采用LSD法,若方差不齐,采用Dunnett’s T3法,P<0.05表示差异有统计学意义。
3 结果 3.1 菩人丹对ob/ob小鼠空腹体质量的影响如图 1所示,相较于空白组,模型组空腹体质量自给药1周后显著增加 (P<0.05),并且差异逐渐扩大至给药结束 (P<0.01);相较于模型组,菩人丹组空腹体质量无统计学差异 (P>0.05)。
|
| 图 1 菩人丹对ob/ob小鼠空腹体质量的影响 (x±s) Fig. 1 Effects of drug intervention on the body weight in mice (x±s) |
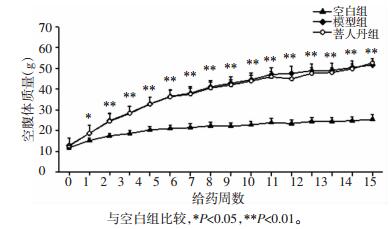
OGTT考察各组糖耐量受损 (IGT) 情况,血糖随时间变化曲线如图 2所示,计算曲线下面积。相较于空白组,模型组曲线下面积显著升高 (P<0.01);相较于模型组,菩人丹组曲线下面积略高但无统计学差异 (P>0.05)。
|
| 图 2 菩人丹对ob/ob小鼠葡萄糖耐量的影响 (x±s) Fig. 2 Effects of drug intervention on glucose tolerance in mice (x±s) |
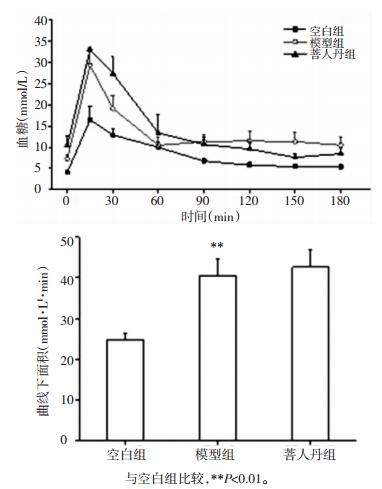
如图 3所示,相较于空白组,模型组内脏脂肪指数显著升高 (P<0.01);相较于模型组,菩人丹组内脏脂肪指数略高但差异无统计学意义 (P>0.05)。
|
| 图 3 菩人丹对ob/ob小鼠内脏脂肪指数的影响 (x±s) Fig. 3 Effects of drug intervention on fat index in mice (x±s) |
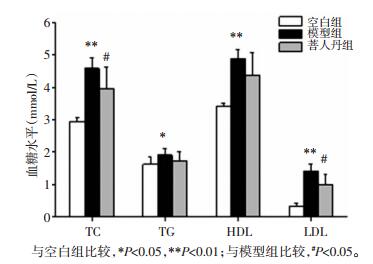
与空白组相比,模型组血清中TC、HDL和LDL水平均显著升高 (P < 0.01),TG水平显著升高 (P < 0.05);与模型组相比,菩人丹组血清中TCL和LDL水平均显著降低 (P < 0.05),TG和HDL水平降低,但无统计学差异 (P > 0.05),见图 4。
|
| 图 4 菩人丹对ob/ob小鼠血脂水平的影响 (x±s) Fig. 4 Effects of drug intervention on the blood lipid levels in mice (x±s) |
相较于空白组,模型组FPG水平显著升高 (P<0.01);相较于模型组,菩人丹组FPG水平降低,但差异无统计学意义 (P>0.05)。相较于空白组,模型组FINS水平无统计学差异 (P>0.05);相较于模型组,菩人丹组FINS水平显著降低 (P<0.01),见表 1。
| mmol/L | ||
| 组别 | FPG | FINS |
| 空白组 | 3.11±0.40 | 19.01±3.37 |
| 模型组 | 7.64±1.73** | 17.50±4.26 |
| 菩人丹组 | 6.61±1.98 | 10.59±1.71## |
| 注:与空白组比较,**P < 0.01;与模型组比较,##P < 0.01。 | ||
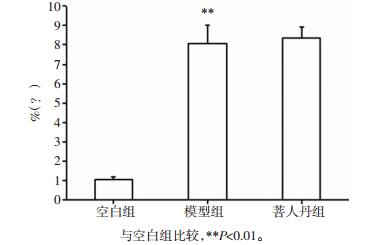
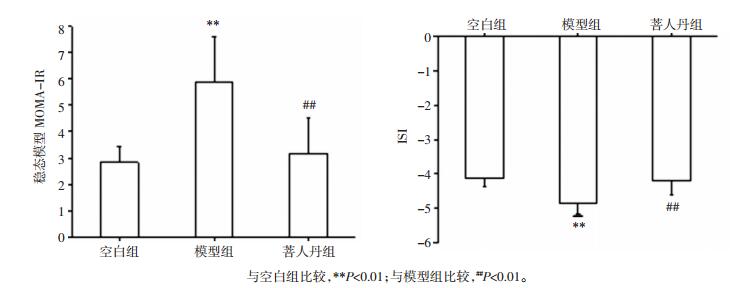
相较于空白组,模型组HOMA-IR显著升高 (P<0.01);相较于模型组,菩人丹组HOMA-IR显著降低 (P<0.01)。相较于空白组,模型组ISI显著降低 (P<0.01);相较于模型组,菩人丹组ISI水平显著升高 (P<0.01),见图 5。
|
| 图 5 菩人丹对ob/ob小鼠胰岛素抵抗水平及胰岛素敏感指数的影响 (x±s) Fig. 5 Effects of drug intervention on the level of insulin resistance and ISI in mice (x±s) |
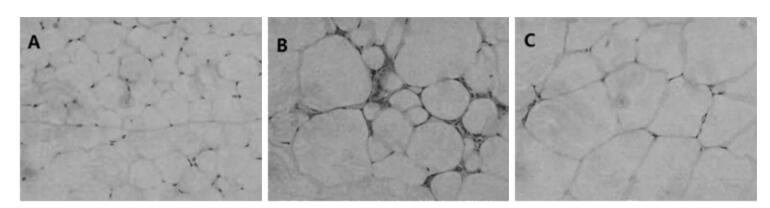
如图 6所示,空白组 (A) 脂肪细胞排列紧密,规则有序,细胞体积相近;模型组 (B) 脂肪细胞排列疏散不规则,体积大小不一,部分脂肪细胞体积明显增加,细胞间可见新生的小脂肪细胞,可见炎细胞浸润灶;菩人丹组 (C) 脂肪细胞体积大小相近,排列相对紧密,规则有序。
|
| 图 6 菩人丹对ob/ob小鼠脂肪细胞形态的影响 (HE染色,×400) Fig. 6 Effects of drug intervention on the form of adipocytes in mice (HE staining, ×400) |
随着社会生活水平的提高,肥胖和T2DM已成为一个全球关注的医学问题,两者之间的关系也成为国内外糖尿病研究的热点。肥胖引发的血脂紊乱与胰岛素抵抗联系紧密,而胰岛素抵抗是T2DM发生发展的重要病理生理机制。因此,调节机体糖脂代谢紊乱、提高外周组织的胰岛素敏感性,可以有效改善肥胖引起的IR并预防肥胖向T2DM发展。目前,预防肥胖、调节糖脂代谢及增加胰岛素敏感性是糖尿病研究关注的焦点和热点问题,而降脂减肥、增加血清胰岛素敏感性的药物多具有肝肾毒性、肠道功能紊乱等不良反应[13]。因此,从中药民族药中发现T2DM早期干预药物的工作势在必行。
自发性2型糖尿病动物模型因其自身疾病进程与人类相似,在糖尿病的发病机制研究、药物筛选和研发等领域中有着极高的应用价值[14]。其中,瘦素基因遗传缺陷的ob/ob小鼠是目前糖尿病相关研究中使用最广泛的动物模型之一[15]。研究发现,ob/ob小鼠位于瘦素蛋白基因的密码子发生点突变, 导致其具有正常功能的瘦素无法表达和分泌,因此出现肥胖、摄食过量、糖耐量受损、胰岛素抵抗等症状[15-16]。该鼠从断奶时即开始发胖,肥胖程度随着周龄增加逐渐加重, 终生表现食欲旺盛;约3~4周龄左右开始出现高胰岛素血症及胰岛素抵抗, 是典型的2型糖尿病前期症状[17-18]。
菩人丹主要由苦瓜、人参、丹参、葛根等药物组成,是临床观察结合现代药理学研究而成的中药复方。其中苦瓜具有清热解毒、滋养肝肾之功效,现代药理研究表明苦瓜富含多糖、多肽、皂苷、类黄酮等多种生物活性成分,具有降血糖、调节糖脂代谢、改善肥胖引起的胰岛素抵抗等药理作用[19-22];人参具有补气固脱、生津安神的功效,现代研究证实人参成分复杂,其有效成分如人参皂苷、人参多肽等,均具有调节糖脂代谢的药理作用[23-26];丹参,可祛瘀止痛、活血通经, 具有降血糖、降血压、抗炎、调节免疫等药理作用[27-28];葛根,可解肌退热,生津止渴,升阳止泻,现代药理学研究表明, 其有效成分葛根素在降血糖血脂、糖尿病肾保护、改善代谢与免疫功能等方面均有一定的药理作用[29-30]。因此,本实验以菩人丹为研究对象,探讨其对ob/ob小鼠糖脂代谢、胰岛素敏感性及脂肪细胞形态的影响。
本实验采用自发性肥胖、胰岛素抵抗模型ob/ob小鼠成功复制了肥胖胰岛素抵抗模型,相较于空白组,模型组小鼠的空腹体质量、内脏脂肪指数均显著升高,OGTT曲线下面积显著升高,血清中TC、TG、HDL、LDL、FPG水平与HOMA-IR显著升高,ISI显著降低,而FINS水平略有下降;空腹体质量、内脏脂肪指数结果提示发生肥胖,OGTT结果提示发生糖耐量损伤,血清指标结果提示发生血脂紊乱,HOMA-IR与ISI结果提示发生胰岛素抵抗,FPG及FINS水平结果提示模型组小鼠胰岛功能或已受损;而与模型组相比,菩人丹组小鼠血清中TC与LDL水平显著降低,提示菩人丹可以明显改善脂代谢紊乱,从而预防糖脂毒性;HOMA-IR显著降低,ISI显著升高,提示菩人丹可以显著提高胰岛素敏感性,有效改善胰岛素抵抗;FINS水平降低,提示菩人丹可能通过提高胰岛素敏感性,减轻胰岛素分泌负担来保护胰岛β细胞。从睾周脂肪细胞形态上看,相较于空白组,模型组ob/ob小鼠脂肪细胞体积明显增大且排列不规则;相较于模型组,菩人丹组ob/ob小鼠睾周脂肪细胞排列形态有改善的趋势。
菩人丹改善ob/ob小鼠胰岛素抵抗的作用特点主要体现在调节糖脂代谢紊乱,降低胰岛素抵抗指数,提高胰岛素敏感性,虽然有一定疗效但其药效物质基础和作用机制还不明确,尚需进一步探明。
| [1] | Guariguata L, Whiting DR, Hambleton I, et al. Global estimates of diabetes prevalence for 2013 and projections for 2035[J]. Diabetes Res Clin Pract, 2014, 103 (2): 137–149. DOI:10.1016/j.diabres.2013.11.002 |
| [2] | Kong AP, Luk AO, Chan JC. Detecting people at high risk of type 2 diabetes-How do we find them and who should be treated?[J]. Best Pract Res Clin Endocrinol Metab, 2016, 30 (3): 345–355. DOI:10.1016/j.beem.2016.06.003 |
| [3] | Patel P, Abate N. Body fat distribution and insulin resistance[J]. Nutrients, 2013, 5 (6): 2019–27. DOI:10.3390/nu5062019 |
| [4] | Castro AV, Kolka CM, Kim SP, et al. Obesity, insulin resistance and comorbidities? Mechanisms of association[J]. Arq Bras Endocrinol Metabol, 2014, 58 (6): 600–609. DOI:10.1590/0004-2730000003223 |
| [5] | Ebbert JO, Jensen MD. Fat depots, free fatty acids, and dyslipidemia[J]. Nutrients, 2013, 5 (2): 498–508. DOI:10.3390/nu5020498 |
| [6] | 庞宗然, 赵玉堂, 李静华, 等. 菩人丹超微粉对肥胖型2型糖尿病大鼠糖代谢相关指标的影响[J]. 中国实验方剂学杂志, 2010 (5): 107–110. |
| [7] | 王朝晖, 庞宗然, 刘祖涵, 等. 菩人丹对2型糖尿病大血管损伤大鼠FFAs及血脂4项的影响[J]. 中国中医基础医学杂志, 2012, 18 (3): 264–265. |
| [8] | 陈书, 张耀丹, 鲁碧楠, 等. 菩人丹对ob/ob肥胖小鼠血清内脂素及脂肪细胞形态的影响[J]. 中成药, 2016, 38 (12): 2669–2673. |
| [9] | 刘祖涵, 庞宗然, 王朝晖, 等. 菩人丹超微粉对2型糖尿病大鼠胰岛α、β细胞的影响[J]. 中国中医基础医学杂志, 2011, 17 (3): 326–328. |
| [10] | 庞宗然, 刘祖涵, 苏晓慧, 等. 菩人丹超微粉对肥胖型T2DM大血管损伤大鼠ET-1、NO、FFAs含量的影响[J]. 中国老年学杂志, 2011, 38 (10): 1779–1780. |
| [11] | 庞宗然, 苏晓慧, 刘祖涵, 等. 菩人丹超微粉对T2DM大血管病变大鼠主动脉形态结构的影响[J]. 辽宁中医杂志, 2011, 38 (10): 1923–1925,2112. |
| [12] | 庞宗然, 苏晓慧, 刘祖涵, 等. 菩人丹超微粉对T2DM大血管病变大鼠骨骼肌组织IRS-1mRNA、GLUT4mRNA表达的影响[J]. 上海中医药杂志, 2010, 44 (10): 66–69. |
| [13] | 中国2型糖尿病防治指南 (2013年版)[J]. 中国糖尿病杂志, 2014, 22(8): 2-42. |
| [14] | 李娟娥, 王磊, 秦灵灵, 等. 自发性2型糖尿病啮齿类动物模型研究概况[J]. 中国实验方剂学杂志, 2010, 16 (6): 267–271. |
| [15] | 薛欣, 李玉梅, 陈冰, 等. 瘦素缺陷型ob/ob小鼠和C57BL/6J小鼠生物学特性的对比研究[J]. 中国医科大学学报, 2015, 44 (11): 983–986. |
| [16] | 刘苏, 周舒雅, 左琴, 等. 利用HRM技术区分ob糖尿病小鼠不同基因型[J]. 中国细胞生物学学报, 2014, 36 (10): 1403–1408. |
| [17] | Ingalls AM, Dickie MM, Snell GD. Obese, a new mutation in the house mouse[J]. Obes Res, 1996, 4 (1): 101. DOI:10.1002/j.1550-8528.1996.tb00519.x |
| [18] | Chehab FF, Lim ME, Lu R. Correction of the sterility defect in homozygous obese female mice by treatment with the human recombinant leptin[J]. Nat Genet, 1996, 12 (3): 318–20. DOI:10.1038/ng0396-318 |
| [19] | 董英, 钱希文, 白娟, 等. 苦瓜改善胰岛素抵抗功能与作用机制研究进展[J]. 食品科学, 2013, 34 (21): 369–374. |
| [20] | 杨娣, 孟大利, 曹家庆, 等. 苦瓜皂 (甾) 苷的现代药学和降血糖作用的研究进展[J]. 中草药, 2013, 44 (24): 3582–3592. |
| [21] | 查青, 董英, 徐斌. 药食两用植物 (Ⅱ)——苦瓜的药理作用研究概况[J]. 食品研究与开发, 2005, 26 (3): 33–35. |
| [22] | 李化. 苦瓜的现代研究进展[J]. 陕西中医学院学报, 2001, 24 (11): 47–48. |
| [23] | 薛涛, 夏朝霞, 邬丽莎, 等. 人参降糖作用的研究进展[J]. 中国现代中药, 2014, 16 (5): 428–432. |
| [24] | 陈艳, 刘杨, 高晓鸽, 等. 人参水提物对小鼠血糖及血脂代谢的影响[J]. 东北师大学报 (自然科学版), 2009, 41 (4): 112–115. |
| [25] | 冯彦. 人参药理作用及临床应用研究进展[J]. 中医临床研究, 2013, 6 (6): 12H22. |
| [26] | 范莎莎, 王楠. 人参的药用研究[J]. 长春中医药大学学报, 2014, 30 (5): 825–826. |
| [27] | 袁恒杰. 丹参素药理作用研究新进展[J]. 中国医院药学杂志, 2006, 26 (5): 604–606. |
| [28] | 陆建军. 丹参的临床新用途[J]. 中国医院药学杂志, 1991, 11 (6): 40. |
| [29] | 胡静, 徐德生. 葛根素药理和临床研究进展[J]. 世界临床药物, 2006, 27 (4): 215–220. |
| [30] | 苑程鲲, 沈文娟, 吴效科, 等. 葛根素临床应用新进展[J]. 中医药信息, 2011, 28 (6): 125–127. |
 2017, Vol. 34
2017, Vol. 34