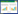文章信息
- 李姗姗, 边育红, 王丽
- LI Shan-shan, BIAN Yu-hong, WANG Li
- 基于肿瘤干细胞的西黄丸抗结肠癌作用研究
- Antitumor effect of Xihuang pills on colorectal cancer based on cancer stem cells
- 天津中医药, 2017, 34(3): 181-185
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(3): 181-185
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.03.11
-
文章历史
- 收稿日期: 2016-11-18
2. 天津市第二人民医院, 天津 300192
结肠癌的发病率在男、女性癌症患者中分别占第三位和第二位[1]。目前,手术根除术是治疗结肠癌的主要手段,癌细胞的复发和转移是手术失败的主要原因[2]。有研究表明,恶性肿瘤的复发和转移与肿瘤组织中存在肿瘤干细胞有关,肿瘤干细胞是具有高度自我更新、多向分化功能的特殊群体。它们拥有强大的DNA损伤后修复及天然耐药能力,可从传统的放化疗中逃逸,从而发生转移和浸润[3],因此肿瘤干细胞可作为治疗结肠癌的潜在靶点。中药抗肿瘤具有多靶点、低毒性、增强机体免疫力、优化患者生活质量等优点[4-7],因而得到越来越多的关注。西黄丸——清代名医王洪绪所创的抗癌名方,由牛黄、麝香、乳香及没药组成[8]。它可提高患者机体免疫力、抑制肿瘤细胞的增殖、逆转肿瘤细胞迁移微环境的形成,并显著提高临床疗效及患者生活质量,被广泛用于乳腺癌、肝癌、结肠癌、胃癌等恶性肿瘤的治疗[9-15]。然而,目前对西黄丸抗肿瘤干细胞的研究尚少,其抗肿瘤的作用机制并不明确。本实验通过小鼠结肠癌CT26细胞荷瘤Balb/C雄性小鼠,取出肿瘤,筛选培养获得肿瘤干细胞后,以西黄丸药浸液作用肿瘤干细胞以及肿瘤细胞,来研究西黄丸对结肠癌肿瘤干细胞的增殖、迁移、浸润能力以及多能干基因表达的影响。
1 实验材料及方法 1.1 实验材料小鼠结肠癌细胞系CT26,Balb/C雄性小鼠,DMEM/ham’s F12,胎牛血清(FBS),青链霉素(PS),谷氨酰胺(LG),磷酸盐缓冲液(PBS),血管内皮生长因子(EGF),碱性成纤维细胞生长因子(bFGF),0.2%肝素(Hep),0.05%胰酶(TE),胰酶抑制剂(TEI),噻唑蓝(MTT)试剂盒,二甲基亚砜(DMSO),提RNA试剂盒,反转录试剂盒,扩增试剂盒,Transwell板,基质胶(Matrigel),粘连蛋白(Fn),4%甲醛细胞固定液,吉姆萨染液,康宁细胞培养瓶,6、24、96孔板,EP管,15、50 mL离心管,1、5 mL冻存管,枪头,镊子,剪刀,200目细胞筛,玻璃器皿,倒置显微镜,读板机定量逆转录-聚合酶链反应(qRT-PCR)仪及定量检测RNA、cDNA仪等。
1.2 方法 1.2.1 细胞及细胞培养以CT26结肠癌肿瘤细胞皮下注射Balb/C雄鼠,待长出肿瘤后,直径大约1.5 cm左右,外科手术法取出肿瘤,放入含有15%~17%PS的PBS中清洗3次,再用PBS洗1遍,将肿块放入无菌的玻璃器皿中,手术刀快速切碎至泥状,转移至50 mL离心管中,加入10~15 mL预热至37 ℃的胰酶(TE),放入培养箱消化15 min,每5 min轻轻震荡1次。消化好后加入等量的胰酶抑制剂(TEI)终止消化,以800 r/min离心5 min,弃去上清液。加入10 mL DMEM/ham’s F12轻柔重悬组织及细胞,以200目细胞筛过滤得到细胞混悬液。以同样的转速离心细胞悬液,弃上清液,加入10 mL PBS轻轻吹打数次清洗细胞,清洗2~3次后计数,最终将细胞以每毫升2×105个接种至不含血清的完全培养基中。1周左右即可成球,以此方法筛选出克隆生长, 悬浮球状的肿瘤干细胞(CSCs),肿瘤干细胞接种至含血清的培养基中即分化为贴壁梭形肿瘤细胞(nCSCs),这两种细胞以用于后续实验。
1.2.2 MTT法检测西黄丸对非肿瘤干细胞及肿瘤干细胞的细胞毒作用 1.2.2.1 西黄丸药浸液的制备[16]1)称取200 mg西黄丸粉末于2 mL DMEM/ham’s F12中,充分混匀,超声助溶30 min。2)4 ℃浸泡24 h后,超声助溶1.5 h。3)置于离心机以1 000 r/min的转速离心5 min,吸取上清液,过滤,得到无菌西黄丸药浸液。
1.2.2.2 MTT实验1)对肿瘤干细胞的影响:倒置显微镜观察肿瘤干细胞,待悬浮呈致密球体,收集至离心管中,离心弃上清液,加入10 mL PBS清洗,离心弃上清液后加入1 mL TE消化40 s,加入3 mL TEI终止消化,轻轻吹打混匀,离心弃上清液,加入1 mL不含血清的完全细胞培养基,重悬。台盼蓝染色计数,制备2×104个/孔浓度的细胞悬液,加入西黄丸药浸液,制成不同终浓度含西黄丸的细胞悬液(西黄丸终浓度为0、2、4、6、8、10、12、14、16、18 mL/L),每孔100 μL接种至96孔板,培养48 h。2)对肿瘤细胞的影响:弃旧培基,PBS清洗,加入5 mL TE,显微镜观察待细胞大量脱落,加入等量TEI抑制消化,离心弃上清液,重悬细胞,以100 μL每孔5×103个细胞浓度接种96孔板,培养24 h后,弃旧培养基,加入不同浓度的含西黄丸药浸液的培养基(西黄丸终浓度为0、5、7.5、10、15、20、25、30、35、40 mL/L)。
每种浓度6个复孔,培养48 h后每孔加入10 μL MTT试剂,孵育4 h后,吸干培养基(肿瘤干细胞组先离心),每孔加入100 μL DMSO,震荡1 min,570 nm波长检测吸光度A。成活率=A加药组/A空白组×100%。
1.2.3 Transwell法检测西黄丸对肿瘤干细胞迁移及浸润能力的影响对浸润能力的影响:用预冷的细胞培养基DMEM/ham’s F12以1:8稀释matrigel胶,加100 μL稀释胶铺于transwell小室底面(冰上操作),37 ℃孵育4 h后,用DMEM/ham’s F12清洗凝胶。迁移实验不用铺胶,对照组上室加100 μL 3×104个的肿瘤干细胞悬液,实验组上室加含1.2 μL(浓度为12 mL/L)西黄丸药浸液的等量肿瘤干细胞悬液,下室均加入600 μL含20%血清、5 mg/L Fn的完全培养基,孵育48 h。而后对其淋洗,擦去上室内表面的细胞,固定,清洗,风干后Giemsa染色20 min,蒸馏水冲洗,400倍镜下观察计数并拍照。
1.2.4 qRT-PCR检测多能干基因sox2、oct4和nanog的表达根据MTT实验结果,明确肿瘤干细胞IC50西黄丸浓度,以该浓度作用细胞48 h后,用Bio-tek Omega E.Z.N.A. total RNA kit提取总RNA,检测其纯度及含量,逆转录为cDNA后,以Gapdh为内参基因对其扩增。引物序列分别为:Gapdh上游5’-AACTTTGGCATTGTGGAAGG-3’, 下游5’-CACATTGGGGGTAGGAACAC-3’;Sox2上游5’-AAAGGGTTCTTGCTGGGTTT-3’下游5’-AGACCACGAAAACGGTCTTG-3’;Oct4上游5’-AGAGGATCACCTTGGGGTACA-3’, 下游5’-CGAAGCGACAGATGGTGGTC-3’;Nanog上游5’AAGCAGAAGATGCGGACTGT-3’下游5’-GTGCTGAGCCCTTCTGAATC-3’。其扩增条件为:95 ℃预变性10 min,95 ℃变性10 s,58 ℃退火10 s而后72 ℃延伸20 s,共40个循环。而后对引物溶解曲线进行分析,条件为72~95 ℃,每10 s升0.5 ℃,再降至25 ℃冷却30 s。
1.3 数据处理应用SPSS 22.0统计软件进行数据处理,侵袭迁移数据均以均数±标准差(x±s)表示,组间比较采用两独立样本t检验,P<0.05表示差异有统计学意义。
2 结果 2.1 西黄丸能抑制肿瘤干细胞及肿瘤细胞的增殖,其中对肿瘤干细胞的抑制作用更强通过MTT实验检测西黄丸对肿瘤干细胞及肿瘤细胞的直接细胞毒作用,结果见图 1。对于肿瘤细胞,西黄丸的IC50为25 mg/L,而对于肿瘤干细胞,西黄丸IC50仅为12 mg/L。由此可见,西黄丸对肿瘤干细胞增殖的抑制作用更强。
|
| 图 1 西黄丸对肿瘤细胞和肿瘤干细胞的直接细胞毒作用 Fig. 1 Cell viability of Xihuang pills on nCSCs and CSCs A:西黄丸对非肿瘤干细胞的直接细胞毒作用;B:西黄丸对肿瘤干细胞的直接细胞毒作用,“*”代表IC50西黄丸的浓度。 |
用transwell法检测西黄丸对肿瘤干细胞迁移及浸润能力的影响,结果见表 1。迁移实验:空白组细胞数为(236±9)个,西黄丸组细胞数为(205±19)个(P < 0.05);浸润实验空白组细胞数为(245±20)个,西黄丸组细胞数目为(213±17)个(P < 0.05),差异有统计学意义。即西黄丸能有效抑制肿瘤干细胞的迁移和浸润。
| 个 | |||||||
| 组别 | 实验 | 视野 | 细胞数 (x±s) |
||||
| 1 | 2 | 3 | 4 | 5 | |||
| 空白组 | 迁移实验 | 233 | 248 | 232 | 226 | 242 | 236±09 |
| 浸润实验 | 261 | 253 | 236 | 260 | 214 | 245±20 | |
| 西黄丸组 | 迁移实验 | 218 | 221 | 211 | 199 | 174 | 205±19* |
| 浸润实验 | 207 | 217 | 187 | 224 | 229 | 213±17* | |
| 注:与空白组比较,*P < 0.05。 | |||||||
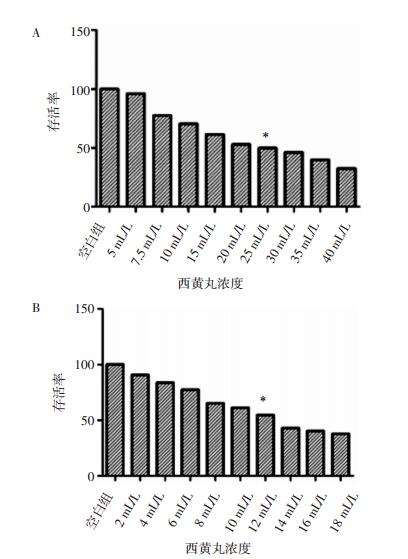
用qRT-PCR法检测空白组和西黄丸组肿瘤干细胞多能干基因Sox2、Oct4及Nanog的mRNA表达水平。结果及溶解曲线图见图 2、图 3。两组细胞多能干基因表达水平比较差异有统计学意义。即西黄丸可显著降低肿瘤干细胞多能干基因Sox2、Oct4及Nanog的表达。
|
| 图 2 西黄丸对肿瘤干细胞Sox2、Oct4及Nanog表达水平的影响 Fig. 2 Effect of Xihuang pills on CSCs Sox2, Oct4 and Nanog expression *P<0.05,**P<0.001。 |
|
| 图 3 多能干基因溶解曲线图 Fig. 3 Melt curve of CSCs pluripotent genes A.Gapdh,B.Sox2,C.Nanog,D.Oct4。溶解曲线为单峰,扩增产物为特异目的基因。 |
肿瘤干细胞的特性如:处在G0期、天然耐药能力、强大的DNA修复能力、干性无限增殖等使其可免受传统放化疗的伤害。它可转移到远端器官和组织,并增殖形成新的肿瘤[17-18],因而肿瘤干细胞被认为是临床外科手术、放化疗等治疗失败的潜在原因[19]。目前,临床上大多数化疗药物治疗靶点是处于S、M、G2期的细胞[17],但肿瘤干细胞处于静止期,故化疗药物对肿瘤干细胞影响较小,还有研究表明临床上经放化疗后反而刺激肿瘤干细胞的增殖[20]。实验一通过MTT细胞毒性实验证实西黄丸对肿瘤细胞及肿瘤干细胞的增殖均具有抑制作用,可喜的是西黄丸对肿瘤干细胞的IC50为12 mL/L, 远远低于肿瘤细胞的IC50(25 mL/L),这就说明肿瘤干细胞对西黄丸比肿瘤细胞更为敏感,较低浓度的西黄丸作用于细胞后,对肿瘤干细胞的增殖抑制作用更强。该实验结果表明西黄丸对肿瘤干细胞有较好的选择性抑制作用,这可能是西黄丸抗结肠癌作用的原因之一。
转移是恶性肿瘤细胞经淋巴系统、血循环、体腔等途径到达远端器官或组织并形成相同性质的肿瘤,其过程多变复杂,浸润并突破基底膜是转移的早期事件[21]。转移作为恶性肿瘤的重要特征,也是临床治疗失败的重要原因。肿瘤干细胞能抵抗临床常规的治疗,是肿瘤转移复发的潜在原因。Kantara C等[22]最新研究表明结肠癌患者循环系统中的肿瘤干细胞能准确的预测患者复发转移的风险,检测到肿瘤干细胞的患者除了常规抗癌治疗之外通过额外给予靶向肿瘤干细胞的治疗来提高患者预后。因而很有必要探讨西黄丸对肿瘤干细胞浸润迁移能力的影响。本研究通过Transwell迁移浸润实验证明了西黄丸能够抑制肿瘤干细胞的迁移和浸润,这可能是西黄丸抗结肠癌,提高患者生存质量的的又一原因,但其机制尚不明确。
肿瘤干细胞的特性源于其“干性”,干细胞相关基因Sox2、Oct4及Nanog的表达与肿瘤干细胞的自我增殖并形成异质性肿瘤组织密切相关[23]。其中Oct4作为胚胎特有干性基因,起主导作用。Sox2是Sox家族的一个成员,它与肿瘤的恶性程度呈正相关;并与Nanog协同共同影响肿瘤细胞的迁移浸润,最终导致肿瘤复发和远端转移[24]。由此,研究西黄丸对其多能干基因表达的影响就尤为重要,qRT-PCR实验结果表明肿瘤干细胞表达多能干基因Sox2、Oct4及Nanog,西黄丸作用后,这3种转录因子的表达明显下降,下降最明显的是Sox2;从基因水平上明确了西黄丸能下调肿瘤干细胞多能干基因的表达从而发挥抗肿瘤作用。随着肿瘤干细胞学说研究的深入,肿瘤干细胞在肿瘤产生、复发、转移中的作用也渐渐得到更多的认识,本实验中西黄丸对肿瘤干细胞的抑制可能是该药发挥抗癌作用的关键,但是抗癌机制仍需进一步研究。
| [1] | Baena R, Salinas P. Diet and colorectal cancer[J]. Maturitas, 2015, 80 (3): 258–264. DOI:10.1016/j.maturitas.2014.12.017 |
| [2] | 孙莉娜, 孟静岩, 王威, 等. 犀黄丸对大肠癌LoVo细胞基质金属蛋白酶2_9蛋白表达的影响[J]. 天津中医药, 2012, 29 (4): 378–380. |
| [3] | 李姗姗, 王丽, 边育红. 基于肿瘤干细胞的恶性肿瘤靶向治疗策略[J]. 中国细胞生物学学报, 2015, 37 (2): 309–314. |
| [4] | Guo Q, Li J, Lin H. Effect and MolecuLar Mechanisms of Traditional Chinese Medicine on ReguLating Tumor Immunosuppressive Microenvironment[J]. Biomed Res Int, 2015 : 261620. |
| [5] | 张秀云, 周凤琴. 中药抗肿瘤研究进展[J]. 辽宁中医药大学学报, 2012, 14 (11): 144–146. |
| [6] | 樊庆利. 中药抗肿瘤作用及有效成分论述[J]. 中国医学工程, 2015, 14 (8): 161–162. |
| [7] | 宁倪, 耿耘. 近五年中药抗肿瘤机制的研究进展[J]. 现代中药研究与实践, 2016, 30 (50): 88–90. |
| [8] | 朱晓静, 李峰, 欧阳兵. 西黄丸抗肿瘤作用研究进展[J]. 山东中医药大学学报, 2012, 36 (1): 83–85. |
| [9] | 杨伟, 关硕, 胡俊霞, 等. 西黄丸对荷瘤大鼠的抗肿瘤及其对炎性因子的调节作用[J]. 现代药物与临床, 2013, 28 (6): 847–850. |
| [10] | 王一尧, 任征远, 焦战, 等. 西黄丸对肿瘤迁移微环境的影响[J]. 中药药理与临床, 2014, 30 (4): 11–13. |
| [11] | 刘博, 于硕, 邢莉, 等. 西黄丸联合介入化疗治疗中晚期原发性肝癌80例疗效分析[J]. 中华中医药杂志, 2010, 25 (6): 947–948. |
| [12] | 陈筱婷, 葛鑫宇, 刘彬, 等. 西黄丸含药血清对人结直肠癌细胞SW480凋亡及Bcl-2、Bax蛋白表达的影响[J]. 中华中医药杂志, 2015, 30 (2): 507–509. |
| [13] | 郭杨志, 冯兴中, 杜娟. 西黄丸联合化疗治疗恶性肿瘤疗效的Meta分析[J]. 中医杂志, 2015, 61 (11): 39–42. |
| [14] | 钱娜, 金沈锐, 陈姗姗. 西黄丸抗肿瘤作用的研究概况[J]. 云南中医中药杂志, 2016, 37 (9): 96–97. |
| [15] | 李德辉, 范焕芳, 孙春霞. 西黄丸在乳腺癌中的应用研究进展[J]. 时珍国医药, 2016, 27 (9): 205–206. |
| [16] | 金沈锐, 祝彼得, 秦旭华, 等. 西黄丸对人肝癌细胞SMMC7721及小鼠宫颈癌细胞U14周期的影响[J]. 时珍国医国药, 2007, 18 (11): 2782–2783. |
| [17] | 欧阳君, 吴振杰, 张森. 肿瘤干细胞与结直肠癌的转移和复发[J]. 中华普外科手术学杂志, 2011, 5 (4): 449–454. |
| [18] | 吴昊. 奥沙利铂辅助化疗方案治疗晚期结肠癌的疗效观察[J]. 临床合理用药杂志, 2017, 10 (1): 80–81. |
| [19] | Kim H. Clinical implication of colorectal cancer stem cells:still has a long way to go[J]. Ann Coloproctol, 2015, 31 (3): 79–80. DOI:10.3393/ac.2015.31.3.79 |
| [20] | Dylla SJ, Beviglia L, Park IK, et al. Colorectal cancer stem cells are enriched in xenogeneic tumors following chemotherapy[J]. PLoS One, 2008, 3 (6): e2428. DOI:10.1371/journal.pone.0002428 |
| [21] | 王杰军, 应明真. 恶性肿瘤的转移机制与治疗策略[J]. 中国肿瘤生物治疗杂志, 2008, 15 (4): 305–310. |
| [22] | Kantara C, O'Connell MR, Luthra G, et al. Methods for detecting circuLating cancer stem cells (CCSCs) as a novel approach for diagnosis of colon cancer relapse/metastasis[J]. Lab Invest, 2015, 95 (1): 100–112. DOI:10.1038/labinvest.2014.133 |
| [23] | Kim RJ, Nam JS. OCT4 Expression enhances features of cancer stem cells in a mouse model of breast cancer[J]. Lab Anim Res, 2011, 27 (2): 147–152. DOI:10.5625/lar.2011.27.2.147 |
| [24] | Sun D, Qin L, Xu Y, et al. Influence of adriamycin on changes in Nanog, Oct-4, Sox2, ARID1 and Wnt5b expression in liver cancer stem cells[J]. World J Gastroenterol, 2014, 20 (22): 6974–6980. DOI:10.3748/wjg.v20.i22.6974 |
2. The Second People's Hospital, Tianjin 300192, China
 2017, Vol. 34
2017, Vol. 34