文章信息
- 王世伟, 徐宁
- WANG Shi-wei, XU Ning
- 山茱萸环烯醚萜总苷对小鼠胰岛素抵抗和非酒精性肝损伤的改善作用及其机制研究
- Study on effect and mechanism of iridoid glycoside from cornus officinalis on mice with nonalcoholic liver injury and insulin resistance
- 天津中医药, 2017, 34(3): 195-199
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(3): 195-199
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.03.14
-
文章历史
- 收稿日期: 2016-11-25
糖尿病是一种常见慢性疾病,2型糖尿病是一种重要的糖尿病发病类型。胰岛素抵抗是2型糖尿病的重要特征和致病原因,与肥胖密切相关。肥胖导致体内慢性、低水平炎症发生,促炎因子通过干扰胰岛素信号传导而引起胰岛素抵抗的发生。山茱萸环烯醚萜总苷(ICO)是山茱萸经提取分离纯化后得到的环烯醚萜苷部位,主要包括马钱苷、莫诺苷、獐牙菜苷等[1],有研究表明其可以防治糖尿病肾病、糖尿病视网膜病变[2-3]、保护糖尿病大鼠主动脉内皮[4],因此推测其对糖尿病胰岛素抵抗和肝损伤也有一定防治作用。本研究观察了山茱萸环烯醚萜总苷对糖尿病大鼠胰岛素抵抗和肝损伤的改善效果,并对其作用机制进行了初步研究。
1 实验材料材料:ICO[实验室自制,经高效液相色谱(HPLC)测定分析总苷纯度达到67.4%];小白鼠(昆明种):由天津中医药大学医学动物实验中心提供;高脂饲料(上海普迈生物科技有限公司);RIPA裂解液(Thermo有限公司);血清中谷丙转氨酶(ALT)、谷草转氨酶(AST)、血清总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、胰岛素和肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)、白细胞介素1β(IL-1β)试剂盒(南京建成生物工程研究所);兔抗鼠的一抗、羊抗兔二抗(p-P65、p-ERK1/2、p-JNK1/2、p-P38,深执联科生物技术有限公司),其余试剂均为市售分析纯。
仪器:GLUCOTREND2血糖检测仪(罗氏诊断有限公司);DYCZ-24DN电泳仪(上海达平仪器有限公司);1600R数码凝胶成像分析系统(上海天能科技有限公司)。
2 实验方法 2.1 ICO制备取山茱萸药材500 g,按料液比1:12(m/v)回流提取2次,每次60 min,滤纸过滤,滤液采用70%乙醇醇沉,隔夜过滤。滤液加水定容至1 L,采用HPD-100大孔吸附树脂,用8 L 50%乙醇3.0 BV/h洗脱,浓缩、干燥后得到ICO。
2.2 分组和给药选择6~8周的雄性小鼠,适应性饲养1周后分成正常组和模型组。正常组大鼠给予普通饲料,模型组大鼠喂以高脂饲料,自由饮食和饮水。14周后进行葡萄糖耐量实验,0 h和2 h血糖值分别大于7.0 mmol/L和11.1 mmol/L为入选标准。将25只造模成功的小鼠按照随机区法随机分为A、B、C、D、E组。A、B、C、D、E组按照随机数字表进行分配,分配为模型组、ICO低剂量组(50 mg/kg)、ICO中剂量组(100 mg/kg)、ICO高剂量组(150 mg/kg)和吡格列酮对照组(10 mg片重/kg)。模型组继续喂以高脂饲料,ICO低、中、高剂量组分别每天日入ICO和高脂饲料,吡格列酮对照组每日摄入吡格列酮和高脂饲料,正常组给予普通饲料,饲养3周。
2.3 胰岛素耐量实验和葡萄糖耐量实验18周后,小鼠禁食4 h,腹腔注射速效胰岛素制剂0.8 U/kg体质量,分别于注射前和注射后30、90、120 min尾静脉采血测定血糖浓度。禁食12 h后,灌胃1.1 g/kg体质量葡萄糖溶液,分别在灌胃后0、15、30、60、90、120 min测定血糖浓度[5]。
2.4 肝功能及血脂测定常规分离血清,试剂盒法测定小鼠血清中ALT、AST、TC、TG、LDL、HDL、胰岛素和炎性因子TNF-α、IL-6、IL-1β水平。
2.5 蛋白免疫印迹法(Western Blot)检测p-P65、p-ERK1/2、p-JNK1/2、p-P38蛋白采用数码成像分析系统分析Western Blot区带[6-7]。
2.6 数据分析采用SPSS19.0统计软件对实验数据进行处理,数据以均数±标准差(x±s)表示,组间差异比较采用分析单因素方差,糖耐量和胰岛素耐量实验结果差异显著性分析采用重复测量方差分析方法,P<0.05表示差异具有统计学意义。
3 实验结果 3.1 ICO对小鼠脂肪指数和血脂水平的影响模型组小鼠脂肪指数(附睾脂肪质量/体质量)、TC、TG、LDL和HDL与正常组小鼠相比差异具有统计学意义(P<0.01),灌胃50 mg/kg ICO后,小鼠脂肪指数明显下降,灌胃100 mg/kg ICO后,小鼠脂肪指数、TC和HDL水平分别下降29.63%、29.69%和17.57%,TG和LDL水平分别下降17.09%和12.74%;灌胃150 mg/kg ICO后,脂肪指数、TC、TG、LDL和HDL依次下降48.15%、42.19、33.54%、35.19%和32.43%,其中TC、TG和HDL水平与吡格列酮对照组差异无统计学意义(P>0.05),表明ICO有利于改善小鼠肥胖状态和血脂水平。见表 1。
| 组别 | 动物数 | 脂肪指数(%) | TC(mmol/L) | TG(mmol/L) | LDL(mmol/L) | HDL(mmol/L) |
| 正常组 | 5 | 1.8±0.19 | 3.2±0.34 | 0.72±0.06 | 0.82±0.08 | 3.21±0.35 |
| 模型组 | 5 | 5.4±0.60** | 6.4±0.68** | 1.58±0.13** | 1.62±0.16** | 5.52±0.54** |
| ICO低剂量组 | 5 | 4.7±0.48#△△ | 5.8±0.62△△ | 1.42±0.15△△ | 1.50±0.13△△ | 5.17±0.43△△ |
| ICO中剂量组 | 5 | 3.8±0.42##△△ | 4.5±0.51##△ | 1.31±0.14#△ | 1.37±0.11#△△ | 4.55±0.36##△ |
| ICO高剂量组 | 5 | 2.8±0.35##△ | 3.7±0.44## | 1.05±0.09## | 1.05±0.09### | 3.73±0.42## |
| 吡格列酮对照组 | 5 | 2.4±0.30## | 3.5±0.31## | 0.92±0.08## | 0.93±0.08## | 3.56±0.37## |
| 注:与正常组比较,**P < 0.01;与模型组比较,#P < 0.05,##P < 0.01;与吡格列酮对照组比较,△P < 0.05,△△P < 0.01。 | ||||||
模型组小鼠ALT和AST活性与正常组小鼠相比分别上升36.83%和39.20%,差异具有统计学意义(P<0.01)。灌胃50 mg/kg ICO后,ALT和AST活性与模型组小鼠相比分别下降7.82%和10.47%;灌胃100 mg/kg ICO后分别下降18.70%和17.92%;灌胃150 mg/kg ICO后分别下降31.87%和23.85%,AST水平与吡格列酮对照组差异无统计学意义(P>0.05),表明ICO可以有效改善糖尿病小鼠肝损伤。见表 2。
| (U/L) | |||
| 组别 | 动物数 | ALT | AST |
| 正常组 | 5 | 33.1±3.2 | 92.3±6.2 |
| 模型组 | 5 | 52.4±3.8** | 151.8±11.3** |
| ICO低剂量组 | 5 | 48.3±3.5#△△ | 135.9±12.2#△△ |
| ICO中剂量组 | 5 | 42.6±3.1#△△ | 124.6±9.9##△ |
| ICO高剂量组 | 5 | 35.7±2.5##△△ | 115.6±8.7## |
| 吡格列酮对照组 | 5 | 34.3±2.4##△△ | 107.8±8.2## |
| 注:与正常组比较,**P < 0.01;与模型组比较,#P < 0.05,##P < 0.01;与吡格列酮对照组比较,△P < 0.05,△△P < 0.01。 | |||
各组小鼠血糖值均在糖负荷30 min时最高,30 min后呈下降趋势;ICO高、中剂量组血糖值在各时段显著低于模型组(P<0.01);高剂量组血糖值在0 min和30 min时与吡格列酮对照组比较差异有统计学意义(P<0.05),在60 min和120 min时没有统计学差异(P>0.05),说明ICO能降低小鼠的血糖水平,改善小鼠糖耐量,并且150 mg/kg效果优于50 mg/kg和100 mg/kg。见表 3。
| mmol/L | |||||
| 组别 | 动物数 | 0 min | 30 min | 60 min | 120 min |
| 正常组 | 5 | 6.46±0.79 | 13.59±3.57 | 10.49±2.28 | 7.52±1.12 |
| 模型组 | 5 | 24.02±6.13** | 33.76±4.46** | 30.46±4.22** | 28.63±2.97** |
| ICO低剂量组 | 5 | 23.67±4.38△△ | 31.07±5.36△△ | 27.93±4.59△△ | 26.49±5.96△△ |
| ICO中剂量组 | 5 | 17.12±3.19##△△ | 26.18±5.13##△△ | 23.86±3.37##△△ | 22.73±4.17##△△ |
| ICO高剂量组 | 5 | 16.89±4.37##△ | 24.00±5.67##△ | 21.84±3.13## | 20.54±2.99## |
| 吡格列酮对照组 | 5 | 12.12±3.02## | 19.66±3.70## | 18.07±4.42## | 17.28±4.14## |
| 注:与正常组比较,**P < 0.01;与模型组比较,##P < 0.01;与吡格列酮对照组比较,△P < 0.05,△△P < 0.01。 | |||||
注射胰岛素后小鼠血糖在一定时间内呈下降趋势,模型组血糖在30 min时达到最低点,在60 min时开始回升,90 min后快速回升,其余组小鼠血糖在60~90 min时达到最低点,90 min后均有所增加。注射胰岛素15 min后,高剂量组血糖值较基础值降低21.95%,而低剂量组仅降低0.55%。3个剂量组在90 min时均降低至最低值,分别降低18.04%、24.05%和53.85%,120 min时血糖回升,但血糖值仍低于模型组,且ICO中、高剂量组与吡格列酮对照组差异无统计学意义(P>0.05),说明ICO可明显增加小鼠对葡萄糖的利用能力,改善糖尿病小鼠胰岛素抵抗。见表 4。
| mmol/L | |||||||
| 组别 | 动物数 | 0 min | 15 min | 30 min | 60 min | 90 min | 120 min |
| 正常组 | 5 | 6.48±1.77 | 4.22±1.22 | 2.73±0.62 | 1.86±0.67 | 2.66±0.83 | 2.87±0.871 |
| 模型组 | 5 | 23.26±2.28** | 22.07±3.42** | 20.42±3.37** | 21.24±4.11** | 22.02±2.69** | 26.57±5.04** |
| ICO低剂量组 | 5 | 19.85±3.24# | 19.74±2.76 | 19.21±4.21 | 18.18±3.43 | 16.27±2.29# | 19.66±3.87#△ |
| ICO中剂量组 | 5 | 20.46±3.46# | 20.93±2.69 | 19.23±2.27 | 16.91±3.22# | 15.54±1.29## | 16.72±3.43## |
| ICO高剂量组 | 5 | 18.68±4.22# | 14.58±3.03## | 12.83±1.87## | 9.79±2.51##△ | 8.62±2.13##△△ | 14.67±1.67## |
| 吡格列酮对照组 | 5 | 18.42±3.14# | 16.83±4.41# | 16.11±3.42# | 14.81±4.26## | 15.02±3.07## | 14.87±4.76## |
| 注:与正常组比较,**P < 0.01;与模型组比较,#P < 0.05,##P < 0.01;与吡格列酮对照组比较,#P < 0.05,△△P < 0.01。 | |||||||
中、高剂量ICO可以显著降低模型小鼠空腹胰岛素水平,分别下降15.38%和44.23%,但与吡格列酮相比差异具有统计学意义(P<0.01,P<0.05)。见表 5。
| ng/mL | ||
| 组别 | 动物数 | 胰岛素 |
| 正常组 | 5 | 1.8±0.21 |
| 模型组 | 5 | 5.2±0.63** |
| ICO低剂量组 | 5 | 4.6±0.51△△ |
| ICO中剂量组 | 5 | 4.4±0.43#△△ |
| ICO高剂量组 | 5 | 2.9±0.26##△ |
| 吡格列酮对照组 | 5 | 2.4±0.31## |
| 注:与正常组比较,**P < 0.01;与模型组比较,#P < 0.05,##P < 0.01;与吡格列酮对照组比较,△P < 0.05,△△P < 0.01。 | ||
模型组小鼠血清中Il-1β、TNF-α和IL-6水平与正常组小鼠相比差异均具有统计学意义(P<0.01)。灌胃ICO后各组小鼠炎性因子水平均成下降趋势。低剂量组小鼠IL-6水平下降21.34%,Il-1β和TNF-α水平变化无统计学意义(P>0.05);灌胃100 mg/kg ICO后,三者水平分别下降24.06%、22.44%和29.67%;灌胃150 mg/kg ICO后,三者水平分别下降33.68%、40.08%和42.89%,但与吡格列酮对照组比较水平差异均具有统计学意义(P<0.05,P<0.05,P<0.01)。见表 6。
| pg/mL | ||||
| 组别 | 动物数 | Il-1β | TNF-α | IL-6 |
| 正常组 | 5 | 12.5±1.12 | 21.2±1.77 | 7.3±0.68 |
| 模型组 | 5 | 95.6±8.47** | 104.3±8.64** | 49.2±3.97** |
| ICO低剂量组 | 5 | 82.4±6.54△△ | 92.8±8.67△△ | 38.7±4.16##△△ |
| ICO中剂量组 | 5 | 72.6±6.11##△△ | 80.9±7.22#△△ | 34.6±3.14##△△ |
| ICO高剂量组 | 5 | 63.4±5.36##△ | 62.5±5.47##△ | 28.1±3.01##△△ |
| 吡格列酮对照组 | 5 | 51.6±4.37## | 43.2±3.15## | 14.2±1.02## |
| 注:与正常组比较,**P < 0.01;与模型组比较,##P < 0.01;与吡格列酮组比较,△P < 0.05,△△P < 0.01。 | ||||
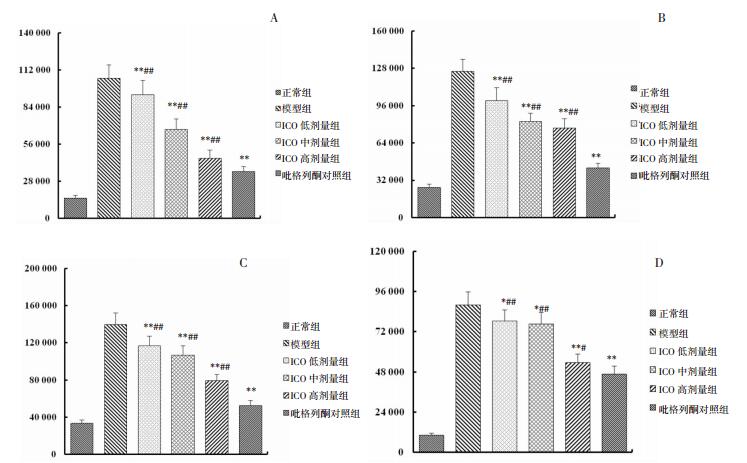
ICO对小鼠4种蛋白表达水平的影响如图 1和图 2所示,Westenblot结果表明,高脂饲料喂养14周后,小鼠4种蛋白表达水平表达量显著升高,ICO喂养3周后,各组小鼠4种蛋白表达水平均呈下降趋势,低剂量组小鼠p-ERK1/2、p-JNK1/2、p-P38蛋白表达水分别下降19.79%、16.36%和10.71%,中剂量组小鼠4种蛋白表达水平依次下降36.45%、34.22%、23.51%和12.81%,高剂量组小鼠4种蛋白表达水平依次下降56.94%、38.60%、43.04%和39.11%,表明ICO可以降低p-P65、p-ERK1/2、p-JNK1/2、p-P38蛋白表达水平,但高剂量组水平与吡格列酮组差异仍具有统计学意义(P<0.01或P<0.05)。

|
| 图 1 ICO对小鼠肝组织p-P65、p-ERK1/2、p-JNK1/2、p-P38蛋白表达水平的影响 Fig. 1 Expression level of p-P65, p-ERK1/2, p-JNK1/2、p-P38 in live of mice A:p-P65蛋白;B:p-ERK1/2蛋白;C:p-JNK1/2蛋白;D:p-P38蛋白;1:正常组;2:模型组3:ICO低剂量组;4:ICO中剂量组;5:ICO高剂量组6:吡格列酮对照组。 |
|
| 图 2 小鼠p-P65蛋白、p-ERK1/2蛋白、p-JNK1/2蛋白、p-P38蛋白相对表达量 Fig. 2 Relative expression level of p-P65, p-ERK1/2, p-JNK1/2, p-P38 in liver of mice A:p-P65蛋白;B:p-ERK1/2蛋白;C:p-JNK1/2蛋白;D:p-P38蛋白;与模型组比较,*P<0.05,**P<0.01;与吡格列酮对照组比较,﹟P<0.05,##P<0.01。 |
机体炎症反应信号转导通路复杂,其中转录因子NF-κB通路和有丝分裂原蛋白激酶(MAPKs)通路与炎症发生密切相关,两者相互联系,共同发挥炎症传导作用[8]。NF-κB是一个家族核转录因子,P65是其重要构成部分,被激活后结合于启动基因位点启动下游基因转录和表达,由此促进炎性因子的合成[9-11]。MAPKs是信号由细胞核外传导至核内的重要介质,可以直接或间接调节炎症的发生,包括ERKs、JNKs和P38MAPK[12]。ERK1/2为脯氨酸导向的丝氨酸/苏氨酸激酶,是ERKs的重要组成部分,受到刺激后发生逐级磷酸化而活化,调节部分转录因子的活性和蛋白的表达。JNK是一类丝氨酸/苏氨酸激酶,重要构成部分为JNK1/2,有研究表明通过下调TNFα介导的“TNFα-TAK1-JNK”炎症信号通路可以改善肥胖2型糖尿病肝脏的胰岛素抵抗[13]。P38MAPK是一种表达于巨噬细胞和淋巴细胞中的酪氨酸磷酸化蛋白激酶,有研究表明通过下调肾组织P38MAPK信号通路中p-P38MAPK蛋白表达水平,抑制炎症信号通路活性,可以改善肾组织炎症性损伤,表明在炎症反应中P38MAPK发挥重要作用[14]。
本研究通过选取p-P65、p-ERK1/2、p-JNK1/2、p-P38蛋白作为ICO抗炎机制中NF-κB和MAPKs信号通路的研究对象可知:模型组与正常组比较,4种蛋白表达水平虽著增高,但采用ICO干预后均呈下降趋势。通过分析ICO主要成分马钱苷、莫诺苷、獐牙菜苷的分子结构可知,3种化合物均含有有数个供电子基团-羟基,羟基通过释放氢原子并与自由基结合,阻断活性氧介导的链式反应,降低机体氧化应激水平。因此推测ICO中主要成分马钱苷、莫诺苷、獐牙菜苷通过降低机体氧化应激水平,使得P65、ERK1/2、JNK1/2和P38蛋白避免受到氧化应激刺激而磷酸化活化,进一步抑制NF-κB和MAPKs炎症信号通路激活,从而抑制炎症反应发生来改善胰岛素抵抗和肝损伤。
综上所述,ICO可改善胰岛素抵抗和肝损伤,提升其对葡萄糖的利用能力,有效调节血脂紊乱,且对正常小鼠的肝功能和胰岛素水平无显著影响,适宜广泛应用于药品、食品行业。
| [1] | 吕兴, 许慧琴, 刘斌, 等. 莫诺苷对晚期糖基化终末产物加重链脲佐菌素诱导糖尿病肾病保护作用及其机制[J]. 中草药, 2014, 45 (21): 3109–3116. |
| [2] | 姜泽群, 李育, 江励华, 等. 制山茱萸活性部位对D-半乳糖致小鼠肝损伤的保护作用[J]. 中药材, 2013, 36 (1): 85–89. |
| [3] | 宋尚华. 山茱萸活性成分提取分离及其治疗糖尿病并发症研究[D]. 重庆: 西南大学, 2013. |
| [4] | Zhao M, Qian DW, Shang EX, et al. Comparative pharmacokinetics of the main compounds of Shanzhuyu extract after oral administration in normal and chronic kidney disease rats[J]. Journal of Ethnopharmacology, 2015, 173 (15): 280–286. |
| [5] | 戴冰, 李兴丰, 肖子曾, 等. 六味地黄丸4种入血成分组合对大鼠前脂肪细胞增殖、分化影响的最佳浓度配伍研究[J]. 中药材, 2013, 33 (12): 1904–1908. |
| [6] | 赵文望, 皮文霞, 蔡宝昌, 等. 马钱苷、莫诺苷对高糖致心肌细胞损伤的保护机制研究[J]. 中成药, 2013, 38 (1): 160–163. |
| [7] | 朱砂, 梁晋如, 何姣, 等. HPLC法同时测定不同产地及不同采收时间山茱萸中3个环烯醚萜苷的含量[J]. 药物分析杂志, 2012, 32 (7): 1235–1242. |
| [8] | 文静, 张德芹, 夏佳楠, 等. 桑叶提取物对MSG肥胖大鼠胰岛素抵抗的影响[J]. 天津中医药, 2015, 32 (4): 234–237. |
| [9] | 刘率男, 刘泉, 孙素娟, 等. 二甲双胍对2型糖尿病KKAy小鼠胰岛β细胞功能的影响及初步作用机制探讨[J]. 药学学报, 2016, 46 (11): 1554–1562. |
| [10] | 杜娟, 张德芹, 文静, 等. 升清降浊方对MSG肥胖大鼠胰岛素增敏作用的影响[J]. 天津中医药, 2015, 35 (1): 27–30. |
| [11] | 王子超, 赵丽娟. 姜黄素对NAFLD大鼠肝组织PPAR-γ和NF-κB p65 mRNA及蛋白表达的影响[J]. 中国医科大学学报, 2016, 45 (2): 120–126. |
| [12] | 郑凝, 魏世津. 金芪降糖片对糖尿病大鼠肾脏保护作用的实验研究[J]. 天津中医药, 2014, 31 (4): 1226–1229. |
| [13] | 何天博. DHA抑制2型糖尿病大鼠肝脏炎症改善胰岛素抵抗的机制研究[D]. 石家庄: 河北医科大学, 2013. |
| [14] | 黄燕如, 万毅刚, 孙伟, 等. 雷公藤多苷调节p38MAPK信号通路改善糖尿病肾病肾小球炎症性损伤的机制[J]. 中国中药杂志, 2014, 39 (21): 4102–4107. |
 2017, Vol. 34
2017, Vol. 34