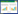文章信息
- 焦婵媛, 景春晖, 员小婷, 苗琳
- JIAO Chan-yuan, JING Chun-hui, YUAN Xiao-ting, MIAO Lin
- 表儿茶素及其衍生物表儿茶素没食子酸酯通过MAPK-ERK44/42通路抑制前列腺间质细胞增殖
- Epicatechin and its derivate Epicatechin gallate inhibit prostatic stromal cell proliferation through selective MAPK-ERK44/42 pathway
- 天津中医药, 2017, 34(3): 200-203
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(3): 200-203
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.03.15
-
文章历史
- 收稿日期: 2016-11-15
良性前列腺增生症(BPH)是老年男性泌尿外科常见疾病,近年来随着人口老龄化程度不断加剧,BPH成为影响老年男性生活质量的常见因素[1]。增生的前列腺细胞增殖加剧导致前列腺体积明显增大,给患者带来尿频、尿不尽或尿失禁等排尿障碍[2],严重者引起肾积水、肾衰竭[3]。组织学上,前列腺由前列腺上皮细胞和间质细胞构成,临床上前列腺增生多以间质增生为主,因此抑制前列腺间质细胞的增殖成为抗前列腺增生直接且有效的治疗方法[4]。
锁阳是补肾助阳的传统中药,广泛用于治疗腰膝酸软、精血亏虚、阳痿、滑精、肠燥便秘等疾病。在抗前列腺增生的治疗中,锁阳是多种中成药复方中的常见药物之一[5-6],临床使用疗效良好,但其抑制BPH的机制尚不十分清楚。表儿茶素(EC)及其衍生物表儿茶素没食子酸酯(ECG)是其两种重要药用成分,结构上均属黄烷醇类(见图 1)。笔者选择前列腺间质细胞WPMY-1为模型,研究ECG和EPI对其增殖的影响,并进一步分析其作用机制。
|
| 图 1 表儿茶素和表儿茶素没食子酸酯的结构式 Fig. 1 Epicatechin and Epicatechin gallate structure A.表儿茶素结构式;B.表儿茶素没食子酸酯结构式 |
前列腺间质细胞WPMY-1(ATCC),锁阳单体表儿茶素没食子酸酯ECG和表儿茶素EC(一方科技),C6-Ceramide(Santa cruz),Anisomycin(Cell signal),胰蛋白酶(Gibicol),DMEM培养基(KC cell),胎牛血清(Hyclone),噻唑蓝(MTT,索莱宝),二甲基亚砜(DMSO,康科德),反转录试剂盒(Promage),逆转录-聚合酶链反应(RT-PCR)试剂盒(Promage)实时定量PCR仪(BIO RAD),Trizol(Invitrogen),PCNA引物序列GACCGCAACCTGGC CAT(上游)GCGTTATCTTCGG CCCTTAGT(下游);GAPDH序列GGGGAGCCA AAAGGGTCATCATCT(上游)GACGCCTGCTTCAC CACCTTCTTG(下游)。兔抗PCNA抗体(cell signal),鼠抗GAPDH(Cell signal),兔抗p-ERK44/42(Cell signal),兔抗ERK44/42(Cell signal),兔抗p-P38(Cell signal),兔抗P38(Cell signal),兔抗p-SAPK/JNK(Cell signa),兔抗SAPK/JNK(Cell signal),山羊抗兔二抗(中山金桥)。
1.2 WPMY-1细胞培养37 ℃水浴复苏细胞,接种于corningT25培养瓶中,放于孵箱中用含5%热灭活胎牛血清的DMEM培养液培养[5%二氧化碳(CO2)、95%氮气(N2)、37 ℃饱和湿度],实验前,需用含有1%活性炭处理血清的DMEM培养一代。
1.3 MTT实验用胰酶消化WPMY-1细胞,以4×103个/孔密度接种于96孔板,过夜贴壁后,加入不同浓度的ECG或EC(终浓度1、10、100 nmol/L、1、10 μmol/L),或C6或ANI预处理1 h,再加入ECG和EC(终浓度均为10 nmol/L),继续培养72 h,加入MTT(终浓度5 mg/mL)继续孵育4 h后吸去上清,加入100 μL/孔DMSO于570 nm处读取吸光度值。
1.4 蛋白免疫印迹(Western blotting)调整细胞浓度2×106个/孔,种于6孔板中,贴壁后,加入10 nmol/L的ECG或EC)孵育48 h,提取细胞总蛋白,SDS-PACE电泳分离蛋白, 湿转至PVDF膜,室温封闭1 h后用一抗4 ℃孵育过夜,TBST洗6次,二抗(山羊抗兔,1:10 000)室温孵育1 h,免疫反应及化学发光、显影、定影均严格参照试剂盒,按实验步骤操作,检测ECG和EC对PCNA蛋白表达的影响。孵育0~60 min,检测PCNA和MAPK信号通路蛋白ERK44/42、P38、SAPK/JNK磷酸化的影响。(PCNA,p-ERK,ERK,p-P38,P38,SAPK/JNK,p-SAPK/JNK,稀释比例均为1:1 000)。
1.5 RT-PCR法调整细胞浓度2×106个/孔,种于6孔板中。贴壁后,加入10 nmol/L的ECG或EC孵育24 h,提取细胞总核糖核核酸(RNA),按反转录试剂盒及扩增试剂盒操作进行RT-PCR实验。扩增反应条件为:95 ℃ 30 min,95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,共循环40次。循环扩增结束后,记录各组Ct值,根据2-△△Ct法计算各组PCNA相对GAPDH的表达量。
1.6 统计学方法采用SPSS 19.0统计软件处理数据。数据以均数±标准差(x±s)形式表示,各组数据间采用单因素方差分析检验,P<0.05为差异有统计学意义。
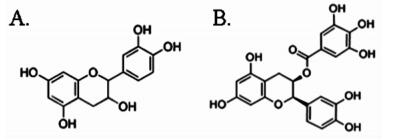
2 结果 2.1 ECG和EC抑制WPMY-1细胞的增殖如图 2A所示,与空白对照组相比,ECG和EC在1、10、100 nmol/L,1、10 μmol/L浓度时均能够抑制WPMY-1细胞的增殖(P<0.01)。选择浓度为10 nmol/L的ECG和EC进行后续实验。与MTT结果一致,如图 2B和2C所示,10 nmol/L的ECG和EC能够抑制PCNA mRNA和蛋白水平的表达,ECG抑制效果略优于EC。
|
| 图 2 ECG和EC对WPMY-1细胞增殖的影响 Fig. 2 Effects of ECG and EC on proliferation of prostatic stromal cell line WPMY-1 1:空白对照组;2:1 nmol/L;3:10 nmol/L;4:100 nmol/L;5:1 μmol/L;6:10 μmol/L;*P<0.05,**P<0.01。A.ECG和EC对WPMY-1增殖的影响;B.ECG和EC对PCNA在基因水平的表达的影响;C. ECG和EC对PCNA蛋白水平的表达的影响。 |
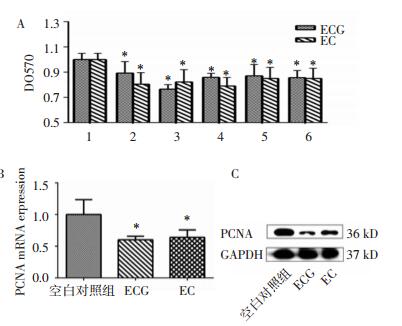
如图 3A、3B所示,与0 min比较,ECG和EC以时间依赖方式抑制ERK44/42通路的磷酸化,ECG和EC能迅速抑制SAPK/JNK通路磷酸化,作用30 min后抑制作用消失。然而,ECG和EC对MAPK另一条通路P38的磷酸化抑制作用则不明显。
|
| 图 3 ECG和EC对ERK44/42、P38、SAPK/JNK磷酸化的影响 Fig. 3 Effects of ECG and EC on phosphorylation levels of MAPK signaling pathway ERK44/42, P38 and SAPK/JNK A.ECG对ERK44/42、P38、SAPK/JNK磷酸化的影响;B.EC对ERK44/42、P38、SAPK/JNK磷酸化的影响。 |
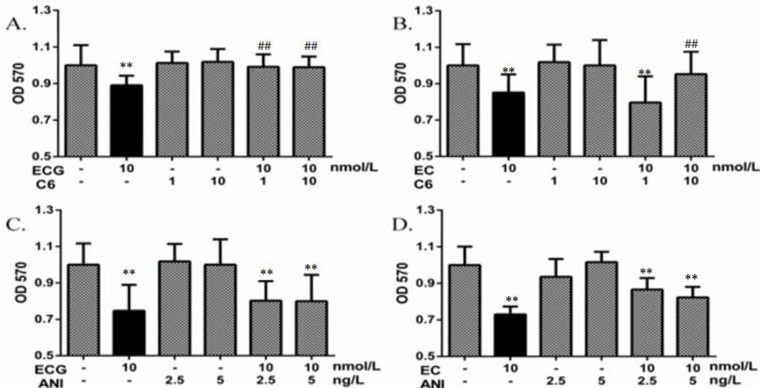
如图 4所示,与空白对照组比较,10 nmol/L的ECG和EC均可以明显抑制WPMY-1细胞的增殖(P<0.01);但是与ECG和EC组比较,加入C6明显阻断了ECG和EC对细胞增殖的抑制作用(见图 4A和4B,P<0.01),加入ANI对ECG和EC抑制细胞增殖的作用无明显影响(见图 4C和4D),单独添加C6或ANI对细胞增殖没有影响。
|
| 图 4 MAPK通路激动剂C6及ANI对ECG或EC抑制WPMY-1细胞增殖的影响 Fig. 4 Effects of C6 or ANI on ECG EC-suppressed cell proliferation of WPMY-1 与空白对照组比较:*P<0.05,**P<0.01;与加药组比较:##P<0.01。A. C6预处理后,ECG对细胞增殖的影响;B. ANI预处理后ECG对细胞增殖的影响;C. C6预处理后,EC对细胞增殖的影响;D. ANI预处理后,EC对细胞增殖的影响。 |
MAPK是细胞内的一类丝氨酸/苏氨酸蛋白激酶,参与调控包括细胞增殖在内的多种信号转到通路,包括ERK、P38、和JNK三条通路[7]。其中,ERK44/42可以通过磷酸化而激活,引发下游包括cyclin D1、c-jun、c-fos、ATF-2、Elk-1、rsk1-3,MNK1/2、Bcl-2和拓扑异构酶Ⅱ在内的多个靶点的信号传导,进而调节细胞增殖,分化,凋亡和细胞周期进程[8]。本实验结果表明ECG和EC可以抑制WPMY-1细胞中组成型ERK44/42的磷酸化(见图 3),并且通过特异性抑制ERK44/42磷酸化的激活而抑制WPMY-1细胞的增殖。
SAPK/JNK是MAPK家族的另一重要通路,可被包括热休克,紫外线照射和炎性细胞因子等在内的多种环境刺激磷酸化激活,引起下游靶基因,如转录因子AP-1和c-Jun、凋亡蛋白质和微管相关蛋白等的磷酸化,进而调控细胞增殖,凋亡,分化和迁移等功能。如图 3所示,ECG和EC均能抑制SAPK/JNK的磷酸化,但是在图 4C、4D中,ANI并不能阻断ECG和EC的抑制WPMY-1细胞的增殖作用,提示:ECG和EC调控SAPK/JNK的作用与WPMY-1细胞增殖作用无关。
研究发现,ECG能够诱导人鼻咽癌、乳腺癌、人肝癌、肺癌来源的多种肿瘤细胞凋亡[9-10]。同时,对转移性前列腺癌(DU154)细胞增殖有较强抑制作用[11]。EC具有抗氧化、调节免疫和抗肿瘤等作用[12-13]。本实验首次发现两者可以通过ERK44/42抑制前列腺间质细胞增殖。ECG是EC的衍生物,两者结构相似,本实验发现ECG和EC均具有明显抑制WPMY-1细胞的增殖作用(见图 1),同时均可以使组成型激活的ERK44/42,SARK/JNK失活(见图 2),均通过选择性抑制ERK44/42激活而抑制前列腺间质细胞增殖(见图 3),提示两者在功能上的相似性。同时两者结构上,ECG比EC增加了一个没食子酸结构,因此可能具有游离出更多自由基的能力,有文献发现ECG的抗氧化及抗炎症优于EC[14]。本实验发现在抗增殖作用方面,ECG的效果略优于EC(见图 2B,图 4),但差异并不十分显著。
ECG和EC是中药锁阳的重要成分。本研究证实EC和ECG具有抑制前列腺间质细胞增殖的作用,提示其可能是锁阳抗BPH的重要物质基础。
| [1] | Kruep EJ, Goodwin BB, Chaudhari S. Evaluation of recent trends in treatment patterns among men with benign prostatic hyperplasia[J]. Am J Mens Health, 2013, 7 (3): 214–219. DOI:10.1177/1557988312469245 |
| [2] | 陈其雨, 喜进岭, 贾晓归. 补肾活血汤治疗良性前列腺增生症50例临床观察[J]. 实用中西医结合临床, 2013, 13 (1): 10–11. |
| [3] | 李新华, 谭琳玲, 张军花. 经尿道前列腺电切术中并发症的原因分析及护理对策[J]. 南方护理学报, 2004, 11 (6): 32–33. |
| [4] | Nicholson TM, Ricke WA. Androgens and estrogens in benign prostatic hyperplasia:past, present and future[J]. Differentiation, 2011, 82 (4-5): 184–199. DOI:10.1016/j.diff.2011.04.006 |
| [5] | 刘如意, 刘敏, 任会勋, 等. 复方锁阳口服液对小鼠性激素水平及免疫功能的影响[J]. 西安交通大学学报 (医学版), 2010, 31 (6): 760–762. |
| [6] | 冯海莲, 黄秀梅, 王宁萍. 考察复方锁阳胶囊的温肾助阳作用[J]. 中成药, 2005, 27 (1): 103–105. |
| [7] | Blenis J. Growth-regulated signal transduction by MAP kinasesand Risks[J]. Cancer cell, 1991, 3 : 445–448. |
| [8] | Mandal R, Becker S, Strebhardt K. Stamping out RAF and MEK1/2 to inhibit the ERK1/2[J]. Oncogene, 2016, 35 : 2547–2561. DOI:10.1038/onc.2015.329 |
| [9] | 蔡轶, 魏沁, 蔡跃鹏, 等. 表儿茶素没食子酸酯对人鼻咽癌C666-1细胞凋亡的影响[J]. 华南师范大学学报, 2015, 47 (4): 103–107. |
| [10] | 黄莉霞, 钟文彬, 黄树林, 等. 儿茶素单体EGCG与ECG体外抗人肝癌细胞BEL-7402的作用[J]. 广东药学院学报, 2013, 29 (4): 435–446. |
| [11] | Ravindranath MH, Saravanan TS, Monteclaro CC, et al. Epicatechins purified from Green Tea (Camellia sinensis) differentially suppress growth of genderdependent human cancer cell lines[J]. Evid Based Complement Altermat Med, 2006, 3 (2): 237–247. DOI:10.1093/ecam/nel003 |
| [12] | Deb G, Thakur VS, Limaye AM, et al. Epigenetic induction of tissue inhibitor of matrix metalloproteinase-3 by green tea polyphenols in breast cancer cells[J]. Molecular Carcinogenesis, 2014, 54 (6): 485–499. |
| [13] | Zhao HX, Xie P, Li XL, et al. A prospective phase Ⅱ trial of EGCG in treatment of acute radiation-induced esophagitis for stage Ⅲ lung cancer[J]. Radiotherapy and Oncology, 2015, 114 (3): 351–356. DOI:10.1016/j.radonc.2015.02.014 |
| [14] | 曹莹, 梁日欣, 杨滨, 等. (-)-儿茶素没食子酸酯和 (+)-表儿茶素对心肌细胞保护作用研究[J]. 中国实验方剂学杂志, 2006, 12 (10): 36–38. |
 2017, Vol. 34
2017, Vol. 34