文章信息
- 张强, 马露, 尹云泽, 唐方
- ZHANG Qiang, MA Lu, YIN Yun-ze, TANG Fang
- 木香在胃肠安丸中药效作用靶点与颗粒剂等效性评价
- Study on radix aucklandiae pharmacodynamic targets in Weichang'an pill and the equivalent evaluation of formula particles
- 天津中医药, 2017, 34(3): 204-207
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(3): 204-207
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.03.16
-
文章历史
- 收稿日期: 2016-11-03
2. 天津中新药业集团股份有限公司乐仁堂制药厂, 天津 300112;
3. 天津医科大学总医院, 天津 300052
胃肠安丸由木香、檀香、沉香、厚朴、枳壳、朱砂、麝香、大黄、巴豆霜、川芎、大枣11味中药组成。以往研究表明,以木香、檀香、枳壳等为代表的芳香化浊类药物能从多途径作用于消化道,改善胃肠道异常状态,恢复正常升降吸收功能[1-3]。本实验选择木香作为胃肠安丸君药的代表药物,采用红外光谱法(IR)、高效液相色谱法(HPLC)检测明确木香全组分及主成分含量,并从胃肠推进、镇痛两方面进行不同剂型、剂量木香药效学比较及作用机制研究,旨在从多靶点阐述木香行气止痛、芳香化浊功效的科学内涵,明确其在胃肠安丸综合作用中的靶点与药效物质基础,并藉此客观评价对照用药木香配方颗粒的药效等效性。
1 实验动物清洁级昆明小鼠300只,雄性,体质量(20±2)g,许可证号SCXK-(军)2009-003,由中国人民解放军军事医学科学院动物实验中心提供,清洁级环境平衡饲养1 d。
2 实验用药木香饮片:云木香,购自安徽亳州市中药饮片厂(批号:130601)。
IR木香水煎剂:天津乐仁堂制药厂提供。将10 g木香饮片以1:10加入蒸馏水,常温浸泡30 min,煎煮30 min,滤过,残渣加5倍量蒸馏水,煎煮30 min,过滤;合并两次滤液,浓缩制备100 g/L原液待测。
给药木香水煎剂:天津乐仁堂制药厂提供。将500 g生药浸泡,煎煮,浓缩至80 g/L原液,分别稀释至60 g/L和40 g/L高中低3个浓度水煎液,分装冷冻保存。木香配方颗粒剂:对照用药分别由天津红日康仁堂药业有限公司(简称KRT)、华润三九现代中药有限公司(简称SJ)提供。
10 %炭末混悬液:将10 g阿拉伯胶均匀撒在100 mL蒸馏水面上,4 ℃过夜,待胶全部沉入水中,加入5 g活性炭顺时针搅拌,静止3~5 h使用。冰醋酸:天津市赢达稀贵化学试剂厂,执行标准CB/T6762007。
3 实验分组与给药将实验动物应用随机函数法(RANDBETWEEM函数)随机分为胃排空和小肠推进实验、热板实验、醋酸扭体实验3组,每组100只。每个实验组随机分为10组,即空白对照组(N)、饮片高、中、低剂量组(Y20、Y15、Y10),KRT配方颗粒高、中、低剂量组(K20、K15、K10),SJ配方颗粒高、中、低剂量组(S20、S15、S10)。各中药组给药剂量分别为1、1.5、2 g/(kg·d),相当于人体剂量的10、15、20倍。每次灌胃0.5 mL,每日1次,连续给药4 d。空白组给予等量蒸馏水灌胃。
4 实验方法 4.1 IR样品制备与指纹图谱特征峰比较采用旋转蒸干仪蒸干IR木香水煎剂的溶剂,作为水煎剂供试品;将木香饮片粉碎,过7号筛,作为饮片样品;将KRT、SJ木香配方颗粒粉碎,过7号筛,分别作为配方颗粒供试品。
取上述4样品加适量溴化钾,研磨均匀,压片,进行红外光谱扫描,建立样品指纹图谱。对比IR木香水煎剂与饮片、IR木香水煎剂与两配方颗粒特征峰相似度;对IR水煎剂组分溶出状态,及水煎剂与对照品组分间是否存在差异进行量化分析。
4.2 温度、时间、制备方式变化对木香全组分及主成分含量影响取KRT和SJ木香配方颗粒,按以下4种方法制备:1)60 ℃浸泡5 min。2)100 ℃浸泡10 min。3)60 ℃煎煮5 min。4)100 ℃煎煮10 min。分别制备8种含生药终浓度为100 g/L样品及传统木香水煎剂样品。
IR建立指纹图谱,对比各样品间特征峰之峰形、峰位及相对峰高相似度;HPLC于225 nm波长下测定主成分含量。
4.3 胃排空和小肠推进实验每只小鼠灌胃给予10 %活性炭混悬液0.2 mL,20 min后用颈椎脱臼法处死,迅速剖开腹腔, 结扎胃贲门和幽门, 取胃, 用滤纸拭干, 称质量(胃总质量), 然后沿胃大弯剪开胃体, 洗去胃内容物并拭干,称质量(胃净质量)。将消化管自幽门至直肠末端完整摘出,测量小肠全长及幽门至炭末前沿的距离,计算炭末推进率。
 |
将实验小鼠分别置于(55±0.5)℃智能热板仪之上,以放置于热板至舔后足所需时间作为实验动物痛阈值。其中,舔足时间>60 s或<5 s或跳跃者为不合格,弃之不用。分别于末次给药后15、30、60、90、120 min测定各实验组小鼠痛阈值。计算给药前痛阈值。
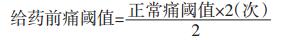 |
于末次给药30 min后,各组小鼠腹腔注射0.6 %醋酸10 mL/kg,同时记录实验小鼠15 min内出现扭体反应(腹部内凹、躯干与后肢伸张、臀部高起)的潜伏期、观察扭体次数。
4.6 统计学处理本实验应用SPSS18.0统计软件包进行数据分析处理,所得结果用均数±标准差(x±s)表示, 采用单因素方差分析,组间两两比较采用LSD法,P < 0.05为有统计学意义。
5 结果 5.1 木香全组分及主成分含量检测见表 1。IR木香水煎液与饮片指纹特征峰比较,其峰形、峰位及相对峰高基本一致,相似度γ=94.98%。提示传统水煎方法可基本实现实验药物全成分溶出,具有稳定性,可作为实验用药并进行主成分含量检测。
| 制备 | 与水煎剂 相似度 |
木香烃内酯 平均含量(%) |
去氢木香内酯 平均含量(%) |
||
| 工艺 | 温度(℃) | 方法 | |||
| 水煎剂 | 60~100 | 煎煮 | 1.000 000 | 0.018 311 852 7 | 0.022 736 937 |
| KRT | 060 | 浸泡 | 0.971 364 | 0.000 790 281 | 0.007 742 537 |
| KRT | 100 | 浸泡 | 0.956 722 | 0.000 671 042 | 0.006 743 936 |
| KRT | 060 | 煎煮 | 0.964 702 | 0.000 699 796 | 0.006 706 380 |
| KRT | 100 | 煎煮 | 0.886 178 | 0.000 834 693 | 0.007 001 416 |
| SJ | 060 | 浸泡 | 0.903 499 | 0.000 261 369 | 0.009 176 003 |
| SJ | 100 | 浸泡 | 0.972 135 | 0.000 214 643 | 0.008 500 787 |
| SJ | 060 | 煎煮 | 0.968 970 | 0.000 240 398 | 0.008 896 502 |
| SJ | 100 | 煎煮 | 0.973 884 | 0.000 291 347 | 0.009 784 969 |
KRT、SJ配方颗粒与水煎剂特征峰之峰形、峰位及相对峰高基本一致,相似度分别为γ=94.36%、93.84 %。木香配方颗粒全组分保留及主成分提取,与水煎剂具有一致性。
5.2 木香对小鼠胃排空和小肠推进的影响见表 2。如表 2所示,木香配方颗粒与水煎剂药效作用相近,三用药组间差异无统计学意义(P>0.05)。
| 组别 | 动物数 | 胃内残留率(%) | 小肠炭末推进率(%) |
| N组 | 10 | 64.19±05.78 | 59.58±05.92 |
| Y20组 | 10 | 50.34±05.62* | 76.59±08.26* |
| Y10组 | 10 | 53.04±09.28* | 67.47±13.72* |
| K20组 | 10 | 53.80±14.86* | 81.36±11.40** |
| K15组 | 10 | 51.59±12.63* | 79.33±13.80** |
| K10组 | 10 | 50.06±10.00* | 73.49±09.86* |
| S20组 | 10 | 43.84±07.91* | 78.34±11.53** |
| S15组 | 10 | 54.92±13.43* | 61.56±15.64* |
| S10组 | 10 | 55.08±13.65* | 69.80±07.64* |
| 注:与N组比较,*P<0.05,**P<0.01。 | |||
见表 3,表 4。表 3不同剂型、剂量木香对小鼠热板反应的比较,如表 3所示,配方颗粒与水煎剂药效作用相近,木香三给药组间比较S10在120 min热板反应显著低于Y10组(P < 0.05)。
| 组别 | 动物数 | 痛阈(s) | 给药后不同时间痛阈(s) | ||||
| 15 min | 30 min | 60 min | 90 min | 120 min | |||
| N组 | 10 | 16.26±1.67 | 16.25±5.37 | 17.85±3.52 | 16.82±7.32 | 16.78±5.23 | 17.81±4.78 |
| Y20组 | 10 | 14.27±5.01 | 18.59±2.68* | 18.06±3.95* | 19.04±4.31* | 19.98±4.50* | 22.56±2.52* |
| Y15组 | 10 | 16.28±2.58 | 18.56±6.27* | 19.54±2.74* | 18.62±1.38* | 20.59±4.70* | 21.37±5.71* |
| Y10组 | 10 | 17.35±4.65 | 18.19±4.63* | 19.43±2.86* | 19.23±3.92* | 21.88±6.75* | 20.93±5.19* |
| K20组 | 10 | 16.59±4.11 | 18.57±2.96* | 16.32±3.38 | 18.67±2.44* | 21.43±3.94* | 21.06±5.19* |
| K15组 | 10 | 16.85±5.71 | 18.41±5.21* | 19.01±6.41* | 19.71±5.56* | 20.21±8.02* | 20.19±10.30* |
| K10组 | 10 | 17.87±5.07 | 17.57±6.64 | 20.75±6.63* | 21.18±6.43* | 21.80±7.89* | 19.02±4.84* |
| S20组 | 10 | 17.60±2.78 | 18.64±3.99* | 20.67±8.28* | 18.25±3.17* | 19.80±3.11* | 20.79±6.62* |
| S15组 | 10 | 16.87±3.82 | 16.28±6.46 | 19.06±3.77* | 18.95±5.41* | 19.87±4.87* | 19.70±8.02* |
| S10组 | 10 | 15.56±3.57 | 17.50±6.54* | 17.80±5.71 | 19.85±3.32* | 19.17±3.63* | 20.40±4.59# |
| 注:与N组比较,*P<0.05;与Y组比较,#P<0.05。 | |||||||
| 组别 | 动物数 | 潜伏期(s) | 扭体次数(次) |
| N组 | 10 | 9.85±1.26 | 27.23±6.52 |
| Y20组 | 10 | 12.82±3.13** | 19.89±5.35* |
| Y15组 | 10 | 11.76±2.61* | 21.73±3.45* |
| Y10组 | 10 | 11.81±1.74* | 19.62±7.59* |
| K20组 | 10 | 11.96±0.46* | 21.75±7.89* |
| K15组 | 10 | 11.27±0.44* | 16.11±7.41*# |
| K10组 | 10 | 12.45±0.91* | 19.75±4.71* |
| S20组 | 10 | 10.67±1.00 | 24.56±10.21 |
| S15组 | 10 | 11.48±1.17* | 20.80±6.37* |
| S10组 | 10 | 11.84±0.83* | 18.56±6.11* |
| 注:与N组比较,*P<0.05,**P<0.01;与Y组比较,#P<0.05。 | |||
不同制备工艺下的木香配方颗粒与水煎剂药效作用相近,三给药组间差异无统计学意义(P>0.05)。
6 讨论 6.1 胃肠安丸中木香行气机制目前为止,已经在木香中发现萜类、黄酮、生物碱、甾体、糖、脂肪酸,还有氨基酸和脂肪[4],其中的倍半萜内酯如去氢木香内酯和木香烃内酯含量较高,为木香的主要活性化合物。其药理作用[5-10]囊括解痉、降压、抗菌、利胆和抗溃疡,抑制麻醉犬呼吸,调节胃肠运动,抗肿瘤和抗炎等。实验结果显示,给予木香水煎剂后胃内残留率降低、小肠推进率升高。证实木香能够加快胃肠蠕动,促进胃排空。提示木香行气消胀,健脾理气功效,与胃肠安丸调整胃肠运动,消除胃脘胀满靶向一致。
6.2 木香止痛机制前期实验证实胃肠安可通过下调UC模型大鼠血清促炎性细胞因子肿瘤坏死因子-α(TNF-α)、白介素6(IL)-6水平,升高抑炎性细胞因子IL-10水平,参与UC细胞因子网络调控,调节COX-2表达,从而抑制炎症介质的释放,减轻肠道炎症反应[11]。为探讨胃肠安丸止痛药效物质基础,本实验选用方中理气止痛代表药物木香为实验用药,采用镇痛金标准热板与醋酸扭体法[12]进行镇痛效应分析。结果显示,木香可有效提高热板实验中小鼠的痛阈值,延长小鼠发生扭体反应潜伏期,减少小鼠15 min内扭体反应次数。证实木香具有明显的镇痛作用,该结论明确了芳香化浊类药物在腹泻、肠炎、菌痢治疗中的作用靶点,并为在胃肠安丸中作为君药提供了科学依据。
6.3 配方颗粒剂等效学评价配方颗粒为工业化大生产新型“饮片”制剂,其药源、提取工艺较之传统饮片及水煎剂稳定[13]。本课题在明确胃肠安丸复方作用机制的基础上,为证实木香药效作用机制及其作用靶点的可重复性,将配方颗粒剂作为木香水煎剂对照用药,并进行等效学评价。但由于本课题无法采用与颗粒剂同批次饮片,为确保实验用药与对照药物的可比性,本实验以药源具有同一性为前提,选择产地均来自云南的木香制品展开相关性分析。
通过建立不同剂型木香制剂IR指纹图谱,确认配方颗粒剂全成分转移与水煎剂特征峰相似度,分析配方颗粒剂全成分转移与传统水煎剂的成分溶出是否存在差异。通过对不同剂型木香药效学比较进而评价中药配方颗粒与传统饮片药效等效性。制备条件与主成分含量相关性分析显示:制备工艺、温度、煎煮方法与木香烃内酯含量呈显著性正相关。γ值依次0.708 389 428,0.985 986 242,0.927 496 618(P<0.05,0.001,0.001);温度、煎煮方法与去氢木香内酯含量亦呈显著性正相关。γ值依次为0.84 4131 738,0.754 973 766(P<0.001,0.05)。实验证实:制备条件与主成分含量密切相关。
大生产提取方式虽然实现多成分转移,但配方颗粒与传统水煎剂主成分含量的比较显示,除KRT在100 ℃煎煮和SJ在60 ℃浸泡制备条件外,配方颗粒与水煎剂组分相似度均>95 %,但水煎剂主成分含量显著高于配方颗粒。分析原因为配方颗粒的出膏率、全成分转移不完全等同于主成分提取率。以出膏率直接换算配方颗粒剂生药剂量,可能是导致与水煎剂相当剂量颗粒剂实际生药量被评估过低,以致主成分含量低于水煎剂的原因。
组分和含量的差异是否会影响配方颗粒的药效,是临床工作者最为关注的焦点[14]。为此本实验在明确组分结构相似度、主成分含量差异基础上,对木香不同制剂药效进行了等效性评价。证实其主成分含量存在差异,而药效作用相近。
提取温度、时间是影响药效物质或有效部位提取率稳定的重要因素。大生产高温加压下的提取过程,与传统文火煎煮提取率存在差异。水煎剂主成分含量明显高于配方颗粒,而三者药效未见统计学差异。分析原因:1)木香烃内酯和去氢木香内酯具有挥发性,大生产高温高压煎煮提取过程、KRT 100 ℃煎煮配置、HPLC样品采用旋蒸挥发溶剂过程,是导致部分主成分丢失或二次丢失的主因。2)SJ 60 ℃温水浸泡,颗粒剂难以充分溶解,可能是导致主成分含量检测出现差异又一原因。3)单品药物主成分含量存在差异,而药效作用未呈现统计学差异,与活性成分的量效区间,药物的协同与拮抗,检测二次丢失(假性丢失)等多因素相关。
| [1] | 朱金照, 冷恩仁, 陈东风. 木香对大鼠胃肠运动的影响及其机制探讨[J]. 中国中西医结合脾胃杂志, 2000, 8 (4): 236–236. |
| [2] | 刘红艳. 檀香"行气"功效物质基础研究[D]. 长沙: 湖南中医药大学, 2012. |
| [3] | Bian ZX, Zhang GS, Wong KL, et al. Inhibitory effects of magnolol on distal colon of guinea pig in vitro[J]. Biological and Pharmaceutical Bulletin, 2006, 29 (4): 790–795. DOI:10.1248/bpb.29.790 |
| [4] | 郑虎占. 中药现代研究与应用[M]. 北京: 学苑出版社, 1997: 936. |
| [5] | 王本祥. 现代中药药理与临床[M]. 天津: 天津科技翻译出版公司, 2004: 263-265. |
| [6] | 魏华, 彭勇, 马国需, 等. 木香有效成分及药理作用研究进展[J]. 中草药, 2012, 03 : 613–620. |
| [7] | 林明侠. 木香的药理及临床研究概况[J]. 中医药信息, 2005, 12 (3): 18–19. |
| [8] | 张猛, 郭建生, 聂子文, 等. 云木香对豚鼠离体肠平滑肌的影响[J]. 中药药理与临床, 2011, 27 (6): 73–76. |
| [9] | 陈少夫, 李宇权. 木香对胃酸分泌、胃排空及男泌素、生长抑素、胃动素水平的影响[J]. 中国中西医结合杂志, 1994, 14 (7): 406–408. |
| [10] | 战宏利. 木香炮制前后化学成分研究[D]. 沈阳: 辽宁中医药大学, 2010. |
| [11] | 侯丽娟. 胃肠安丸对溃疡性结肠炎干预效应的机制研究[D]. 天津: 天津医科大学, 2012 |
| [12] | 刘真, 马晓丽, 夏甜甜, 等. 尼古丁对小鼠镇痛作用的研究[J]. 时珍国医国药, 2013, 24 (2): 279–280. |
| [13] | 张红梅, 宋景政, 谭红胜, 等. 从汤剂到颗粒剂:中药配方颗粒20年回顾与展望[J]. 世界科学技术.中医药现代化, 2012, 14 (4): 1740–1753. |
| [14] | 袁立. 黄连解毒汤传统饮片汤剂与配方颗粒汤剂药动学的对比研究[D]. 长沙: 中南大学, 2010. |
2. Zhongxin Pharmaceuticals Tianjin Lerentang, Tianjin 300112, China;
3. Tianjin Medical University General Hospital, Tianjin 300052, China
 2017, Vol. 34
2017, Vol. 34