文章信息
- 韩静, 邵瑞, 王跃飞, 王彧
- HAN Jing, SHAO Rui, WANG Yue-fei, WANG Yu
- 甘草化学成分植物雌激素活性研究进展
- Advances study of phytoestrogen from licorice
- 天津中医药, 2017, 34(3): 212-216
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(3): 212-216
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.03.18
-
文章历史
- 收稿日期: 2016-12-03
2. 天津国际生物医药联合研究院, 中药新药研发中心, 天津 300457
美国妇女健康倡议会的临床研究资料显示,雌激素替代疗法在围绝经期综合征及心血管疾病的治疗中费用昂贵,不良反应明显,长期使用可增加子宫癌及乳腺癌的发病率[1-2]。植物雌激素作为天然化合物,通过低亲和力与雌激素受体(ER)结合,发挥弱的雌激素样或抗雌激素样效应,具有双向调节的“扶正”作用,因此在生殖系统、骨骼系统、心血管系统及中枢神经系统等方面[3-4]具有广泛应用。甘草是中国传统中药, 具有补脾益气,清热解毒,调和诸药的功能,在传统中医药中被称为“国老”[5]。众多实验研究表明,甘草主要是通过其中的植物雌激素成分发挥作用。因此本文主要集中阐述近年来甘草化学成分植物雌激素活性研究进展。
1 甘草中具有植物雌激素活性的化学成分及其作用机制甘草中化学成分丰富,截止目前约有464种之多,按结构分为黄酮类、香豆素类、三萜皂苷和苷元类、二苯乙烯类。此外,还有少许其他结构的化合物,如正戊基苯衍生物、酚酸类等。其中,黄酮类(包括黄酮、异黄酮、黄酮醇、二氢黄酮、查耳酮等,其中以异黄酮类为主),香豆素类,木脂素类以及二苯乙烯类化合物由于含有杂环酚羟基,与女性体内的雌激素相似,发挥对乳腺癌、绝经期综合征、心脑血管病和骨质疏松等疾病的预防和治疗作用。下面以化学结构为依据,对甘草中具有植物雌激素活性的单体成分及其临床疾病和作用机制进行介绍。
1.1 甘草中具有植物雌激素活性的异黄酮类单体异黄酮的基本母核为3-苯基苯并二氢吡喃,甘草中被报道的具有植物雌激素活性的异黄酮类单体包括甘草苷、光甘草定、光甘草素、染料木素、芒柄花素和毛蕊异黄酮,表 1分别列举了它们在神经保护、治疗或预防乳腺癌和子宫内膜癌、预防代谢综合征、心血管疾病防护、防治更年期综合征和抗骨质疏松方面的作用机制。在神经保护方面其作用机制可归纳为:1)抑制神经细胞凋亡。2)促进神经营养因子的合成与分泌。在抗肿瘤作用机制主要为低浓度时ER依赖的促进肿瘤细胞增殖,高浓度时,ER非依赖的抗肿瘤细胞增殖。在心血管疾病方面其作用机制为:1)改善血脂紊乱。2)双向调节血管平滑肌的增殖,即低浓度时促进细胞增殖,高浓度时抑制细胞增殖。作为植物选择性雌激素受体调节剂改善更年期综合征和骨质疏松症。见表 1。
| 单体名称 | 疾病模型 | 作用机制 | 参考文献 |
| 甘草苷 | 神经系统疾病 | 1)ERβ选择性激动剂。2)像雌激素一样拮抗Aβ25~35导致的神经细胞凋亡,且可以被ER完全阻断剂ICI 182 780部分阻断,说明其抗Aβ的神经保护作用至少部分通过ER途径。 | [6] |
| 光甘草定 | 乳腺癌 | 剂量依赖双向调节乳腺癌,即低浓度(0.01~10 μmol/L)呈ER依赖的促增殖作用, 高浓度(大于15 μmol/L)呈ER非依赖的抗增殖作用。 | [7-8] |
| 神经系统疾病 | 通过激活雌激素反应标志基因肌酸激酶(CK),改善学习和记忆能力。 | [9] | |
| 代谢综合征 | 植物选择性雌激素受体调节剂,调节细胞能量消耗,预防代谢综合征。 | [10] | |
| 心血管疾病 | 双向调节人血管平滑肌细胞的增殖,即低浓度时促进增殖,高浓度时抑制增殖,且该作用可被雌激素拮抗剂雷洛昔芬抑制。 | [10] | |
| 光甘草素 | 乳腺癌 | 剂量依赖双向调节乳腺癌,即低浓度(0.01~10 μmol/L)呈ER依赖的促增殖作用, 高浓度(大于15 μmol/L)呈ER非依赖的抗增殖作用。 | [7] |
| 神经系统疾病 | 通过激活雌激素反应标志基因CK,改善学习和记忆能力。 | [9] | |
| 心血管疾病 | 在雌性大鼠心血管组织中,促进ER转录,激活雌激素相关基因CK,ERK1/2和Akt,诱导血管细胞增殖,修复血管损伤。 | [8, 11] | |
| 染料木素 | 乳腺癌 | 1)依赖于乳腺癌细胞内ERα/ERβ比率。2)抑制T47D细胞(低ERα/ERβ比率)增殖,上调ERβ,提高细胞色素c氧化酶活性。3)促进MCF-7细胞(高ERα/ERβ比率)增殖,抑制凋亡。4)对MDA-MB-231细胞(ER-)无影响。 | [12] |
| 子宫内膜癌 | 1)低浓度时通过增加ERRα的表达,拮抗ER介导的下游基因转录,抑制Ishkawa细胞生长。2)高浓度时会通过激动ER促进内膜癌的发展。 | [13] | |
| 骨质疏松 | 1)在患有乳腺癌且卵巢切除缺乏雌激素的模型中,增加骨的密度。2)在雌激素缺乏诱发的大鼠骨质疏松症模型中,会改善骨密度、骨生物力学及相关生化指标,具有抗骨质疏松作用。 | [14-15] | |
| 芒柄花素 | 更年期综合征 | 在去势大鼠中,大剂量[100 mg(/ kg· d)]时使萎缩的子宫指数回升, 且未引起子宫内膜细胞异常增殖发生癌变。 | [16-17] |
| 心血管疾病 | 1)在去势大鼠中,降低血清总胆固醇(TC)和低密度脂蛋白胆固醇(LDL-C)含量, 改善血脂紊乱。2)高剂量[100 mg(/ kg· d)]会选择性上调大鼠主动脉血管中ERβ的表达,对ERα无影响,从而抑制血管平滑肌细胞的增殖。3)通过与ERβ结合, 使ERβ发生构型改变, 形成同源或异源二聚体, 在转录因子Fos和Jun的作用下, 启动靶基因的转录和翻译,促进血管新生。 | [16-17] | |
| 乳腺癌 | 1)抑制ER+乳腺癌细胞增殖,使细胞发生G1期阻滞、减少PCNA蛋白的表达, 上调Bax/Bcl-2比率, 上调ERα、miR-375, 激活Ras/P38 MAPK通路。2)不影响ER-的乳腺癌细胞的增殖。 | [18] | |
| 神经系统疾病 | 在去卵巢的成年大鼠中,剂量依赖性的上调大脑皮层ERα、ERβ的表达,起到神经保护的作用。 | [19] | |
| 毛蕊异黄酮 | 乳腺癌 | 1)低剂量时(2~8 μmol/L),通过激活ER,下调Bax,上调Bcl-2和ERK1/2的磷酸化,促进ER+乳腺癌细胞MCF-7的生长。2)高剂量时(>16 μmol/L),上调ERβ,抑制IGF-1R的激活,降低Akt的磷酸化,下调HOTAIR,从而抑制ER+乳腺癌细胞增殖。3)对ER-的乳腺癌细胞没有作用。 | [12, 20-24] |
| 神经系统疾病 | 1)通过下调RASD1,上调ERα, miR-375和Bcl-2基因, 减少脑梗死体积和脑含水量,改善神经功能缺损。2)促进神经营养因子的合成与分泌,包括神经生长因子(NGF)、神经胶质细胞源性的神经营养因子(GDNF)和脑源性神经营养因子(BDNF),且会被雌激素受体抑制剂抑制。3)在星形胶质细胞中,促进ER的磷酸化。 | [25-26] | |
| 心血管疾病 | 1)与ERα和ERβ选择性结合。2)作为选择性雌激素受体调节剂,通过上调VEGF-VEGFR2和激活MAPK通路来促进血管生成。3)在人脐静脉血管内皮细胞(HUVEC)中,降低高级糖化终产物(AGEs)引起的巨噬细胞迁移及其对内皮细胞的黏附,上调ER,下调TGF-beta1, ICAM-1和RAGE基因,逆转ERK1/2和NF-κB磷酸化和核易位,减少血管局部炎症,且会被雌激素受体抑制剂抑制。 | [24, 27] |
二氢黄酮,是自然界中存在的一类多酚类物质,分布于蔷薇科、芸香科、姜科、菊科、杜鹃花科,豆科等被子植物中, 作为ERβ的强激活剂起到抗肿瘤、杀菌、抗炎、抗氧化等多种生物活性, 是一类研究价值很高的化合物。见表 2。
| 单体名称 | 疾病模型 | 作用机制 | 参考文献 |
| 甘草苷 | 乳腺癌 | 1)强激活ERβ,调控的基因与雌二醇不同,较少激活增殖基因而较多的激活促凋亡基因,抑制乳腺癌细胞的生长,同时不刺激子宫变大, 不促进内皮细胞的生长。2)在只表达ERα乳腺癌细胞中,低剂量对细胞增殖无影响,很高剂量时非特异性激活ERα,通过上调cyclin B1, PR和PS2基因,刺激细胞增殖,作用与雌二醇相当。 | [28-33] |
| 阿尔茨海默病 | 1)激活ERβ,减少Aβ1-40的分泌,减少Notch-2 mRNA和蛋白水平的表达,促进脑源性祖细胞分化成神经元,不影响星形胶质细胞的生长。2)促进突触树突的恢复。3)上调ERβ,抑制神经胶质瘤的生长,且没有性别差异。 | [9, 34-38] |
查耳酮类是二氢黄酮的衍生物, 结构柔性大, 能够结合不同的受体,具有广泛的生物活性。通过调节ERα和ERβ以及相关下游基因,如PS2、bcl2/ bax等起到抗肿瘤、神经性保护、抗菌等作用。见表 3。
| 单体名称 | 疾病模型 | 作用机制 | 参考文献 |
| 异甘草素 | 乳腺癌 | 1)ERα和ERβ激动剂。2)剂量依赖双向调节乳腺癌。即低浓度时下调人乳腺癌MCF-7细胞中的内源性ERα蛋白水平和上调PS2 mRNA表达,起到促增殖作用, 高浓度呈ER非依赖的抗增殖作用。3)除作为ERα和ERβ激动剂,还为芳香化酶抑制剂,阻断雄激素转化为雌激素,调控雌激素作用下的肿瘤生长。 | [8, 39] |
| 神经系统疾病 | 通过激活雌激素反应标志基因CK,改善学习和记忆能力 | [9] | |
| 甘草查尔酮A | 肿瘤 | 1)作为植物雌激素,通过降低癌细胞的bcl2水平、bcl2/bax比值以及减弱DNA拓扑异构酶Ⅱ活性,起到抗增殖作用。2)增强紫杉醇和长春碱的化疗作用。 | [40-41] |
三萜皂苷是由三萜皂苷元和糖、糖醛酸和其他有机酸组成,大部分存在于双子叶植物中,通过与ER结合,调节c-Fos、TNF-α、Aβ等相关因子起到抗肿瘤、抗骨质疏松、抗炎、神经保护等作用。见表 4。
雌激素替代疗法用于骨质疏松、更年期综合征、老年性痴呆等多种疾病的预防和治疗。但是, 雌激素不仅有毒副作用和禁忌症, 而且长期使用有诱发乳腺癌和子宫内膜癌的危险。因此, 从天然植物中寻找毒副作用小、具有雌激素样作用的天然品代替化学合成品, 具有重要的现实意义和广阔的应用前景。
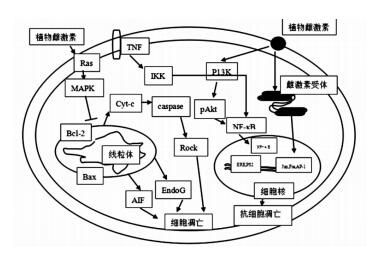
甘草是一味具有植物雌激素活性的中药,随着对甘草化学成分的深入研究,其作用机制得到进一步证实。但是甘草不仅化学成分复杂,其中的植物雌激素活性成分的作用机制更为繁杂(见图 1),目前,关于甘草植物雌激素活性的研究尚有许多问题需要探讨,如药理活性的研究缺乏统一的评价标准;作用机制研究不够系统全面。因此,应从分子、细胞、整体动物和临床试验多个方面全面、系统、深入研究甘草中植物雌激素样活性成分对人体的作用,明确其作用机制,建立完善的质量评价体系,为甘草的应用提供科学的依据。
|
| 图 1 植物雌激素可能的作用通路 Fig. 1 Possible mechanism of phytoestrogen |
| [1] | Rossouw JE, Anderson GL, Prentice RL, et al. Risks and benefits of estrogen plus progestin in healthy postmenopausal women:principal results From the Women's Health Initiative randomized controlled trial[J]. Jama, 2002, 288 (3): 321–333. DOI:10.1001/jama.288.3.321 |
| [2] | Norman RJ, MacLennan AH. Current status of hormone therapy and breast cancer[J]. Human Reproduction Update, 2005, 11 (6): 541–543. DOI:10.1093/humupd/dmi041 |
| [3] | Usui T. Pharmaceutical prospects of phytoestrogens[J]. Endocrine Journal, 2006, 53 (1): 7–20. DOI:10.1507/endocrj.53.7 |
| [4] | 张建梅, 李瓦里. 植物雌激素防治绝经后骨质疏松的研究进展[J]. 现代药物与临床, 2012, 27 (1): 65–69. |
| [5] | 梁冰, 杨爱馥, 黄凤兰, 等. 甘草属化学成分及药理作用研究进展[J]. 东北农业大学学报, 2006, 37 (1): 115–119. |
| [6] | 杨云. 甘草苷抗阿尔茨海默病作用及机制研究[D]. 北京: 中国人民解放军军事医学科学院, 2008. |
| [7] | Tamir S, Eizenberg M, Somjen D, et al. Estrogenic and antiproliferative properties of glabridin from licorice in human breast cancer cells[J]. Cancer Research, 2000, 60 (20): 5704–5709. |
| [8] | Tamir S, Eizenberg M, Somjen D, et al. Estrogen-like activity of glabrene and other constituents isolated from licorice root[J]. The Journal of Steroid Biochemistry and Molecular Biology, 2001, 78 (3): 291–298. DOI:10.1016/S0960-0760(01)00093-0 |
| [9] | Lin Z, Gu J, Xiu J, et al. Traditional chinese medicine for senile dementia[J]. Evidence-based Complementary and Alternative Medicine:eCAM, 2012 : 692621. |
| [10] | Simmler C, Pauli GF, Chen SN. Phytochemistry and biological properties of glabridin[J]. Fitoterapia, 2013 (90): 160–184. |
| [11] | Somjen D, Knoll E, Vaya J, et al. Estrogen-like activity of licorice root constituents:glabridin and glabrene, in vascular tissues in vitro and in vivo[J]. Journal of Steroid Biochemistry and Molecular Biology, 2004, 91 : 147–155. DOI:10.1016/j.jsbmb.2004.04.003 |
| [12] | Chen J, Lin C, Yong W, et al. Calycosin and genistein induce apoptosis by inactivation of HOTAIR/p-Akt signaling pathway in human breast cancer MCF-7 cells[J]. Cellular Physiology and Biochemistry:International Journal of Experimental Cellular Physiology, Biochemistry, and Pharmacology, 2015, 35 (2): 722–728. |
| [13] | 赵鑫, 吕斯迹, 丁岩, 等. 染料木素与大豆甙元对子宫内膜癌细胞株ERRα的影响[J]. 同济大学学报 (医学版), 2009, 30 (4): 12–17. |
| [14] | Power KA, Ward WE, Chen JM, et al. Genistein alone and in combination with the mammalian lignans enterolactone and enterodiol induce estrogenic effects on bone and uterus in a postmenopausal breast cancer mouse model[J]. Bone, 2006, 39 (1): 117–124. DOI:10.1016/j.bone.2005.12.015 |
| [15] | 孙纪元, 缪珊, 李纪鹏, 等. 染料木素对雌激素缺乏诱发的大鼠骨质疏松症的作用研究[J]. 中国药学杂志, 2009, 44 (12): 900–904. |
| [16] | 幸奠霞, 刘志高, 薛存宽, 等. 刺芒柄花素雌激素样作用及其与血脂相关性研究[J]. 中国老年学杂志, 2009, 29 (18): 2340–2342. |
| [17] | 幸奠霞, 刘先玲, 薛存宽, 等. 刺芒柄花素雌激素样作用及对大鼠心房雌激素受体表达的影响[J]. 中药材, 2010, 33 (9): 1445–1449. |
| [18] | Chen J, Zeng J, Xin M, et al. Formononetin induces cell cycle arrest of human breast cancer cells via IGF1/PI3K/Akt pathways in vitro and in vivo[J]. Hormone and Metabolic Research, 2011, 43 (10): 681–686. DOI:10.1055/s-0031-1286306 |
| [19] | 孙英春. 刺芒柄花素对去卵巢大鼠大脑皮层雌激素受体α, β表达的影响[D]. 武汉: 华中科技大学, 2010. |
| [20] | Chen J, Xiong WB, Xiong Y, et al. Calycosin stimulates proliferation of estrogen receptor-positive human breast cancer cells through downregulation of Bax gene expression and upregulation of Bcl-2 gene expression at low concentrations[J]. JPEN Journal of Parenteral and Enteral Nutrition, 2011, 35 (6): 763–769. DOI:10.1177/0148607111413900 |
| [21] | Chen J, Liu L, Hou R, et al. Calycosin promotes proliferation of estrogen receptor-positive cells via estrogen receptors and ERK1/2 activation in vitro and in vivo[J]. Cancer Letters, 2011, 308 (2): 144–151. DOI:10.1016/j.canlet.2011.04.022 |
| [22] | Chen J, Zhao X, Ye Y, et al. Estrogen receptor beta-mediated proliferative inhibition and apoptosis in human breast cancer by calycosin and formononetin[J]. Cellular Physiology and Biochemistry:International Journal of Experimental Cellular Physiology, Biochemistry, and Pharmacology, 2013, 32 (6): 1790–1797. DOI:10.1159/000356612 |
| [23] | Chen J, Hou R, Zhang X, et al. Calycosin suppresses breast cancer cell growth via ERbeta-dependent regulation of IGF-1R, p38 MAPK and PI3K/Akt pathways[J]. Plos One, 2014, 9 (3): e91245. DOI:10.1371/journal.pone.0091245 |
| [24] | Tang JY, Li S, Li ZH, et al. Calycosin promotes angiogenesis involving estrogen receptor and mitogen-activated protein kinase (MAPK) signaling pathway in zebrafish and HUVEC[J]. Plos One, 2010, 5 (7): e11822. DOI:10.1371/journal.pone.0011822 |
| [25] | Wang Y, Dong X, Li Z, et al. Downregulated RASD1 and upregulated miR-375 are involved in protective effects of calycosin on cerebral ischemia/reperfusion rats[J]. Journal of the Neurological Sciences, 2014, 339 (1-2): 144–148. DOI:10.1016/j.jns.2014.02.002 |
| [26] | Xu SL, Bi CW, Choi RC, et al. Flavonoids induce the synthesis and secretion of neurotrophic factors in cultured rat astrocytes:a signaling response mediated by estrogen receptor[J]. Evidence-Based Complementary and Alternative Medicine:eCAM, 2013, 2013 : 127075. |
| [27] | Xu Y, Feng L, Wang S, et al. Calycosin protects HUVECs from advanced glycation end products-induced macrophage infiltration[J]. Journal of Ethnopharmacology, 2011, 137 (1): 359–370. DOI:10.1016/j.jep.2011.05.041 |
| [28] | Paruthiyil S, Cvoro A, Zhao X, et al. Drug and cell type-specific regulation of genes with different classes of estrogen receptor beta-selective agonists[J]. Plos One, 2009, 4 (7): e6271. DOI:10.1371/journal.pone.0006271 |
| [29] | Lattrich C, Stegerer A, Haring J, et al. Estrogen receptor beta agonists affect growth and gene expression of human breast cancer cell lines[J]. Steroids, 2013, 78 (2): 195–202. DOI:10.1016/j.steroids.2012.10.014 |
| [30] | Shanle EK, Hawse JR, Xu W. Generation of stable reporter breast cancer cell lines for the identification of ER subtype selective ligands[J]. Biochemical Pharmacology, 2011, 82 (12): 1940–1949. DOI:10.1016/j.bcp.2011.08.026 |
| [31] | Mersereau JE, Levy N, Staub RE, et al. Liquiritigenin is a plant-derived highly selective estrogen receptor beta agonist[J]. Molecular and Cellular Endocrinology, 2008, 283 (1-2): 49–57. DOI:10.1016/j.mce.2007.11.020 |
| [32] | Jiang Y, Gong P, Madak-Erdogan Z, et al. Mechanisms enforcing the estrogen receptor beta selectivity of botanical estrogens[J]. FASEB Journal:Official Publication of the Federation of American Societies for Experimental Biology, 2013, 27 (11): 4406–4418. DOI:10.1096/fj.13-234617 |
| [33] | Gong P, Madak-Erdogan Z, Li J, et al. Transcriptomic analysis identifies gene networks regulated by estrogen receptor alpha (ERalpha) and ERbeta that control distinct effects of different botanical estrogens[J]. Nuclear Receptor Signaling, 2014, 12 : e001. |
| [34] | Liu RT, Zou LB, Fu JY, et al. Effects of liquiritigenin treatment on the learning and memory deficits induced by amyloid beta-peptide (25-35) in rats[J]. Behavioural Brain Research, 2010, 210 (1): 24–31. DOI:10.1016/j.bbr.2010.01.041 |
| [35] | Liu RT, Zou LB, Lu QJ. Liquiritigenin inhibits Abeta (25-35)-induced neurotoxicity and secretion of Abeta (1-40) in rat hippocampal neurons[J]. Acta Pharmacologica Sinica, 2009, 30 (7): 899–906. DOI:10.1038/aps.2009.74 |
| [36] | Liu RT, Zou LB, Fu JY, et al. Promotion of rat brain-derived progenitor cell neurogenesis by liquiritigenin treatment:underlying mechanisms[J]. Neuroscience Letters, 2010, 481 (3): 139–143. DOI:10.1016/j.neulet.2010.06.065 |
| [37] | Bertrand SJ, Mactutus CF, Aksenova MV, et al. Synaptodendritic recovery following HIV Tat exposure:neurorestoration by phytoestrogens[J]. Journal of Neurochemistry, 2014, 128 (1): 140–151. DOI:10.1111/jnc.12375 |
| [38] | Sareddy GR, Nair BC, Gonugunta VK, et al. Therapeutic significance of estrogen receptor beta agonists in gliomas[J]. Molecular Cancer Therapeutics, 2012, 11 (5): 1174–1182. DOI:10.1158/1535-7163.MCT-11-0960 |
| [39] | Ye L, Gho WM, Chan FL, et al. Dietary administration of the licorice flavonoid isoliquiritigenin deters the growth of MCF-7 cells overexpressing aromatase[J]. International Journal of Cancer Journal International du Cancer, 2009, 124 (5): 1028–1036. DOI:10.1002/ijc.v124:5 |
| [40] | Yoon G, Kang BY, Cheon SH. Topoisomerase Ⅰ inhibition and cytotoxicity of licochalcones A and E from Glycyrrhiza inflata[J]. Archives of Pharmacal Research, 2007, 30 (3): 313–316. DOI:10.1007/BF02977611 |
| [41] | Rafi MM, Rosen RT, Vassil A, et al. Modulation of bcl-2 and cytotoxicity by licochalcone-A, a novel estrogenic flavonoid[J]. Anticancer Research, 2000, 20 (4): 2653–2658. |
| [42] | Simons R, Vincken JP, Mol LA, et al. Agonistic and antagonistic estrogens in licorice root (Glycyrrhiza glabra)[J]. Analytical and Bioanalytical Chemistry, 2011, 401 (1): 305–313. DOI:10.1007/s00216-011-5061-9 |
| [43] | 张明发, 沈雅琴. 甘草酸的抗肿瘤作用[J]. 上海医药, 2010, 31 (11): 492–495. |
2. Tianjin International Joint Academy of Biotechnology and Medicine, Research and Development Center of Traditional Chinese Medicine, Tianjin 300457, China
 2017, Vol. 34
2017, Vol. 34