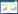文章信息
- 王世伟, 徐宁
- WANG Shi-wei, XU Ning
- 消渴灵片对2型糖尿病大鼠JNK信号通路的影响
- Effects of Xiaokeling tablet on JNK signaling pathway with type 2 diabetic
- 天津中医药, 2017, 34(4): 255-258
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(4): 255-258
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.04.13
-
文章历史
- 收稿日期: 2016-10-27
糖代谢紊乱引起的血糖水平升高,是造成糖尿病的直接原因,胰岛B细胞分泌的胰岛素,可加速糖原的合成及机体对血糖的吸收利用,降低血糖水平,当胰岛B细胞功能异常,胰岛素分泌不足,则引起血糖水平升高[1]。近年研究发现,c-Jun氨基末端激酶(JNK)信号转导通路对胰岛B细胞具有较强的调控作用,JNK蛋白激活后可抑制胰岛素信号转导通路、胰岛B细胞特异基因的表达,造成胰岛素分泌减少,引起血糖水平升高[2]。研究JNK信号通路在调节血糖、治疗糖尿病方面具有重要意义。
消渴灵片选用熟地黄、黄芪等具有生津止渴功效的药材,具有补阴益气、行气通瘀、清热化痰的功效,在调节血糖、治疗糖尿病方面具有较好的临床效果。本研究以高糖高脂食物联合链脲佐菌素(STZ)制备2型糖尿病模型大鼠,观察消渴灵片对模型大鼠血液指标、JNK mRNA、p-JNK蛋白及PDX-1蛋白表达的影响,探究其可能的降糖机制。
1 材料 1.1 材料与试剂消渴灵片(陕西金象制药有限公司,批号20160826);链脲佐菌素(南京生兴生物技术有限公司,批号160406);盐酸二甲双胍(天津亚宝药业科技有限公司,批号20160422);葡萄糖测定试剂盒(宁波市慈城生化试剂厂,批号20160223);胰岛素放免分析试剂盒(天津新传生物技术有限公司,批号20160306);丙二醛(MDA)、超氧化物歧化酶(SOD)测试盒(南京建成生物工程研究所,批号20160104);兔抗鼠磷酸化JNK多克隆抗体(Santa,美国);免疫组织化学试剂盒(北京中杉金桥生物技术有限公司)。
1.2 实验仪器D8系列紫外可见分光光度计(南京菲勒仪器有限公司);HH6003γ-放射免疫分析仪(北京核海高技术开发公司);PT-620半自动生化分析仪(北京普天新桥技术有限公司);TDL-40C低速台式离心机(苏州欧倍科学仪器有限公司);QuantStudioTM 12K Flex实时荧光定量PCR仪(ABI,美国)。
1.3 实验动物Wistar大鼠,雄性,体质量(160± 10)g,购自天津实验动物中心,合格证号为SCXK(津)2016-0011。喂养期间自由摄食饮水,环境温度(24±3)℃、相对湿度40%~60%。
2 方法 2.1 大鼠模型的制备实验大鼠适应性喂养1周后,给予高脂高糖食物(15%白砂糖,15%猪油,4.5%胆固醇,65.5%基础饲料)喂养4周,禁食12 h后,50 mg/kg剂量腹腔注射链脲佐菌素-柠檬酸缓冲溶液(pH4.5),给药48 h后,尾静脉采血,测定大鼠空腹血糖(FBG)、总胆固醇(TC)及甘油三酯(TG)含量。
2.2 分组及给药选取造模成功大鼠50只,按随机数字表法随机分为5组,分为模型组,XKL低、中、高剂量组[分别以2、4、8 g/kg XKL作为低、中、高剂量灌胃]、阳性对照组(以0.8 g/kg盐酸二甲双胍灌胃),另取基础喂养大鼠10只,作为正常组。模型组及正常组给予同等体积生理盐水,给药期间全部大鼠基础饲料连续喂养28 d。
2.3 检测指标及方法 2.3.1 血液指标检测末次给药后禁食12 h,1%戊巴比妥钠溶液40 mg/kg腹腔注射麻醉,腹主动脉取血,分离血清,TC、TG采用自动生化分析仪测定,放射免疫法测定FINS;生物试剂盒测定FBG、MDA、SOD。
2.3.2 JNK mRNA表达的检测末次给药后禁食12 h,1%戊巴比妥钠溶液40 mg/kg腹腔注射麻醉,处死大鼠,分离胰腺组织,称取胰腺组织100 mg,加入RNAiso Plus试剂提取总mRNA;检测mRNA纯度及完整性,按照逆转录试剂盒操作说明,实验结果采用2-△△Ct法计算相对表达量。
2.3.3 JNK及PDX-1蛋白表达的检测末次给药后禁食12 h,1%戊巴比妥钠溶液40 mg/kg腹腔注射麻醉,处死大鼠,分离胰腺组织,胰腺组织裂解、匀浆,12 000×g,4 ℃离心10 min分离上清液,应用BCA试剂盒操作进行蛋白含量测定,配制SDSPAGE分离胶、浓缩胶,进行电泳、转膜、封闭,分别将PVDF膜用稀释好的p-JNK、JNK、PDX-1一抗(1:3 000,5%脱脂奶粉稀释),进行孵育,4℃摇荡过夜,再用荧光二抗(1:5 000稀释)室温孵育1.5 h,ECL发光显色,凝胶成像仪曝光成像。Image J软件分析条带灰度,读取各条带校正积分光密度值,并进行半定量分析,以β-actin作为内参照,PDX-1蛋白含量用APDX-1/Aβ-actin表示;p-JNK蛋白含量用Ap-JNK/ AJNK表示。
2.4 数据处理采用SPSS19.0统计软件对实验数据进行处理,数据以均数±标准差(x±s)表示,各组间比较采用单因素方差分析Oneway ANOVA检验,组间两两比较若方差齐用LSD法,若方差不齐采用Dunnett’s T3法,P<0.05表示差异具有统计学意义。
3 结果 3.1 模型大鼠血液指标变化情况模型大鼠在经高糖高脂食物喂养4周后,与正常组大鼠比较,FBG、TC及TG含量均显著升高,FBG≥16.7 mmol/L,表明大鼠模型制备成功,见表 1。
| 组别 | 动物数 | FBG | TC | TC | |||||
| 第1周 | 第4周 | 第1周 | 第4周 | 第1周 | 第4周 | ||||
| 正常组 | 10 | 04.27±0.54 | 04.32±0.39 | 1.52±0.18 | 01.48±0.21 | 1.31±0.21 | 1.29±0.19 | ||
| 模型组 | 40 | 10.35±4.76 | 16.97±3.23 | 8.96±4.87 | 12.85±5.77 | 2.17±0.93 | 2.95±1.22 | ||
XKL可显著降低模型大鼠FBG、TC、TG水平,XKL对模型大鼠FBG水平变化的影响最为明显,XKL低、中、高剂量组与模型组比较,差异具有统计学意义(P<0.01);同时XKL对血清TC及TG含量也有较明显的调节作用,中、高剂量组与模型组比较,差异具有统计学意义(P<0.05,P<0.01),表明XKL可有效改善模型大鼠血糖血脂指标,结果见表 2。
| mmol/L | |||||
| 组别 | 动物数 | 剂量 (g/kg) | FBG | TC | TC |
| 正常组 | 10 | - | 4.32±0.39** | 1.48±0.21** | 1.29±0.19* |
| 模型组 | 10 | - | 16.97±3.23 | 12.85±5.77 | 2.95±1.22 |
| XKL低剂量组 | 10 | 2 | 9.43±1.95** | 11.43±4.79 | 2.43±1.03 |
| XKL中剂量组 | 10 | 4 | 8.24±1.36** | 6.24±2.86* | 2.24±0.97* |
| XKL高剂量组 | 10 | 8 | 6.95±0.93** | 2.95±2.72** | 1.95±0.84* |
| 阳性对照组 | 10 | 0.8 | 6.32±0.71 | 2.01±0.71 | 2.32±0.71 |
| 注:与模型组比较,*P<0.05,**P<0.01。 | |||||
XKL可显著降低模型大鼠MDA水平,提高FINS水平及SOD活性,中、高剂量组与模型组比较,差异具有统计学意义(P<0.05),XKL可降低MDA含量并提高SOD活性,XKL中、高剂量组可显著降低MDA含量,与模型组比较(P<0.05),表明XKL可有效降低模型大鼠体内氧化应激水平,结果见表 3。
| 组别 | 动物数 | 剂量 (g/kg) | FINS (μU/mL) | MDA (nmol/L) | SOD (U/L) |
| 正常组 | 10 | - | 11.43±1.24** | 5.02±1.19** | 85.23±9.74* |
| 模型组 | 10 | - | 5.01±0.69 | 9.57±1.47 | 69.85±8.77 |
| XKL低剂量组 | 10 | 2 | 6.13±0.78 | 8.21±1.25 | 72.76±6.89 |
| XKL中剂量组 | 10 | 4 | 7.98±0.95* | 7.61±1.06* | 79.93±7.24 |
| XKL高剂量组 | 10 | 8 | 9.42±0.99** | 6.74±1.28** | 82.11±8.47* |
| 阳性对照组 | 10 | 0.8 | 9.14±0.91 | 8.42±1.13 | 71.72±8.41 |
| 注:与模型组比较,*P<0.05,**P<0.01。 | |||||
与正常组比较,模型组JNK mRNA相对表达量显著升高(P<0.01),表明JNK信号通路激活;与模型组比较,XKL及阳性对照组均可降低JNK mRNA的相对表达量,XKL中剂量与模型组差异有统计学意义(P<0.05),XKL高剂量组及阳性对照组与模型组差异同样具有统计学意义(P<0.01),表明XKL可有效降低JNK mRNA的相对表达量,抑制JNK信号通路的过度活化,实验结果见表 4。
| 组别 | 动物数 | JNK平均CT值 | β-actin平均CT值 | 相对表达量 |
| 正常组 | 10 | 22.38±0.44 | 16.73±0.22 | 1.02±0.14** |
| 模型组 | 10 | 25.65±0.58 | 21.34±0.38 | 13.63±2.67 |
| XKL低剂量组 | 10 | 24.71±0.26 | 17.37±0.15 | 10.34±1.73 |
| XKL中剂量组 | 10 | 24.01±0.24 | 20.00±0.57 | 8.92±1.91* |
| XKL高剂量组 | 10 | 22.88±0.66 | 20.70±0.52 | 6.54±1.05** |
| 阳性对照组 | 10 | 23.68±0.35 | 17.91±0.06 | 5.06±1.09** |
| 注:与模型组比较,*P<0.05,**P<0.01。 | ||||
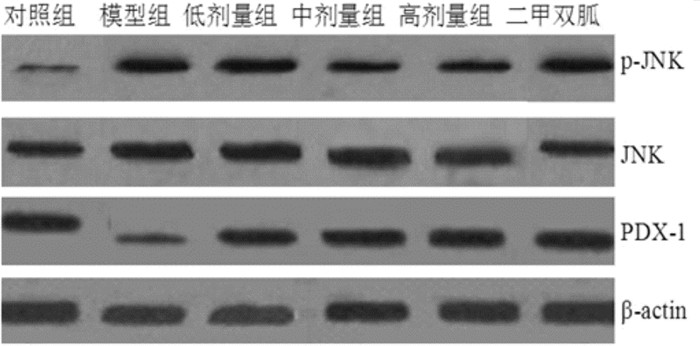
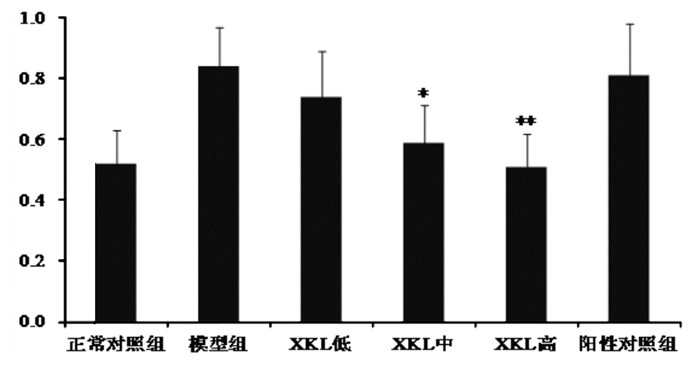
与正常组比较,模型组p-JNK蛋白表达量显著升高,表明JNK信号通路活化;与模型组比较,XKL可显著降低模型大鼠p-JNK蛋白的表达水平,XKL中、高剂量与模型组比较差异具有统计学意义(P<0.05,P<0.01),二甲双胍对p-JNK蛋白的表达无直接作用,与模型组比较无统计学意义(P>0.05);与正常组比较,模型组PDX-1蛋白表达量显著减少,XKL各剂量组均可增加PDX-1蛋白表达量,中、高剂量与模型组比较差异具有统计学意义(P<0.05,P<0.01);XKL对p-JNK及PDX-1蛋白表达的影响具有一定的剂量效应,见图 1-3。
|
| 图 1 p-JNK及PDX-1蛋白表达电泳图 Fig. 1 Expression of p-JNK and PDX-1 protein electrophoresis |
|
| 图 2 不同计量XKL对模型大鼠pJNK蛋白表达量的影响 Fig. 2 Effects of different doses of XKL on p-JNK protein expression in model rats 与模型组比较, *P<0.05,**P<0.01。 |
|
| 图 3 不同计量XKL对模型大鼠PDX-1蛋白表达量的影响 Fig. 3 Effects of different doses of XKL on PDX-1 protein expression in model rats 与模型组比较, *P<0.05,**P<0.01。 |
中药在治疗糖尿病方面拥有悠久历史,具有安全有效,毒副作用低,标本兼治的特点,糖尿病属于中医“消渴”范畴,“本虚标实为病机,气虚阴亏为其病本,血瘀痰湿之标贯穿其中”[4-5]。消渴灵片选用熟地黄、黄芪、麦门冬、黄连、牡丹皮等药材,其中熟地黄补阴益气、黄芪补气固表、麦门冬养阴生津、黄莲清热解毒、牡丹皮行气通瘀,上述诸药合用具有生津止渴、补阴益气、清热解毒、抗菌消炎等功效[6-7]。消渴灵片全方攻补兼施,标本同治,补阴益气,化瘀除湿,扶正祛邪,针对病机治疗糖尿病。
氧化应激被认为是糖尿病重要发病机制之一[8-9],氧化应激反应引起体内SOD活性降低,导致机体氧自由基大量产生,对本身缺乏抗氧化酶的胰岛B细胞更易造成氧损伤,引起胰岛B细胞功能受损,胰岛素分泌减少,血糖代谢紊乱[10]。JNK属于丝裂原活化蛋白激酶(MAPK)家族,是信号传导过程中重要传递物质,可将机体信号由细胞表面传递细胞核内,使核内相应基因发生表达调节靶细胞功能[11]。JNK信号通路对氧自由基极为敏感,易被氧自由基激活,JNK信号转导通路对胰岛B细胞具有较强的调控作用,在JNK信号通路激活后,影响PDX-1转录因子功能,造成胰岛素及胰岛细胞特异基因无法正常表达,糖代谢紊乱引起血糖升高,导致糖尿病的发生[12-13]。同时有研究表明,JNK信号通路在受到抑制后,胰岛素抵抗作用降低,表明JNK信号通路的激活对胰岛素抵抗也发挥着重要作用[14-15]。氧化应激反应造成的氧自由基含量升高,可直接损伤胰岛细胞,同时氧自由基还可以激活JNK信号通路,进一步影响胰岛细胞功能,造成胰岛素分泌的减少。
本研究发现,与模型组比较,XKL可有效降低FBG及MDA含量,显著提高FINS水平及SOD活性,表明XKL具有良好降低血糖及氧化应激反应的作用,可有效促进胰岛素的分泌;XKL干预后模型大鼠PDX-1蛋白表达量显著升,p-JNK蛋白及JNK mRNA表达量显著下降,表明JNK蛋白通路过度激活的情况被抑制,XKL可以有效降低体内氧化应激水平及抑制JNK信号通路的过度激活。XKL在降血糖、增加胰岛素分泌、降低氧化应激反应、抑制JNK信号通路等方面具有较强的剂量效应。
综上所述,XKL降糖机制可能是通过降低氧化应激水平,抑制JNK信号通路活化,保证胰岛素的分泌及胰岛细胞的正常增殖分化,调节血糖水平,进而治疗糖尿病。
| [1] | 张良满, 喻翠玲, 徐蓉, 等. 2型糖尿病胰岛素强化治疗患者的低血糖原因分析及护理[J]. 中华护理杂志, 2005, 40 (7): 142–143. |
| [2] | 任春久, 张瑶, 崔为正, 等. 氧化应激在2型糖尿病发病机制中的作用研究进展[J]. 生理学报, 2013 (6): 664–673. |
| [3] | 韩亭亭, 曹茵茵, 田丽君, 等. 哮喘大鼠肺组织中Wnt5a/JNK信号通路相关分子表达增强[J]. 细胞与分子免疫学杂志, 2015, 31 (3): 325–327. |
| [4] | 李黎莉, 陈志强, 王月华, 等. 益气养阴化瘀通络中药对实验性糖尿病大鼠模型的影响[J]. 时珍国医国药, 2012, 23 (5): 1203–1206. |
| [5] | 刘博, 于春江, 孟祥宝, 等. 芪蛭降糖胶囊对2型糖尿病大鼠肝组织中InsR, GLUT2, p-JNK蛋白表达的影响[J]. 中国中药杂志, 2016, 41 (11): 1978–1982. |
| [6] | 宋莉, 王洋, 张竹, 等. 人参花与黄芪、麦冬配伍的研究[J]. 药物分析杂志, 2013, 33 (12): 2114–2118. |
| [7] | 白振义. 六味地黄加黄芪当归汤治疗早期糖尿病肾病疗效观察[J]. 中华中医药杂志, 2009, 24 (8): 1097–1098. |
| [8] | 胡雅国, 张利棕, 邓九零, 等. 氧化应激在血糖波动加速GK大鼠糖尿病肾病发病过程中的作用[J]. 中华糖尿病杂志, 2015, 32 (12): 1106–1110. DOI:10.3969/j.issn.1006-6187.2015.12.014 |
| [9] | 王萍, 戚琛晔, 席守民, 等. 2型糖尿病大鼠氧化应激与骨骼肌细胞葡萄糖转运蛋白4转位相关性的研究[J]. 中国临床药理学杂志, 2016, 32 (15): 1428–1431. |
| [10] | 魏娜, 贺海波, 张长城, 等. JNK信号通路与细胞凋亡关系的研究进展[J]. 中国临床药理学与治疗学, 2013, 18 (7): 807–812. |
| [11] | 于娜, 左加成, 穆倩倩, 等. 降糖消渴颗粒对自发性糖尿病KKAy小鼠肾脏JNK信号通路的影响[J]. 中华中医药杂志, 2016, 31 (5): 1801–1804. |
| [12] | Shiraki N, Lai CJ, Hishikari Y, et al. TGF-β gnaling potentiates differentiation of embryonic stem cells to PDX-1 expressing endodermal cells[J]. Genes cells, 2005, 10 (6): 503–516. DOI:10.1111/gtc.2005.10.issue-6 |
| [13] | Stoffers DA, kieffer TJ, Hussain MA, et al. insulinotropic glucagon-like peptide 1 agonists stimulate expressions of homeodomain protein PDX-1 and increase islet size in mouse pancreas[J]. Diabetes, 2000, 49 (5): 741–748. DOI:10.2337/diabetes.49.5.741 |
| [14] | 郭红辉, 凌文华. JNK介导TNF-A和H2O2引起的脂肪细胞胰岛素抵抗[J]. 中国病理生理杂志, 2010, 26 (2): 349–352. |
| [15] | 金正贤, 高中, 张桂珍. 胰岛素抵抗与IKK和JNK活性的改变[J]. 中华糖尿病杂志, 2009, 17 (4): 319–320. |
 2017, Vol. 34
2017, Vol. 34