文章信息
- 崔翰博, 褚月颉, 任永丽, 李萍
- CUI Han-bo, CHU Yue-jie, REN Yong-li, Li Ping
- 乌头汤对DPN大鼠NGF受体TrkA、p75NTR表达的影响
- Intervention of Aconite Main Tuber decoction on NGF, TrkA and p75NTR in rats developed diabetic peripheral neuropathy
- 天津中医药, 2017, 34(4): 259-261
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(4): 259-261
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.04.14
-
文章历史
- 收稿日期: 2016-12-16
糖尿病周围神经病变(DPN)是糖尿病的常见并发症,其临床表现常为下肢的感觉异常、疼痛,足部皮温降低、怕冷,皮肤色淡,足背动脉搏动减弱等症状。中医认为本病多为寒湿闭阻经络,阳失温煦下肢所致。乌头汤具有温经散寒、通络止痛之功效,临床工作中将该方化裁用于改善DPN的以上症状常可获得较满意疗效。本实验通过观察乌头汤对DPN大鼠胫神经组织酪氨酸蛋白激酶A(TrkA)、p75神经营养因子受体(p75NTR)及血清神经生长因子(NGF)的影响,探索该方的可能作用机制。
1 材料与仪器 1.1 动物及分组Wistar大鼠60只,6周龄,雌雄各半,购自北京维通利华实验动物技术有限公司。室温(22±2)℃,保持安静。动物分层随机分入空白组、模型组、乌头汤组,每组20只,雌雄各半。
1.2 主要试剂链尿佐菌素(STZ)Sigma-S0130,(批号:082k0827);大鼠TrkA、p75NTR、NGF ElISA Kit均购自上海邦奕生物科技有限公司(批号:201512);Anti-TrkA抗体、Anti-p75NTR抗体均购自艾博抗(上海)贸易有限公司。
1.3 主要设备酶标仪:芬兰(Labsystems Multiskan MS),仪器型号:352型;洗板机:芬兰(Thermo Lab-systems),仪器型号:AC8;离心机:微量高速离心机(国产),仪器型号:TG16W;培养箱:隔水式恒温培养箱(国产),仪器型号:GNP-9080;血糖仪及试纸:长沙三诺生物传感技术有限公司。
1.4 药物制备中药饮片(麻黄、赤芍、黄芪、炙甘草、制川乌头)均购自于天津市中医药研究院附属医院中药房。乌头汤按如下方法制备:麻黄、赤芍、黄芪、炙甘草各15 g,制川乌头30 g。制川乌头先煎3 h,再加入其他药物煎煮两次,每次30 min,分别得药汁后混合,并以65 ℃水浴浓缩至100 mL(相当于生药0.90 g/mL)。
2 实验方法 2.1 模型制备动物适应性喂养1周后开始造模:1)禁食8 h后,按75 mg/kg腹腔注射STZ(采用柠檬酸-柠檬酸钠缓冲液,调整pH至4.2~4.6,STZ浓度为10 g/L);空白组腹腔注射等体积的柠檬酸-柠檬酸钠缓冲液。1周后剪尾采血测定空腹血糖(FBG),FBG高于16.7 mmol/L(3 000 mg/L)的样本为合格。对不合格样本予以剔除。2)根据相关文献,糖尿病模型复制成功并维持高血糖水平6周后可形成DPN[1]。故于第6周末测定缩足反应阈值,较空白组平均水平升高2.0 g以上者为DPN模型合格。对不合格样本予以剔除。缩足反应阈值检测方法参考王汉兵文献[2]。
2.2 给药方法干预药物制备后,经动物体表面积计算大鼠的相应给药量为10 mL/kg。乌头汤组每日灌胃1次,模型组及空白组采用等剂量蒸馏水灌胃。中药干预从DPN造模成功后介入,持续4周。
2.3 指标及检测动物空腹8 h后以10%水合氯醛腹腔注射(350 mg/kg)麻醉,麻醉后立即手术分离双侧胫神经,下腔静脉取血。左侧胫神经按照1 g组织加入9 mL磷酸盐缓冲溶液(PBS)制备组织匀浆,酶联免疫吸附测定法(ELISA法)检测TrkA和p75NTR含量,操作严格按照试剂盒说明书进行。右侧胫神经以30%甲醛溶液固定,常规石蜡包埋,免疫组化法染色,Anti-TrkA的稀释度为1:50、Antip75NTR的稀释度为1:100,阴性对照片省去“一抗”,光镜下采集图片观察TrkA和p75NTR在神经纤维中雪旺细胞表面的表达。药物干预前以剪尾采血法测定FBG,干预后测定静脉血FBG。静脉血制备血清后以ELISA法检测NGF含量,操作严格按照试剂盒说明书进行。
2.4 统计学分析数据分析采用SPSS 19.0统计软件处理,各组数据均以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK检验,P<0.05为差异有统计学意义。
3 实验结果 3.1 对FBG的影响不论是干预前还是干预后,乌头汤组和模型组FBG均较空白组升高(P<0.01);乌头汤组与模型组间FBG均无统计学差异(P>0.05)。各组内FBG在干预前后均无统计学差异(P>0.05)。
| 组别 | 动物数 | 干预前FBG(mmol/L) | 干预后FBG(mmol/L) |
| 空白组 | 20 | 4.54±0.88* | 4.67±0.62 |
| 模型组 | 15 | 23.91±2.26 | 22.4±5.85* |
| 乌头汤组 | 17 | 23.44±5.83 | 24.2±4.29* |
| 注:与空白组比较,*P<0.01。 | |||
模型组神经组织TrkA、p75NTR及血清NGF较空白组均无统计学差异(P>0.05);与模型组比较,乌头汤组血清NGF含量明显升高(P<0.05),神经组织p75NTR明显降低(P<0.05),神经组织TrkA无统计学差异(P>0.05)。
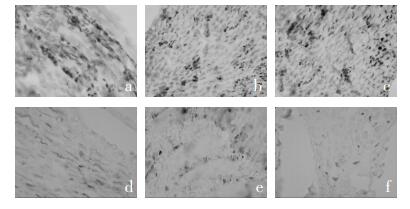
3.3 对雪旺细胞TrkA、p75NTR表达的影响免疫组化染色阳性产物呈浅棕色至棕黄色,其染色的深浅反应目标蛋白阳性表达强弱,阴性对照片不着色。三组间TrkA阳性表达未见明显差异(见图 1a、图 1b、图 1c)。模型对照组p75NTR着色较空白组和乌头汤组加深,提示其阳性表达程度较另两组增强(见图 1d、图 1e、图 1f)。
|
| 图 1 DPN大鼠雪旺细胞TrkA、p75NTR的表达(免疫组化,×400) Fig. 1 Expression of TrkA, p75NTR in Schwann cells a:空白组TrkA表达;b:模型对照组TrkA表达;c:乌头汤组TrkA表达;d:空白组p75NTR表达;e:模型对照组p75NTR表达;f:乌头汤组p75NTR表达 |
| 组别 | 动物数 | TrKA(U/L) | p75NTR(μg/L) | NGF(ng/L) |
| 空白组 | 20 | 69.47±8.46 | 97.64±13.85 | 489.14±53.68 |
| 模型组 | 15 | 68.22±10.4 | 100.39±11.58 | 470.75±42.90 |
| 乌头汤组 | 17 | 67.17±11.74 | 87.37±16.24* | 513.07±44.51# |
| 注:与空白组、模型组比较*P<0.05;与模型组比较#P<0.05。 | ||||
有报道称糖尿病患者中约有61.8%并发DPN[3],而在病程大于15 a的糖尿病患者中近乎全部都合并DPN[4]。即使在新诊断糖尿病足病患者中伴随DPN病变者也占到了46.06%[5]。DPN严重影响患者的生活质量,造成家庭甚至社会负担,占用和消耗大量社会医疗资源。
p75NTR与TrkA均为NGF受体。p75NTR的胞内区含有可通过调节凋亡信号而诱导神经元凋亡的区域[6]。当p75NTR与TrkA同时表达时,p75NTR可通过强化NGF与TrkA的结合而促进其效应发挥,而在缺乏p75NTR时NGF-TrkA的促神经生长作用消失。这可能是通过p75NTR跨膜区的螺旋结构与TrkA形成二聚体[7],继而改变TrkA上与NGF特异性结合的结构域而改变TrkA与NGF的亲和力,使信号蛋白在下游级联反应中增强而实现的[8]。p75NTR既可以作为TrkA的协同受体,通过与TrkA协同作用,促进神经元生长,也可直接与神经营养素结合而介导神经元及胶质细胞凋亡[9]。p75NTR对配体NGF或神经生长因子前体(proNGF)具有相同的亲合力;而TrkA与NGF亲和力更高,将proNGF裂解后的pro结构域与TrkA结合,同样能产生促神经生长作用。因此神经细胞是凋亡抑或存活,需由NGF:proNGF与p75NTR:TrkA的比例来决定[10]。高糖可造成proNGF增多,打乱NGF与proNGF平衡。
乌头汤出自《金匮要略》,文载“:疼痛,不可屈伸,乌头汤主之。”本方多用于治疗以关节疼痛、肿胀,活动受限为主的肌肉骨骼系统和结缔组织疾病[11]。本实验并未发现DPN大鼠神经纤维TrkA的表达在3组间有明显的差异,而乌头汤组较模型对照组胫神经组织p75NTR含量降低,免疫组化也显示乌头汤组较模型对照组p75NTR染色阳性程度明显降低。因而可以认为调整NGF的两个受体的协同作用也可能是本方的作用机制之一,高糖可导致神经髓鞘雪旺细胞NGF水平降低,并且与共培养的神经元轴突的协调生长也较差[12]。乌头汤组血清NGF较模型组升高,也可能是其促进神经修复、再生,预防DPN进展的原因之一。实验结果所示,乌头汤组与模型组间血糖并无差异,并且各组内干预前后FBG水平也没有明显变化,从而可知乌头汤对NGF和p75NTR的干预作用并非通过调整血糖而达到的。并且模型对照组NGF较空白组并无明显差异,提示乌头汤对NGF的干预作用亦不依赖其原有的病理变化,其具体原因尚需进一步探索。
| [1] | Marangoni MN, Brady ST, Chowdhury SA, et al. The co-occurrence of myocardial dysfunction and peripheral insensate neuropathyin a streptozotocin-induced rat model of diabetes[J]. Cardiovasc Diabetol, 2014, 13 (1): 11. DOI:10.1186/1475-2840-13-11 |
| [2] | 王汉兵, 王焱林, 欧伟明, 等. 糖尿病周围神经病变大鼠疼痛模型的建立[J]. 中国疼痛医学杂志, 2007, 13 (1): 43–48. |
| [3] | Lu B, Yang Z, Wang M, et al. High prevalence of diabetic neuropathy in population-based patients diagnosed with type 2 diabetes in the Shanghai downtown[J]. Diabetes Res Clin Pract, 2010, 88 (3): 289–294. DOI:10.1016/j.diabres.2010.02.002 |
| [4] | Oguejiofor OC, Odenigbo CU, Oguejiofor CB. Evaluation of the effect of duration of diabetes mellitus on peripheral neuropathy using the United Kingdom screening test scoring system, bio-thesiometry and aesthesiometry[J]. Niger J Clin Pract, 2010, 13 (3): 240–247. |
| [5] | Sinharay K, Paul UK, Bhattacharyya AK, et al. Prevalence of diabetic foot ulcers in newly diagnosed diabetes mellitus patients[J]. J Indian Med Assoc, 2012, 110 (9): 608–611. |
| [6] | Charalampopoulos I, Vicario A, Pediaditakis I, et al. Genetic dissection of neurotrophin signaling through the p75 neurotrophin receptor[J]. Cell Rep, 2012, 2 (6): 1563–1570. DOI:10.1016/j.celrep.2012.11.009 |
| [7] | Sykes AM, Palstra N, Abankwa D, et al. The effects of transmembrane sequence and dimerization on cleavage of the p75 neurotrophin receptor by γ-secretase[J]. J Biol Chem, 2012, 287 (52): 43810–43824. DOI:10.1074/jbc.M112.382903 |
| [8] | Matusica D, Skeldal S, Sykes AM, et al. An intracellular domain fragment of the p75 neurotrophin receptor [p75(NTR)] enhances tropomyosin receptor kinase A (TrkA) receptor function[J]. J Biol Chem, 2013, 288 (16): 11144–11154. DOI:10.1074/jbc.M112.436469 |
| [9] | Chen Y, Zeng J, Cen L. Multiple roles of the p75 neurotrophin receptor in the nervous system[J]. J Int Med Res, 2009, 37 (2): 281–288. DOI:10.1177/147323000903700201 |
| [10] | Frade JM, López-Sánchez N. A novel hypothesis for Alzheimer disease based on neuronal tetraploidy induced by p75 (NTR)[J]. Cell Cycle, 2010, 9 (10): 1934–1941. DOI:10.4161/cc.9.10.11582 |
| [11] | 梅罗阳, 高岑, 宋俊生. 乌头汤方证临床文献研究[J]. 四川中医, 2015, 33 (4): 182–184. |
| [12] | Dey I, Midha N, Singh G, et al. Diabetic Schwann cells suffer from nerve growth factor and neurotrophin-3 underproduction and poor associability with axons[J]. Glia, 2013, 61 (12): 1990–1999. DOI:10.1002/glia.22570 |
 2017, Vol. 34
2017, Vol. 34