文章信息
- 王一洲, 赵强
- WANG Yi-zhou, ZHAO Qiang
- 屈膝点按叩揉法调控L型电压依赖性钙通道影响软骨细胞代谢的机制研究
- Study on the mechanism of Quxi Dian'an Kourou method regulation of L-type calcium channel affect the metabolism of chondrocytes
- 天津中医药, 2017, 34(4): 262-265
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(4): 262-265
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.04.15
-
文章历史
- 收稿日期: 2016-12-26
2. 天津市中医药研究院附属医院, 天津 300120
膝骨性关节炎(KOA)是一种常见的退行性骨关节疾病,软骨细胞在异常微应力环境中发生的肥大、凋亡是该病的主要病理变化。研究发现[1],适当的应力刺激能够维持软骨细胞结构、促进细胞合成代谢、降低细胞凋亡率。Browning等[2]通过酶联免疫吸附法测定流体静压干预后体外培养的软骨细胞中钙离子(Ca2+)浓度上升,而使用钙通道阻滞剂可明显降低Ca2+浓度上升的速率。可见钙通道是软骨细胞响应应力刺激的中介结构,目前已发现软骨细胞具有L型、P/Q型电压依赖性钙通道蛋白亚单位Cav1.2,Cav1.3,Cav1.4,Cav2.1等表达[3],由钙通道引发的Ca2+内流对甲状旁腺激素相关蛋白(PTHrP)具有重要意义[4-5],两者的联动效应是软骨细胞力学-生物信号转导的主要途径。
推拿手法的本质是外源性应力刺激,具有即时性、短效性的特点,关节周围的软组织是手法的直接效应器官,前期研究发现[6-7]屈膝点按叩揉法能有效改善肌肉、韧带的力学性能,而膝关节周围肌肉、韧带等软组织是缓解关节软骨应力集中的重要结构,相比直接针对软骨面的西医防治手段,该手法具有整体调节的独特优势,基于此笔者运用屈膝点按叩揉法与关节腔玻璃酸钠注射治疗比较,分析屈膝点按叩揉法对软骨细胞合成代谢相关通路蛋白及L型电压依赖性钙通道的影响,探讨该手法防治KOA的分子机制。
1 材料和方法 1.1 试剂DMEM、胰蛋白酶、胎牛血清、青霉素、链霉素(Gibco公司,美国);Ⅱ型胶原酶、(Sigma公司,美国);RNA提取试剂、反转录试剂盒、Real-time PCR试剂盒、DNase 1、5×RNA Loading Buffer(Takara公司,日本)。
1.2 仪器HB-PT型单跑道兔跑台(上海艾研生物科技有限公司);电子天平(Sartorius公司,德国);涡旋振荡仪(海门市其林贝尔仪器制造有限公司);分光光度计(Therno scientific公司,美国);iCycler荧光定量PCR仪、电泳系统(Bio-Rad公司,美国);低温离心机(Eppendorf公司,德国)。
1.3 实验动物及造模健康6~8月龄新西兰大耳白兔50只[北京维通利华SCXK(京)05076685],体质量(3.25±0.25)kg,雌雄各半,采用Hulth造模法构建KOA兔模型,将50只兔编号后按随机数字表法平均分成5组,治疗组采用屈膝点按叩揉法治疗,对照组采用关节腔注射玻璃酸钠注射液治疗,正常组、假手术组及模型组造模后按光照12 h,温度(23± 2)℃,湿度40%~70%饲养。
造模方法[8]:3%戊巴比妥钠(1 mL/kg)耳缘静脉注射麻醉,仰卧位捆绑固定,一侧膝部内侧及后腿前面备皮,胫骨内侧髁内上切开2 cm手术窗口,逐层分离显露关节腔,向后剪断内侧副韧带,过屈膝关节暴露前交叉韧带并切断,同时取出内侧半月板,生理盐水冲洗关节腔2次,逐层缝合,术后给予口服止痛药及抗生素3 d,3 d后强迫跑台,25 m/min,每日0.5 h,连续30 d。假手术组常规消毒,备皮,胫骨内侧切开手术窗口,逐层分离并切开直至暴露关节腔,再逐层缝合,术后口服止痛药及抗生素3 d,与模型组同条件饲养。
1.4 治疗方法治疗组治疗方法如下:1)在助手帮助下将兔固定于仰卧位,指揉股四头肌及髌骨上、下极,约5 min,点按伏兔、血海、鹤顶、梁丘等穴,每穴1 min。2)沿髌韧带、髂胫束、股四头肌肌腱从上至下轻手法弹拨,并提拿髌骨。3)屈髋屈膝90°行顺时针摇膝,并配合屈伸。4)沿膝关节内外侧从前至后行擦法1 min,结束手法[9]。以上手法治疗1次/日,7 d为1个疗程,共治疗3个疗程。对照组治疗方法如下:1)将兔仰卧位固定,膝关节周围常规消毒备皮。2)髌骨外侧缘下方凹陷处,注入玻璃酸钠注射液1 mL。3)屈伸数次膝关节后纱布蒙盖注射区,每周1次,共治疗3周。模型组、假手术组、正常组与其余各组同条件饲养。
1.5 蛋白免疫印迹法检测耳缘静脉空气栓处死动物,称取20 mg组织,将组织剪碎后研磨,加200~ 400 μL裂解液,手握式电动组织细胞匀浆器匀浆1 min。12 000转离心10 min,提取上清转入离心管,考马斯亮蓝法测定样本蛋白含量。制备SDS-PAGE凝胶:配制10%分离胶4 mL,灌入凝胶槽,去离子水覆盖并室温放置45 min,配制4%浓缩胶2 mL,弃覆盖液,加入浓缩胶,凝胶约40 min,总蛋白样品与上样缓冲液混合变性后加入凝胶孔,电泳使染料至分离胶适当位置,结束电泳。半干转膜:聚偏二氟乙烯膜(PVDF膜)置于100%甲醇浸泡3 min,电转液漂洗2 min×2次,裁剪样品胶并电转液漂洗1次,样品胶与PVDF膜置转膜夹板,放入电泳槽中,130 ma,30 V,转膜30 min,置于封闭液1 h,加一抗4 ℃反应过夜,TBST洗膜3次,放入(1:3 000)二抗工作液1 h,TBST洗膜1次,曝光、洗片,image J软件分析灰度值,通过灰度分析Cav1.2,Cav1.3,Cav1.4,Cav2.1在5组软骨组织中的表达情况。
1.6 实时荧光定量检测各组软骨组织中PTHrP的表达,用超纯RNA提取试剂提取组织样本中总RNA,取5 μL RNA用1%琼脂糖凝胶进行电泳,以检测RNA的完整性,将RNA模板、引物、5×RT Buffer和RNase-freeWater溶解并置于冰上备用,向反应管中加入20 μL反应体系进行反转录,用ABI 7500型荧光定量PCR仪,设定反应条件为:预变性:95 ℃ 10 s,95 ℃ 5 s,60 ℃ 34 s,40个循环。每对引物设3个复孔。结果用ABI PRISM 7500分析,引物:PTHrP-F(5′-AGAAGAAG AAGCGGCGAACT-3′),PTHrP-R(5′-CAATGCCTC CGTGAATCGAG-3′),CollagenⅡ-F(5′-CAGGCAG AGGCAGGAAACTA-3′),CollagenⅡ-R(5′-TGACA CGGAGTAGCACCATC-3′)。
1.7 统计学方法采用SPSS18.0对数据进行统计学分析,计量资料使用均数±标准差(x±s)表示,组间比较采用单因素方差分析,组间两两比较采用LSD法,P<0.05为差异有统计学意义。
2 结果 2.1 蛋白免疫印迹法检测结果各组软骨组织中均有Cav1.2、Cav1.3、Cav1.4、Cav2.1蛋白的表达,通过灰度分析表明:正常组与假手术组Cav1.2、Cav1.3、Cav1.4、Cav2.1蛋白的表达无明显差异(P>0.05),正常组Cav1.2、Cav1.3、Cav1.4蛋白的表达高于模型组(P<0.05),模型组Cav2.1的表达高于正常组(P<0.05),治疗组、对照组Cav1.2、Cav1.3、Cav1.4蛋白的表达高于模型组,差异具有统计学意义(P<0.05),治疗组、对照组Cav2.1蛋白的表达与模型组相比无统计学差异(P>0.05)。见图 1。
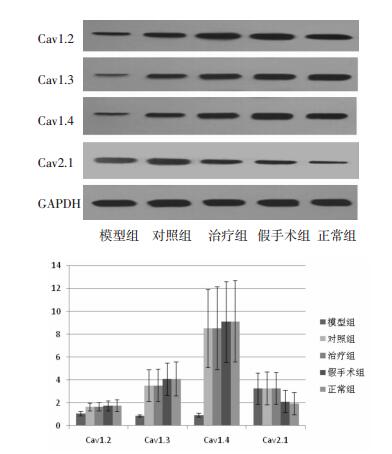
|
| 图 1 Western Blot法检测各组软骨组织中Cav1.2、Cav1.3、Cav1.4、Cav2.1蛋白的表达 Fig. 1 Expression of Cav1.2, Cav1.3, Cav1.4 and Cav2.1 protein in cartilage tissue of each group detected by Western Blot method |
各组软骨组织提取总RNA,聚合酶链式反应(PCR)检测PTHrP及CollagenⅡ蛋白的表达,实验重复3次。结果表明:正常组、假手术组PTHrP、CollagenⅡ蛋白的表达高于模型组,差异具有统计学意义(P<0.05),治疗组、对照组PTHrP、CollagenⅡ蛋白的表达均高于模型组,差异具有统计学意义(P<0.05),治疗组与对照组PTHrP、CollagenⅡ蛋白的表达相比差异无统计学意义(P>0.05)。见表 1。
| 组别 | 动物数 | PTHrP | CollagenⅡ |
| 正常组 | 10 | 1.73±0.09* | 1.77±0.02* |
| 假手术组 | 10 | 1.76±0.11* | 1.73±0.03* |
| 模型组 | 10 | 1.04±0.09 | 1.12±0.03 |
| 治疗组 | 10 | 1.64±0.15*# | 1.49±0.08*# |
| 对照组 | 10 | 1.60±0.15* | 1.48±0.06* |
| 注:与模型组比较,*P<0.05,与对照组比较,#P>0.05。 | |||
屈膝点按叩揉法、玻璃酸钠关节腔注射均可以上调软骨组织内的Cav1.2、Cav1.3、Cav1.4蛋白的表达,通过参与调控软骨内Ca2+稳态,启动下游合成代谢相关蛋白的表达,其中Cav2.1蛋白是P/Q型钙通道的亚型,P/Q型钙通道在造模后各组中的高表达,可能与细胞外高Ca2+浓度导致的选择性抑制有关。笔者推测屈膝点按叩揉法通过影响L型电压依赖性钙通道蛋白,增加细胞内Ca2+浓度,上调PTHrP蛋白的表达,进而发挥促软骨细胞合成代谢的作用。
4 讨论KOA是以关节软骨退变、骨质硬化和增生为主要特征的退行性骨关节病,临床主要表现为进行性膝关节疼痛、僵硬、肿胀、功能障碍等,严重时可导致畸形,甚至丧失关节功能。膝关节是滑膜关节,软骨组织是滑膜关节的重要组成部分,它具有复杂的力学特征和高度的耐用性,其主要功能是传导分布运动载荷、维持和承受接触应力。同时,应力是维持和诱导软骨细胞生物行为的重要因素,应力超载或负荷不足,均可使软骨基质对软骨细胞的保护作用和营养供给受到影响,从而引起软骨细胞的损伤。当软骨细胞感受力学刺激时,细胞通过启动Ca2+通道使Ca2+内流增加、浓度上升,细胞内钙库释放引发的耗竭机制扩大这一反应[10-11]。不同强度、频率的应力通过调控软骨细胞内Ca2+的平衡实现对成熟软骨生物行为的影响[12]。
软骨组织并非推拿手法的第一效应器官,前期研究发现手法通过调节膝关节周围肌肉、韧带的切线模量、拉伸强度、极限应变等力学指标改善关节整体功能。肌肉、韧带、软骨围绕下肢承重力线协同发挥作用,手法的最终目的就是改善软骨组织的应力环境,减缓软骨退变。PTHrP是软骨细胞合成代谢的重要信号蛋白,它通过与软骨细胞上的特异性蛋白结合参与细胞钙平衡的联动调节[13],由L型电压依赖性钙通道参与的钙浓度调控对这一联动机制有显著影响,这一反应在OA细胞中表现更加显著[14],PTHrP通过抑制5-氮杂胞苷调控Ⅹ型胶原(Col Ⅹ)、碱性磷酸酶(ALP)等软骨细胞肥大基因的表达,同时促进Collagen Ⅱ的表达,逆转KOA引起的异常骨吸收和软骨下骨硬化[15]。
本研究证明屈膝点按叩揉法和玻璃酸钠关节腔注射对改善软骨代谢均有帮助,但两者相比,屈膝点按叩揉法在整体调节下肢应力,改善软骨细胞生长环境方面具有更深远的意义。通过分析该手法对L型电压依赖性钙通道及细胞合成代谢相关蛋白的影响,将为进一步研究屈膝点按叩揉法防治KOA的分子机制提供依据,未来课题组将应用全细胞膜片钳、激光共聚焦等技术深入研究手法应力刺激对软骨细胞代谢的干预作用,从力学-生物信号转导方面为推拿手法防治KOA的机制研究作出贡献。
| [1] | Baker BM, Shah RP, Huang AH, et al. Dynamic tensile loading improves the functional properties of mesendrymal stem cell-laden nanofiber-based fibrocartilage[J]. Tissue Eng Part A, 2011, 17 (9-10): 1445–1455. DOI:10.1089/ten.tea.2010.0535 |
| [2] | Browning JA, Saunders K, Urban JP, et al. The influence and interactions of hydrostatic and osmotic pressure on the intracellular milieu of chondrocytes[J]. Biorheology, 2004, 41 (3-4): 299–308. |
| [3] | Shao Y, Alicknavitch M, Farach-Carson MC. Expression of voltage sensitive calcium channel (VSCC) L-type Cav1.2 (alpha1C) and T-type Cav3.2 (alpha1H) subunits during mouse bone development[J]. Dev Dyn, 2005, 234 (1): 54–62. DOI:10.1002/(ISSN)1097-0177 |
| [4] | Chen X, Maeiea CM, Nasiri A, et al. Regulation of artieular chondroeyte Proliferation and differentiation by indian hedgehogand parathyroid hormone-related protein in mice[J]. Arthritis Rheum, 2008, 58 (12): 3788–3797. DOI:10.1002/art.v58:12 |
| [5] | Bi Y, Ehirchiou D, Kilts TM, et al. Identification of tendon stem/progenitor cells and the role of the extracellular matrix in their niche[J]. Nat Med, 2007, 13 (10): 1219–1227. DOI:10.1038/nm1630 |
| [6] | 赵强, 王一洲. 伸筋易骨法治疗膝关节骨性关节炎临床观察[J]. 天津中医药, 2014, 31 (5): 275–277. |
| [7] | 张永泉. 屈膝点按扣揉法治疗膝关节骨性关节炎49例[J]. 天津中医药, 2013, 30 (4): 209–211. DOI:10.11656/j.issn.1672-1519.2013.04.07 |
| [8] | Hulth A, Lindberg L, Telhag H. Experimental Osteoar thritis in rabbits[J]. Acta Orthop Scand, 1970, 41 (5): 522–530. DOI:10.3109/17453677008991540 |
| [9] | 范围. 屈膝点按扣揉推拿手法配合微波治疗膝关节鹅足滑囊炎46例临床研究[J]. 天津中医药, 2013, 30 (9): 537–539. |
| [10] | Pedersen SF, Owsianik G, Nilius B. TRP channels: an overview[J]. Cell Calcium, 2005, 38 (5): 233–252. |
| [11] | Weick JP, Austin JM, Zhang SC. Developmental regulation of human embryonic stem cell-derived neurons by calcium entry via transient receptor potential channels[J]. Stem Cells, 2009, 27 (6): 2906–2916. |
| [12] | Mobasheri A, Lewis R, Ferreira-Mendes A, et al. Potassium channels in articular chondrocytes[J]. Channels, 2012, 6 (6): 416–425. DOI:10.4161/chan.22340 |
| [13] | 丁然, 游洪波, 李锋, 等. 脉冲磁场与前软骨干细胞向成熟软骨细胞的增殖与分化:与Ihh/PTHrP信号通路活性有关吗[J]. 中国组织工程研究与临床康复, 2010, 20 (11): 3615–3620. |
| [14] | Chang JK, Chang LH, Hung SH, et al. Parathyroid hormone 1-34 inhibits terminal differentiation of human articular chondrocytesand osteoarthritis progression in rats[J]. Arthritis Rheum, 2009, 60 (10): 3049–3060. DOI:10.1002/art.v60:10 |
| [15] | Mwale F, Yao G, Ouellet JA, et al. Effect of parathyroid hormone on type X and type Ⅱ collagen expression in mesenchymal stem cells from osteoarthritis patients[J]. Tissue Engineering Part A, 2010, 16 (11): 3449–3455. DOI:10.1089/ten.tea.2010.0091 |
2. Tianjin Academy of Traditional Chinese Medicine Affiliated Hospital, Tianjin 300120, China
 2017, Vol. 34
2017, Vol. 34