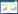文章信息
- 翟婷, 华声瑜
- ZHAI Ting, HUA Sheng-yu
- 血小板ADP受体及其拮抗剂的研究进展
- Research progress of platelet ADP receptor and its antagonist
- 天津中医药, 2017, 34(4): 280-284
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(4): 280-284
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.04.19
-
文章历史
- 收稿日期: 2016-12-31
2. 中药新药研发中心, 天津国际生物医药联合研究院, 天津 300457
血小板在凝血和止血、伤口愈合、炎症反应等生理和病理过程中占有重要作用。在正常情况下,血小板在循环血液中呈现两面微凹的椭圆形或圆盘形,一旦受到刺激,就会迅速扩展, 变形并伸出多个伪足,释放出颗粒内容物,然后相互黏附、聚集,见图 1。ADP作为血小板聚集的重要活性因子之一,它存在于血小板致密颗粒中,当血小板受到刺激被激活时ADP会被释放,并进一步激活周围循环中的血小板进而加速血小板聚集[1]。

|
| 图 1 血小板活化形态示意图 Fig. 1 Diagrammatic sketch of platelet activation form |
血小板有3种不同的ADP受体: P2Y1、P2Y12和P2X1受体[2]。P2X1系配体门控离子通道,P2Y1受体存在于血小板和血管内皮细胞,P2Y12受体存在于血小板膜上,其中P2Y1和P2Y12属于G蛋白偶联受体的嘌呤能类[3-4]。ADP引起的血小板最佳激活需要P2Y1和P2Y12的活化[5-6]。
1.1 P2Y1受体P2Y1是最早被克隆出来的受体,当受到ADP刺激后,它与Gq蛋白相偶联,激活下游通路,即可诱发G蛋白上Gα-GDP与GTP交换,成为活性状态的Gq-GTP。同时,Gq-GTP与Gβ、Gγ部分分离,并移动到邻近的βγ磷脂酶C(PLC)部位,以促进PLC使二磷酸肌醇磷脂(PIP2)水解成三磷酸肌醇(IP3)和二酰基甘油(DAG),前者可使Ca2+从细胞外流入细胞内,使细胞内Ca2+浓度升高,后者使磷酸激酶C(PKC)活性增强,从而改变血小板的形态、整合素αIIbβ3活化、血小板聚集,具体模式图如图 2。虽然引起聚集的作用比较弱,但P2Y1却是ADP和胶原诱导血小板活化起始步骤的关键受体之一。
1.2 P2Y12受体P2Y12受体是最重要的ADP受体。当P2Y12受体被激活后能抑制腺苷酸环化酶(AC)活性,进而降低cAMP水平,降低PKA活性,引起靶蛋白如血管刺激扩张磷蛋白(VASP)等磷酸化减少,解除VASP对细胞变形和聚集的抑制作用[8],增强血小板聚集。因此VASP的磷酸化是一种反应P2Y12受体激活的特异性方法,并且被广泛的应用于评价靶向于P2Y12受体的抗血小板药[9]。目前临床上开发了许多种针对P2Y12受体的药物,能有效阻碍ADP介导的信号转导,从而抑制血小板的活化和聚集,能够有效治疗心脑血管疾病。
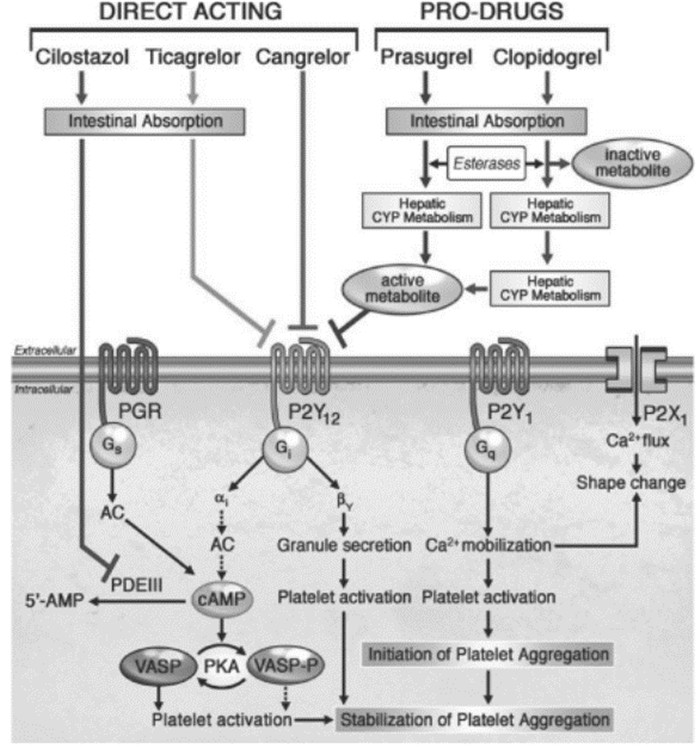
|
| 图 3 各类抑制血小板P2Y12受体的治疗方案图解(JACC Cardiovasc Interv.2011, 4:411-414.) Fig. 3 Diagraph of varieties of therapeutic regimen about platelet P2Y12 receptor in hibition |
P2X1受体主要负责ADP诱导的快速钙内流,暂时改变血小板形态,进而在其他激动剂诱发下加速血小板聚集[10]。虽然在血小板聚集中作用比较微弱[11], 但在高剪切力的条件下, 其在血栓形成中发挥着重要作用。有研究还发现P2X1受体对由胶原和肾上腺素混合注射诱导的全身性血栓栓塞以及激光诱导的肠系膜动脉血管损伤有很好的拮抗活性。此外,有报道表明:激活后的P2X1能使Ca2+内流并诱导细胞外信号调节激酶(ERK-2)活化,这对小动脉中剪切力条件下的胶原诱导的血栓形成非常重要[12]。这些研究都使得它有望成为抗血栓药物的理想靶点。
2 血小板ADP受体拮抗剂从ADP的3个受体在血小板表达数量上看,由大到小依次是P2Y12、P2Y1、P2X1;从作用程度上来说,P2Y12是ADP诱导血小板聚集反应中最重要的受体[13]。目前的ADP受体拮抗剂主要是针对P2Y12受体。
2.1 P2Y1受体桔抗剂目前这类化合物主要是核苷酸类似物,包括A2P5P(2′,5′-二磷酸腺苷)和A3P5P(3′,5′-二磷酸腺苷)以及MRS-2197,前两者是选择竞争性P2Y1拮抗剂,可抑制血小板变形和聚集,但因其抑制作用不强,口服吸收性差,限制了在临床上的应用;MRS-2197是目前发现的活性和选择性高的拮抗剂,结构上与前两者类似,在体内、体外均有很强的抗血小板聚集作用,并可延长血栓形成的时间,但由于半衰期、选择性等原因,还需要进一步的改造。还有一些化合物尚处于临床前研究阶段,比如一些合成的N-芳基或N-杂芳基取代杂环的脲及其类似物也可以作为人类P2Y1受体的选择性抑制剂。因此,P2Y1受体有可能成为合成抗血栓药物过程中的重要靶点。
2.2 P2Y12受体桔抗剂P2Y12受体拮抗剂包括噻氯匹定、氯吡格雷、普拉格雷、替卡格雷、坎格雷诺及依诺格雷,可根据其化学结构将其分为噻吩吡啶类和非噻吩吡啶类。
2.2.1 噻吩吡啶类噻氯匹啶属于第一代噻吩吡啶类药物,也是第一代P2Y12受体拮抗剂。该药为无活性的前体药物,口服后在体内通过至少5个途径代谢,产生至少13个代谢产物,并且绝大部分代谢产物没有抗血小板活性。活性代谢产物是经细胞色素P450(CYP450)代谢途径产生,通过作用于P2Y12受体,从而抑制ADP介导的血小板聚集,并且不可逆。口服吸收后作用良好,2 h后血药浓度可达到峰值,口服后1~2天开始呈现出抗血小板作用,3~5天后作用达高峰;停药后仍然发挥作用,可持续3天[14]。其不良反应较多,主要为中性粒细胞减少,在服药期间部分还会有一些胃肠道紊乱的症状。近些年来,由于其明显的副作用,逐渐退出临床。
氯吡格雷为第二代噻吩并吡啶药物,亦是无活性的前体药物,口服吸收快。通过选择性、不可逆地结合P2Y12受体,进而阻断ADP等激动剂诱导的血小板聚集, 其半衰期约为6 h,活性代谢产物半衰期为30 min,停药后5天抗血小板作用才完全消失[15-16]。在CLASSIC试验中,对冠脉支架植入患者给予氯吡格雷联合阿司匹林的治疗,结果发现,它的安全性和耐受性比噻氯匹啶联合阿司匹林都要好,并且负荷剂量下,氯吡格雷具有良好的耐受性,没有增加出血等并发症。因此,根据氯吡格雷与阿司匹林在作用机制方面的互补性,在高风险临床情况下,联合使用的有效性与安全性成为被研究的重点[17]。但是,氯吡格雷也具有严重的不良反应,包括腹痛、腹泻、消化不良等。这些不良反应的发生概率比噻氯匹啶低。
普拉格雷是第三代噻吩吡啶类药物,起效时间短,血小板抑制作用强,特异性强且不可逆。和氯吡格雷相比, 普拉格雷在体内仅需要一步P450依赖性转化就能够激活并转化为活性代谢物,口服30 min后达峰,并且呈线性增长趋势,对ADP诱导的血小板聚集作用具有更强的抑制效果[18-19]。PRINCIPLE-TIMI 44研究发现,普拉格雷在60 mg负荷剂量时,30 min后便可产生效果,血小板聚集抑制率最大可以达到74.8%,然而氯吡格雷在600 mg负荷剂量时仅达到31.8%血小板抑制率。尽管普拉格雷的激活与代谢也需要CYP450酶系的参与,但是和氯吡格雷不同的是普拉格雷发生药物相互作用的可能性比氯吡格雷要低[20-21]。
2.2.2 非噻吩吡啶类替卡格雷是首个经口服但不经肝脏P450酶代谢就可直接发挥药效,并且和P2Y12受体可逆结合的抗血小板药物,也是目前正处在研发当中的高选择性受体拮抗剂,其抑制效果比氯吡格雷要强[22]。PLATO研究中,征集18 624例患有急性冠状动脉综合征的志愿者,并且随机给予替卡格雷180 mg负荷剂量+90 mg维持剂量,每天两次,和氯吡格雷300 mg负荷剂量+75 mg维持剂量,每天一次,观察12个月,主要终点为心血管性死亡,心肌梗死或脑卒中发病率。结果相对于氯吡格雷组,替卡格雷组主要终点事件显著下降。此外, 替卡格雷组心肌梗死发生率相对下降16%,心血管病病死率下降21%,总病死率降低22%。两组间总体大出血率没有显著差异[23]。
坎格雷诺是目前正在研究当中的静脉抗血小板药物,静脉注射后几秒就开始起效,15 min后抗血小板作用便可达到最大值,30 min可达到一个稳态水平,半衰期短,约3~6 min,停止使用60 min后血小板的功能便可自行恢复。它直接作用于P2Y12受体并与其可逆性结合,竞争性抑制ADP与P2Y12受体结合,进而抑制血小板聚集反应。有研究表明,坎格雷诺对血小板聚集的抑制作用比前面提到的几种药物要强,并且具有起效快、高效性双相清除的优点[24-25]。但是,坎格雷诺也存在一些不良反应,主要为出血。目前该药也正在申请上市。
依诺格雷属于喹唑啉二酮一族,可通过口服和静脉两种方式给药,直接作用于P2Y12受体并且快速可逆结合。其不通过酶的代谢激活,所以个体间反应多样性及药物的相互作用较少。半衰期和血药浓度达峰时间与给药方式有关,如果口服给药,半衰期为11~12 h,血药浓度达峰时间为2~4 h。如果静脉给药,起效迅速,半衰期为50 min,血药浓度达峰时间为20 min[26]。目前并未出现评估依诺格雷临床疗效的大规模随机对照临床研究。因此,其临床疗效仍然需要进一步研究。相比于噻氯匹定和氯吡格雷,新一代的P2Y12受体拮抗剂具有起效快、个体差异性小、抑制作用强等优点。因此,下一步的研究工作要放在考察这些新的受体拮抗剂是否在起效更快、效果更强的同时, 不良反应也相应增加[27]。
2.3 P2X1受体拮抗剂虽然血小板上P2X1受体并不是ADP作用的主要受体,并且其血小板聚集作用也比较微弱,但是在高剪切力存在下,其表现出强有效的抗栓作用。虽然激活P2X1受体不会直接导致血小板的聚集,但它与肾上腺素和促血小板生成素发生协同作用,从而增加血小板的聚集效应。近期还发现了一种新的P2X1受体拮抗剂NF449(舒拉明的同系物),它与P2X1受体选择性结合的能力比较好。在体内实验中,对血栓栓塞的小鼠注射NF449,剂量按10 mg/kg,结果它对P2X1受体有选择性抑制作用, 而且会降低血管内的血小板聚集,并且不会延长出血时间;当剂量增加到50 mg/kg后,对3种二磷酸腺苷受体(P2Y1、P2Y12、P2X1)均有抑制作用。另一种舒拉明的同系物NF864对P2X1受体有更强的选择性拮抗作用, 目前正处在进一步的研究中[28]。
3 中草药中相关成分面对西药在起效同时会产生巨大副作用的现象,众多学者决定从中草药入手,在中药单味药、有效成分和少数复方抗血小板、防止血栓形成方面进行了有益的探索,并且目前已经取得了一定成效,有一些已经被广泛应用于临床。但是中药的化学成分复杂,所以在治疗血栓性疾病中呈现出多环节、多靶点的特点,针对性不强,各个靶向的作用强度较难评价,所以对于中草药的机制研究目前尚不完善。
3.1 中药有效成分及单体有专家发现,中药生物碱类在体外实验中表现出明显的抑制ADP、胶原、凝血酶等激动剂诱导的家兔和人的血小板聚集,并被广泛用于血栓性疾病的治疗[29]。此类化合物包括川芎嗪(Ligustrazine)、钩藤碱(Rhy)、小檗碱(Berberine, Ber),还有王辉等发现的莲心碱(Nef)。特别是它可能是通过抑制P2Y1受体发挥抗血小板作用的,它可抑制不同时间点的ADP诱导的血小板聚集,降低最大聚集率[30]。陈元元等[31]发现毛冬青总提取物对模型动物体内血栓形成有显著的抑制作用,表现出一定的抗血栓、改善血管内皮的受损程度、保护血管内皮的作用;经过研究还发现其抗血栓机制可能是通过抑制血小板的聚集,进而影响P2Y12受体αGi亚单位和βγ亚单位的功能而抑制血栓的形成。
3.2 单味中药根据以往的研究数据表明, 川芎、当归、赤芍、丹参、三七、桃仁、红花等活血化瘀药均具有较强的抗血小板聚集和释放作用。川芎煎剂或提取物川芎嗪注射液所做的实验表明:川芎嗪不仅能延长体外实验中由诱导剂诱导的血小板凝聚时间, 并且对已聚集的血小板有解聚作用。川芎嗪可使血小板中cAMP含量升高近l倍, 从而抑制血小板聚集、释放反应。其可活化细胞膜上的“钙泵”, 降低血小板内Ca2+浓度, 然后阻断Ca2+对血小板的激活和PG代谢,显示川芎嗪有类似钙拮抗剂的作用[32]。
3.3 中药复方孙沛等[33]观察丹红注射液对冠状动脉粥样硬化性心脏病患者血小板聚集率的影响,结果表明,相较于治疗前,丹红注射液治疗后,花生四烯酸及ADP诱导的血小板聚集率水平均降低。另有研究表明,逐瘀通脉胶囊能抑制ADP诱导的大鼠血小板聚集,减轻急性血瘀模型大鼠体外血栓长度、减少血栓干湿重,从而在治疗血瘀证中发挥着显著作用[34]。王东生等[35]研究发现, 大黄蜇虫丸不仅在体外实验中能明显抑制ADP诱导的血小板活化,在体内研究中也可抑制冠心病及脑梗死患者血小板活化, 并且效果明显优于阿司匹林, 可作为理想的抗血栓药物。还有很多中药静脉制剂如红花黄色素、瓜萎皮注射液、银杏达莫注射液等均有相关报道具有抑制血小板聚集作用[36-37]。
4 结语目前,随着市场上抗血栓药物容量的不断增长,抗血小板聚集药在心血管血栓栓塞初期预防和急性冠脉综合征及经皮冠脉介入治疗术后的二级预防中起着举足轻重的作用。因此由ADP诱导血小板聚集的关键作用也受到了越来越多人的重视,人们对ADP受体的研究也逐渐深入,但是目前该类药物仍然存在着一些疗效及安全性等方面的问题,因此,研究更加安全、可靠、有效的ADP受体拮抗剂也成为重要的研究目标,这为研究人员指明了方向。所以在进一步的研究中:要做到以下几点:一是对目前市场上已经存在的药物进行优化,降低药物的不良反应,联合使用多种不同作用机制的抗血小板药物,寻找合适的配比,同时积极寻找新的靶点;二是利用传统活血化瘀中药抗血小板聚集的多靶点多途径的优势[38],采用中西药结合的手段治疗血栓性疾病;三是开发一些高效、可靠、稳定、不良反应少的中药单体及制剂,并广泛应用于临床,减轻患者痛苦。
| [1] | Gachet C. Regulation of platelet unctions by P2 receptors[J]. Annu Rev Pharmacol Toxicol, 2006, 46 : 277–300. DOI:10.1146/annurev.pharmtox.46.120604.141207 |
| [2] | 石方牛, 徐为人, 张士俊, 等. ADP受体阻滞剂的研究进展[J]. 心血管病学进展, 2007, 28 (1): 130–133. |
| [3] | Cattaneo M, Gachet C. ADP receptors and clinical bleeding disorders[J]. Arterioscler Thromb Vase Biol, 1999, 19 (10): 2281–2285. DOI:10.1161/01.ATV.19.10.2281 |
| [4] | Hollopeter G, Jantzen HM, Vincent D, et al. Identification of platelet ADP receptor targeted by antithrombotic drugs[J]. Nature, 2001, 409 (6817): 202–207. DOI:10.1038/35051599 |
| [5] | Zhang FL, Luo L, Gustafson E, et al. ADP is the cognate ligand for the orphan G-protein coupled receptor SP1999[J]. J Biol Chem, 2001, 276 (11): 8608–8615. DOI:10.1074/jbc.M009718200 |
| [6] | Jin J, Kunapuli SP. Coactivation of two different G protein-coupled receptors is essential for ADP-induced platelets aggregation[J]. Proc Natl Acad Sci USA, 1998, 95 (14): 8070–8074. DOI:10.1073/pnas.95.14.8070 |
| [7] | 王杰, 魏云林. 基于P2Y1受体药物研究进展[J]. 药物生物技术, 2016, 23 (2): 159–163. |
| [8] | Wang TT, Li K, Wei L. Role of vasodilator-stimulated phospho-protein in the regulation of cytoskeletal[J]. Progphysiol Sci, 2006, 37 (1): 27–30. |
| [9] | Liu L, Li J, Zhang Y, et al. Salvianolic acid B inhibits platelets as a P2Y12 antagonist and PDE inhibitor: evidence from clinic to laboratory[J]. Thrombosis Research, 2014, 134 (4): 866–876. DOI:10.1016/j.thromres.2014.07.019 |
| [10] | 周莹, 冯明声, 姚其正. 抗血小板药物研究进展[J]. 中国医药指南, 2012, 10 (5): 9–12. |
| [11] | Mahaut SM, Jones S, Evans R. The P2X1 receptor and platelet function[J]. Purinerg Signal, 2011, 7 (3): 341–356. DOI:10.1007/s11302-011-9224-0 |
| [12] | Oury C, Toth ZE, Vermylen J, et al. P2X1-mediated activation of extracellular signal-regulated kinase 2 contributes to platelet secretion and aggregation induced by collagen[J]. Blood, 2002, 100 (7): 2499–2505. DOI:10.1182/blood-2002-03-0812 |
| [13] | Hollopeter G, Jantzen HM, Vincent D, et al. Identification of the platelet ADP receptor targeted by antithrombotic drugs[J]. Nature, 2001, 409 (6817): 202–207. DOI:10.1038/35051599 |
| [14] | Knudsen JB, Bastain W, Sefton CM, et al. Pharmacokinetics of ticlopidine during chronic oral administration to healthy volunteers and its effects Onantipyrine Pharmacokinetics[J]. Xenobiotica, 1992, 22 (5): 579–589. DOI:10.3109/00498259209053121 |
| [15] | Nguyen TA, Diodati JG, Pharand C. Resistance to clopidogrel: a review of the evidence[J]. J Am Coll Cardiol, 2005, 45 (8): 1157–1164. DOI:10.1016/j.jacc.2005.01.034 |
| [16] | Feher G, Feher A, Pusch G, et al. Clinical importance of aspirin and clopidogrel resistance[J]. World J Cardiol, 2010, 2 (7): 171–186. DOI:10.4330/wjc.v2.i7.171 |
| [17] | Lepatalo A, Virtanen AS, Resndiz JC, et al. Antiplatelet effect of clopidogrel in patients with aspirin therapy undergoing percutaneous coronary interventions--limited inhibition of the P2Y12 receptor[J]. Thrombosis Research, 2009, 124 (2): 193–198. DOI:10.1016/j.thromres.2009.01.009 |
| [18] | Farid NA, Smith RL, Gillespie TA, et al. The disposition of prasugrel, a novel thienopyridine in humans[J]. Drug Metab Dispos, 2007, 35 (7): 1096. DOI:10.1124/dmd.106.014522 |
| [19] | Ogawa T, Hashimoto M, Niitsu Y, et al. Effects of prasugrel, a novel P2Y12 inhibitor, in rat models of cerebral and peripheral artery occlusive diseases[J]. European journal of pharmacology, 2009, 612 (1-3): 29–34. DOI:10.1016/j.ejphar.2009.03.073 |
| [20] | Farid NA, Small DS, Payne CD, et al. Effect of atorvastatin on the pharmacokinetics and pharmacodynamics of prasugrel and clopidogrel inhealthy subjects[J]. Pharmaco therapy, 2008, 28 (12): 1483–1494. DOI:10.1592/phco.28.12.1483 |
| [21] | Small DS, Farid NA, Li YG, et al. Effect of ranitidine on the pharmacokinetics and pharmacodynamics of prasugrel and clopidogrel[J]. Curr Med Res Opin, 2008, 24 (8): 2251–2257. DOI:10.1185/03007990802205985 |
| [22] | Storey RF, Husted S, Harrington RA, et al. Inhibition of platelet aggregation by AZD6140, a reversible oral P2Y12 receptor antagonist, compared with clopidogrel in patients with acute coronary syndromes[J]. J Am Coll Cardiol, 2007, 50 (19): 1852–1856. DOI:10.1016/j.jacc.2007.07.058 |
| [23] | Wallentin L, Becker RC, Budaj A, et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes[J]. N Engl J Med, 2009, 361 (11): 1045–1057. DOI:10.1056/NEJMoa0904327 |
| [24] | Damman P, Woudstra P, Kuijt WJ, et al. P2Y12 platelet inhibition in clinical practice[J]. J Thromb Thrombolysis, 2012, 33 (2): 143–153. DOI:10.1007/s11239-011-0667-5 |
| [25] | Bhatt DL, Lincoff AM, Gibson CM, et al. Intravenous platelet blockade with cangrelor during PCI[J]. N Engl J Med, 2009, 361 (24): 2330–2341. DOI:10.1056/NEJMoa0908629 |
| [26] | Gurbel PA, Bliden KP, Antonino MJ, et al. The effect of elinogrel on high platelet reactivity during dual antiplatelet therapy and the relation to CYP2C19*2 genotype: first experience in patients[J]. J Thromb Haemost, 2010, 8 (1): 43–53. DOI:10.1111/jth.2009.8.issue-1 |
| [27] | Flaumenhaft R, Dilks JR. Discovery-based strategies for studying platelet function[J]. Mini Rev Med Chem, 2008, 8 (4): 350–357. DOI:10.2174/138955708783955971 |
| [28] | Horner S, Menke K, Hildebrandt C, et al. The novel suramin analogue NF864 selectively blocks P2X1 receptors in human platelets with potency in the low nanomolar range[J]. Naunyn-Schmiedebergs Arch Pharmacol, 2005, 372 (1): 1–13. DOI:10.1007/s00210-005-1085-z |
| [29] | Meri S. Complement activation in diseases presenting with thrombotic Microangiopathy[J]. European J Inter Med, 2013, 24 (6): 496–502. DOI:10.1016/j.ejim.2013.05.009 |
| [30] | 王辉, 刘刚, 罗顺德, 等. 莲心碱对血小板聚集、凝血功能和血栓形成的影响[J]. 中国药理学通报, 2010, 26 (6): 768–772. |
| [31] | 陈元元, 熊天琴, 赵玉民, 等. 毛冬青总提取物的抗血栓作用及基于ADP的机制研究[J]. 中华中医药学刊, 2015 (5): 1092–1096. |
| [32] | 柳吉玲. 活血化瘀药抗血栓作用的研究进展[J]. 中国当代医药, 2013, 20 (35): 15–17. |
| [33] | 孙沛, 张金花. 丹红注射液对冠状动脉粥样硬化性心脏病患者血小板聚集率的影响[J]. 河北医药, 2010, 32 (9): 1133. |
| [34] | 白黎明, 张晓双. 逐瘀通脉胶囊对大鼠血小板聚集、体外血栓形成及血液流变学的影响[J]. 河南中医, 2009, 29 (10): 2009. |
| [35] | 王东生, 陈方平, 贺石林, 等. 大黄蜇虫丸抗血小板活化的机制研究[J]. 中国中医药杂志, 2008, 23 (9): 818–821. |
| [36] | 郭张强, 成忠, 李论, 等. 红花黄色素注射液对急性非ST段抬高型心肌梗死患者血小板聚集率和转化生长因子β1的影响[J]. 临床心血管病杂志, 2010, 26 (8): 591–592. |
| [37] | 王姗姗. 瓜萎皮的药理作用及其临床应用[J]. 山西医药杂志, 2009, 38 (1): 67. |
| [38] | Wang FQ, Chen C, Xia ZN, et al. Application of platelets in studies on the traditional Chinese medicines promoting blood circulation to remove blood stasis[J]. Chin J Mater Med, 2014, 39 (16): 2993–3003. |
2. Research and Development Center of Traditional Chinese Medicine, Tianjin International Joint Academy of Biotechnology and Medicine, Tianjin 300457, China
 2017, Vol. 34
2017, Vol. 34