文章信息
- 刘金畅, 王涛
- LIU Jin-chang, WANG Tao
- 治疗高尿酸血症药物研发现状与思考
- Present research situation and thinking of drug in treating hyperuricemia
- 天津中医药, 2017, 34(5): 291-294
- Tianjin Journal of Traditional Chinese Medicine, 2017, 34(5): 291-294
- http://dx.doi.org/10.11656/j.issn.1672-1519.2017.05.02
-
文章历史
- 收稿日期: 2017-01-10
高尿酸血症表现为血液尿酸水平高于正常值,当男性血清尿酸高于417 μmol/L,女性高于357 μmol/L时,临床定义为高尿酸血症。虽然高尿酸血症不属于致命性疾病,但能诱发多种重大疾病,其最常见的临床表现—痛风,发病期间严重影响患者的生存质量。文章综述了近年来对高尿酸血症的发病机制研究进展及新药研究概况,对中药治疗高尿酸血症特点进行了分析,为基于临床有效中药开发治疗高尿酸血症新药提供思路和参考。
近年来高尿酸血症发病率逐年升高,美国国家健康和营养调查显示,在1988—1994年期间,美国高尿酸血症的患病率为3.2%,而在2007—2008年间,高尿酸血症的患病率上升至21.4%[1]。流行病调查结果表明,中国过去10年里,男性高尿酸血症发病率为15.0%,女性为7.3%[2],内蒙古地区男性发病率最高,约为17.7%[3]。
痛风常由体内尿酸长期保持高水平蓄积而引起,是高尿酸血症最常见的临床表现,伴随剧烈的关节疼痛,及关节周围组织红肿等不适症状,对患者生活质量影响较大[4]。此外,高尿酸血症还会引起循环系统功能障碍,诱发高血压、糖尿病、心血管疾病、慢性肾功能衰竭等[5]。
1 虽然高尿酸血症发病机制相对简单,但治疗药物不能满足临床需求高尿酸血症的形成主要与尿酸过度产生和尿酸排泄不足有关。尿酸是人体内嘌呤代谢的终产物,大部分在肝脏中形成,小部分在肠道中产生[6]。尿酸过度产生的主要机制为,次黄嘌呤-鸟嘌呤磷酸核糖转移酶的部分缺乏,减弱了对嘌呤代谢的负反馈调节作用,使尿酸生成增多,黄嘌呤氧化酶(XOD)活性代偿性增高,致使尿酸水平上升[7]。
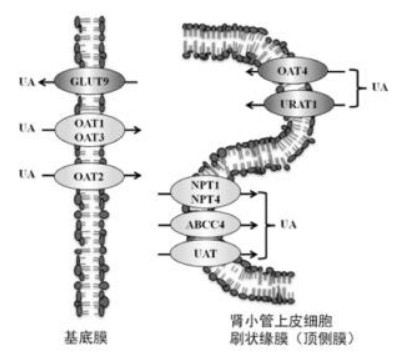
肾脏和小肠是尿酸排泄的重要器官,相关转运体功能障碍引起尿酸排泄不足,诱发高尿酸血症。肾脏承担约70%的尿酸排泄作用,这个过程主要由尿酸转运蛋白将尿酸由血液排出体外。尿酸转运蛋白分为重吸收蛋白和分泌蛋白两大类,重吸收蛋白包括尿酸盐转运体1(URAT1)、葡萄糖转运体9(GLUT9)和有机阴离子转运体OAT-4。Enomoto [8]等人首次发现人类肾脏中存在URAT1,该蛋白在近曲小管内重吸收尿酸的量高达50%左右,对调节体内尿酸起着至关重要的作用。URAT1通过介导管腔内的尿酸与近曲小管上皮细胞内无机阴离子、有机阴离子(乳酸盐和盐酸盐)的交换,依赖于管腔两侧的浓度梯度和电化学梯度,将尿酸从管腔内重吸收至上皮细胞[9]。URAT1将尿酸吸收到基底外侧膜以后,由GLUT9将尿酸转移至肾间质[10],完成尿酸从尿液到血液的重吸收过程。尿酸分泌蛋白包括OAT1、OAT3,多药耐药蛋白4和磷酸盐转运蛋白1/4等,见图 1。已有较多文献对此进行了综述[11]。
|
| 图 1 肾脏尿酸重吸收作用机制图 Fig. 1 Mechanism of renal re-absorption of uric acid UA:尿酸;GLUT9:葡萄糖转运体9;OAT1:有机阴离子转运体1;OAT3:有机阴离子转运体3;OAT2:有机阴离子转运体2;OAT4:有机阴离子转运体4;URAT1:尿酸盐转运蛋白1;NPT1:磷酸盐转运蛋白1;NPT4:磷酸盐转运蛋白4;ABCC4:多药耐药相关蛋白4;UAT:尿酸盐转运体 |
肠道也是尿酸排泄的一个重要途径,其排泄量占尿酸总排泄量的30%,但对其机制研究相对较少。转运蛋白有三磷酸腺苷结合盒转运体G2(ABCG2)在这个过程中发挥主要作用[12]。ABCG2蛋白来源于ABC家族,是一种以同型二聚体为活化形式的半转运蛋白。研究表明[13],血清尿酸升高可引起回肠中ABCG2 mRNA的上调,进而增加肠道对尿酸的排泄。ABCG2功能发生障碍会引起尿酸肠道排泄不足,引发高尿酸血症[14]。
针对高尿酸血症发病机制,临床常用药物可分为抑制尿酸形成和促进尿酸排泄两类。别嘌醇是临床一线抑制尿酸形成类药物,能够通过抑制XOD活性来减少次黄嘌呤和黄嘌呤向尿酸转化,降低了体内尿酸水平,但临床研究表明,别嘌醇对高尿酸血症患者的有效率仅为40%,说明大多数患者发生高尿酸血症的主要原因并不完全在于尿酸过度产生[15]。长期使用别嘌醇会引起药疹、发热、肝肾功能损害、胃肠道反应或超敏反应综合征[16-17]。促进尿酸排泄药物主要包括苯溴马隆、丙磺舒等,可以通过增加尿量、抑制部分转运体对尿酸的重吸收降低体内尿酸水平,长期服用苯溴马隆可引起线粒体功能障碍,产生肝毒性[18]。肾功能不全患者服用丙磺舒降尿酸作用不明显。
由此可见,虽然高尿酸血症发病机制相对明确,但临床治疗药物种类较少,特别值得注意的是,临床通过限制高嘌呤食物摄取,也可以一定程度缓解尿酸的过度产生,对促进尿酸排泄药物的需求大于减少尿酸产生药物。开发促进尿酸排泄新药具有较好的临床应用前景。
2 促进尿酸排泄是目前治疗高尿酸血症药物研发的热点目前在研促进尿酸过度产生药物相对较少,继别嘌醇之后,日本武田制药株式会社开发了非布索坦,其作用强度是别嘌醇的4倍以上,基本满足了临床对该靶点药物的需求,已在欧美上市销售,目前尚无严重临床不良反应的报道[19]。促进尿酸排泄药物是治疗高尿酸血症研发主流,2002年发现的URAT1成为了研发热点。原有一线促进尿酸排泄药物苯溴马隆、丙磺舒具有一定抑制URAT1活性的作用,但特异性不强[20],多个药物原研企业合成了大量URAT1抑制剂,已有多个新药完成了临床前研究,进入临床试验阶段。美国Ardea Biosci Inc.公司开发了RDEA系列药物,包括RDEA594、806、3170等,其中Lesinurad(RDEA594)已完成3期临床试验[21],2015年获得美国FDA批准上市,商品名为Zurampic,随机临床试验显示,高尿酸血症患者相应率高于60%。另外,其他URAT1抑制剂如Arhalofenate、Tranilast、Levotofisopam、KX1151等均已进入2期临床研究阶段。
3 中药调节高尿酸血症活性成分不断被发现中医将湿热、痰浊、瘀血、肝脾肾不足视为高尿酸血症的主要病因病机,临床表现为湿热蕴结、瘀热阻滞、痰浊阻滞和肝肾阴虚[22]。常用萆薢分清饮、泄浊除痹方、祛浊通痹汤、活血四妙汤、萆薢车前茯苡汤、五苓散、虎杖萆薢汤、祛湿化瘀通络方、复方青秦制剂等复方加减治疗高尿酸血症,且疗效显著。
随着对中药药效物质基础和高尿酸血症发病机制的深入研究,从中医临床常用治疗高尿酸血症药物中,发现了一些活性成分。例如:姜黄素环己酮衍生物口服给药7 d后,能降低血清中尿酸水平,下调转运蛋白URAT1表达,抑制XOD活性[23]。绵萆薢及其主要成分薯蓣皂苷对氧嗪酸钾诱导的高尿酸血症小鼠连续口服给药10 d后,下调URAT1表达,上调分泌型OAT1及有机阳离子转运蛋白2(OCT2),降低血清中尿酸及肌酐水平[24]。甜菜碱对氧嗪酸钾诱导的高尿酸血症小鼠口服给药7 d后,能显著增加尿酸的排泄,降低血清中尿酸水平,下调URAT1及GLUT9,上调OCT-1,肉碱/有机阳离子转运蛋白1(OCTN1)和OCTN2的表达,改善肾功能,提高机体尿酸盐排泄能力[25]。荷叶碱对氧嗪酸钾诱导的高尿酸血症小鼠口服给药7 d后,下调URAT1,上调ABCG2,OAT1,OCT2,OCTN1,OCTN2,抑制Toll样受体4/骨髓分化因子88/NF-κB(TLR4/MyD88/NF-κB)信号传导,降低血清中尿酸和肾白细胞介素-1β(IL-1β)水平[26]。由此可见,中药调节高尿酸血症疗效确切,其活性成分具有较好的新药开发前景。
4 治疗高尿酸血症中药研究中存在的问题目前为止,无论是在抑制尿酸产生,还是在抑制尿酸重吸收方面,从中药中发现的活性化合物在作用强度与合成药物相比差异较大,部分活性单体化合物的溶解度、稳定性、生物利用度、靶标特异性限制了进一步研究与开发,成药前景并不乐观。围绕单一靶点试图从中药中发现治疗高尿酸血症前体化合物或创新药物意义不大,且割裂了中医药整体观,研究成果难以对临床组方用药提供科技支撑。
高尿酸血症的发生和发展是一个复杂过程,是由于嘌呤代谢整体网络的多个靶点失衡引起的代谢性疾病,结合中药多成分、多靶点的作用优势开展针对高尿酸血症的复杂机制的综合调节作用研究,有望发现创新药物,指导临床合理用药。
5 基于临床治疗高尿酸血症药物研发思路在抑制尿酸形成方面,由于发病机制相对单一,合成药物通过结构设计能高效率的发现特异性强XOD抑制剂,与此相比,中药不具备优势。临床与基础研究结果表明,中医药治疗高尿酸血症的优势可能在于促进尿酸排泄。肾脏和肠道是尿酸外排的两个主要器官,涉及多种尿酸外排蛋白,特别是肾脏,尿酸外排蛋白涉及多个蛋白质家族,生物学网络特点明显,中药化学成分多样,虽然某个化学成分对某个靶点作用较弱,但可能对多个靶点发挥弱作用,或多个成分同时对某个靶点形成作用合力,降尿酸活性会显著增强。在合成药品研发过程中也有类似现象,Tranilast对URAT1和GLUT9两个靶点同时具有抑制作用,KX1151能同时抑制URAT1和XOD,两种药物虽然针对URAT1靶点与RDEA系列相比活性较弱,但是整体降低血尿酸作用很强。目前均已进入2期临床试验阶段。
如何揭示中药治疗高尿酸血症多成分、多靶点整合作用特性,是目前亟待解决的问题。复方中药中化学成分种类繁多,如果用单一成分对各个尿酸转运体进行活性评价,工作量巨大。可以参考已发布的蛋白质结构,采用计算机辅助设计的方法进行初步筛选,再用体内外活性评价方法进行验证,提高活性成分发现效率。
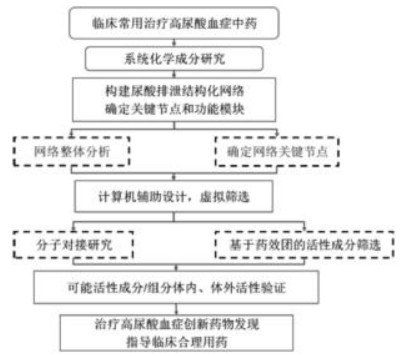
通过中药化学、网络药理学、计算机辅助设计、分子生物学等多学科交叉,将网络药理学研究方法介入治疗高尿酸血症中药药效物质与作用机制研究,深入揭示调节尿酸代谢异常药效物质及作用机制,见图 2。将不同功效药物调节尿酸代谢异常药效物质基础、作用机制数据进行整理、分析和比较,进一步分析尿酸代谢网络协同作用,一方面可以从临床经验中发现调节尿酸代谢异常新靶点,研制创新药物,另一方面可以指导中药临床合理用药。
|
| 图 2 基于临床有效中药发现治疗高尿酸血症创新药物模式 Fig. 2 Model of anti-hyperuricemia drug discovery based on clinically effective traditional Chinese medicine |
| [1] | Zhy Y, Pandya BJ, Choi HK. Prevalence of gout and hyperuricemia in the US general population:the national health and nutrition examination survey 2007-2008[J]. Arthritis Rheum, 2011, 63 (10): 3136–3141. DOI:10.1002/art.30520 |
| [2] | Yu S, Yang H, Guo X, et al. Prevalence of hyperuricemia and its correlates in rural Northeast Chinese population:from lifestyle risk factors to metabolic comorbidities[J]. Clin Rheum Atol, 2016, 35 (5): 1207–1215. DOI:10.1007/s10067-015-3051-6 |
| [3] | You L, Liu A, Wu YG, et al. Prevalence of hyperuricemia and the relationship between serum uric acid and metabolic syndrome in the Asian Mongolian area[J]. J Atheroscler Thromb, 2014, 21 (4): 355–365. DOI:10.5551/jat.20529 |
| [4] | Cristóbal-García M, García-Arroyo FE, Tapia E, et al. Renal oxidative stress induced by long-term hyperuricemia alters mitochondrial function and maintains systemic hypertension[J]. Oxid Med Cell Longev, 2015 (47): 1–8. |
| [5] | Kumar R, Khalsa DD, Carmody JB. Serum uric acid and hyperuricemia in US adolescents:40-year trends[J]. Clin Exp Rheumatol, 2016, 34 (1 Suppl 95): 22–23. |
| [6] | Richette P, Bardin T. Gout[J]. Lancet, 2010, 375 (9711): 318–328. DOI:10.1016/S0140-6736(09)60883-7 |
| [7] | Hao S, Zhang C, Song H. Natural Products Improving Hyperuricemia with Hepatorenal Dual Effects[J]. Evid Based Complement Alternat Med, 2016, 2016 (10): 1–7. |
| [8] | Enomoto A, Kimura H, Chairoungdua A, et al. Molecular identification of a renal urate-anion exchanger that regulates blood urate levels[J]. Nature, 2002, 417 (6887): 447–452. |
| [9] | Merriman TR. An update on the genetic architecture of hyperuricemia and gout[J]. Arthritis Res Ther, 2015, 17 (1): 98–110. DOI:10.1186/s13075-015-0609-2 |
| [10] | Anzai N, Ichida K, Jutabha P, et al. Plasma urate level is directly regulated by a voltage-driven urate efflux transporter URATv1(SLC2A9) in humans[J]. J Biol Chem, 2008, 283 (40): 26834–26838. DOI:10.1074/jbc.C800156200 |
| [11] | Otani N, Ouchi M, Hayashi K, et al. Roles of organic anion transporters (OATs) in renal proximal tubules and their localization[J]. Anat Sci Int, 2017, 92 (2): 200–206. DOI:10.1007/s12565-016-0369-3 |
| [12] | Ichida K, Matsuo H, Takada T, et al. Decreased extra-renal urate excretion is a common cause of hyperuricemia[J]. Nat Commun, 2011, 3 (1): 764–770. |
| [13] | Nagura M, Tamura Y, Kumagai T, et al. Uric acid metabolism of kidney and intestine in a rat model of chronic kidney disease[J]. Nucleosides, Nucleotides and Nucleic Acids, 2016, 35 (10-12): 550–558. DOI:10.1080/15257770.2016.1163379 |
| [14] | Xu X, Li C, Zhou P, et al. Uric acid transporters hiding in the intestine[J]. Pharm Biol, 2016, 54 (12): 3151–3155. DOI:10.1080/13880209.2016.1195847 |
| [15] | Halevy S, Ghislain PD, Mockenhaupt M, et al. Allopurinol is the most common cause of Stevens-Johnson syndrome and toxic epidermal necrolysis in Europe and Israel[J]. J Am Acad Dermatol, 2008, 58 (1): 25–32. DOI:10.1016/j.jaad.2007.08.036 |
| [16] | Min HK, Lee B, Kwok SK, et al. Allopurinol hypersensitivity syndrome in patients with hematological malignancies:characteristics and clinical outcomes[J]. Korean J Intern Med, 2015, 30 (4): 521–530. DOI:10.3904/kjim.2015.30.4.521 |
| [17] | Mancano MA. Risk Factors for Androgen Deficiency with Daily Opioid Use; Co-trimoxazole and Sudden Cardiac Death in Patients Receiving ACE Inhibitors; Clindamycin-Induced Myelosuppression; Apixaban-Induced Diffuse Alveolar Hemorrhage; DRESS Syndrome Induced by Allopurinol[J]. Hosp Pharm, 2015, 50 (3): 189–193. DOI:10.1310/hpj5003-189 |
| [18] | Shirakawa M, Sekine S, Tanaka A, et al. Metabolic activation of hepatotoxic drug (benzbromarone) induced mitochondrial membrane permeability transition[J]. Toxicol Appl Pharmacol, 2015, 288 (1): 12–18. DOI:10.1016/j.taap.2015.06.018 |
| [19] | Ojha R, Singh J, Ojha A, et al. An updated patent review:xanthine oxidase inhibitors for the treatment of hyperuricemia and gout (2011-2015)[J]. Expert Opin Ther Pat, 2017, 27 (3): 311–345. DOI:10.1080/13543776.2017.1261111 |
| [20] | Nindita Y, Hamada T, Bahrudin U, et al. Effect of losartan and benzbromarone on the level of human urate transporter 1 mRNA[J]. Arzneimittelforschung, 2010, 60 (4): 186–188. |
| [21] | Shahid H, Singh JA. Investigational drugs for hyperuricemia[J]. Expert Opin Investig Drugs, 2015, 24 (8): 1013–1030. DOI:10.1517/13543784.2015.1051617 |
| [22] | 倪青, 孟祥. 高尿酸血症和痛风中医认识与治疗[J]. 北京中医药, 2016, 36 (6): 529–535. |
| [23] | Ao GZ, Zhou MZ, Li YY, et al. Discovery of novel curcumin derivatives targeting xanthine oxidase and urate transporter 1 as anti-hyperuricemic agents[J]. Bioorg Med Chem, 2017, 25 (1): 166–174. DOI:10.1016/j.bmc.2016.10.022 |
| [24] | Su J, Wei Y, Liu M, et al. Anti-hyperuricemic and nephroprotective effects of Rhizoma Dioscoreae septemlobae extracts and its main component dioscin via regulation of mOAT1, mURAT1 and mOCT2 in hypertensive mice[J]. Arch Pharm Res, 2014, 37 (10): 1336–1344. DOI:10.1007/s12272-014-0413-6 |
| [25] | Liu YL, Pan Y, Wang X, et al. Betaine reduces serum uric acid levels and improves kidney function in hyperuricemic mice[J]. Planta Med, 2014, 80 (1): 39–47. |
| [26] | Wang MX, Liu YL, Yang Y, et al. Nuciferine restores potassium oxonate-induced hyperuricemia and kidney inflammation in mice[J]. Eur J Pharmacol, 2015, 747 : 59–70. DOI:10.1016/j.ejphar.2014.11.035 |
 2017, Vol. 34
2017, Vol. 34